Как получить выписку из ЕГРЮЛ по ИНН бесплатно
Заказать выписку из ЕГРЮЛ по ИНН можно несколькими способами, часть из которых бесплатна. Выписки, в зависимости от способа их оформлении, могут отличаться спектром применения, так как некоторые могут быть действительны только в электронном формате. Выбор варианта оформления документа всегда соотносится с целями субъекта хозяйствования.
Когда нужна выписка из ЕГРЮЛ
Зачем может понадобиться выписка из Госреестра предприятий:
-
участие компании в аукционах, тендерах;
-
подтверждение действительности регистрации при заключении крупной сделки;
-
судебное разбирательство, участником которого выступает юридическое лицо;
-
оформление разрешительной документации на ведение лицензируемой деятельности;
-
нотариальное заверение документов;
-
реорганизация фирмы;
-
открытие счетов в банках и т.
 д.
д.
Чаще всего выписка из ЕГРЮЛ по ИНН оформляется для того, чтобы соблюсти принцип должной осмотрительности. Таким способом субъекты предпринимательства проверяют достоверность сведений о своих контрагентах. В этом случае достаточно бесплатной выписки, но в некоторых ситуациях не обойтись без бумажного экземпляра, заверенного печатью регистрирующего органа – этот документ выдается только после уплаты госпошлины.
Как получить выписку из ЕГРЮЛ по ИНН
Как может быть получена выписка из ЕГРЮЛ:
-
бесплатно по ИНН документ формируется на сайте налоговой службы, результатом будет электронная выписка, заверенная ЭЦП ИФНС;
-
официальная выписка из ЕГРЮЛ по ИНН может быть заказана в любом отделении ИФНС независимо от места регистрации юридического лица;
-
через МФЦ;
-
через частные посреднические организации (эта услуга всегда платная, в стоимость закладывается не только размер госпошлины, но и вознаграждение исполнителя).

Выписка на бумаге
Если обращаться в ИФНС лично или в МФЦ, то оформляется бумажная выписка. Она выдается заявителю на руки или отправляется по почте. Такой документ может быть использован в любых сделках. Чтобы заказать выписку в бумажном виде, надо составить официальный запрос – заявление, в котором должны быть указаны следующие данные:
-
цели получения документа;
-
реквизиты юридического лица, по которому требуется выписка;
-
способ получения готового документа;
-
в скольких экземплярах нужна выписка из ЕГРЮЛ;
-
тип документа – срочная выписка, обычная, расширенная.
К заявлению прикладывается документ, удостоверяющий факт уплаты заявителем госпошлины. Если платежная форма не приложена, налоговый орган создает запрос в Казначейство и самостоятельно проверит, были средства оплачены или нет.
Сроки оформления выписки зависят от указанного в заявлении типа. Если речь идет о срочной выписке, то она будет готова на следующий день после получения налоговиками запроса. Обычная выписка оформляется в 5-тидневный срок. От срочности зависит и размер госпошлины. Сумма государственной пошлины установлена правительственным Постановлением от 19.05.2014 г. № 462:
Электронная выписка
Если документ нужен в сжатые сроки и не обязательно требуется бумажный вариант (устраивает электронная выписка из ЕГРЮЛ), сайт налоговой по ИНН предоставляет возможность заказать документ бесплатно. Такая информация выдается в режиме онлайн, услугой могут воспользоваться любые заинтересованные лица. База данных ЕГРЮЛ обновляется ежедневно, поэтому получаемые в выписке сведения всегда будут достоверными.
На сайте налог.ру выписка из ЕГРЮЛ по ИНН заказывается в онлайн-режиме, уплата госпошлины не требуется.
На экран выводится название фирмы, ее адрес, регистрационные реквизиты, ФИО руководителя. Справа от текстового блока появится кнопка «Получить выписку», после нажатия на которую сформируется документ. Далее можно скачать выписку из ЕГРЮЛ бесплатно по ИНН, ее можно сохранить на ПК в формате PDF или открыть в онлайн-режиме для просмотра. В документе отражается широкий спектр информации о предприятии, включая зарегистрированные по нему направления деятельности. Такая выписка равнозначна бумажному документу.
Получить выписку из ЕГРЮЛ по ИНН бесплатно можно без регистрации на сайте ФНС, для этого не нужен доступ к «Личному кабинету налогоплательщика» или к учетной записи на портале Госуслуг. Получаемый документ заверяется усиленной электронной подписью ИФНС. При этом самому заявителю нет необходимости оформлять сертификат ключа ЭЦП.
Срок предоставления электронного документа – в день обращения или на следующие сутки, не позже, но обычно такая выписка формируется моментально.
Выписка из ЕГРЮЛ по ИНН на сайте доступна пользователю для скачивания в течение 5 дней после формирования. Такой документ может использоваться в качестве официального документа в электронном виде, например, на онлайн-площадках или при подаче документов на участие в госзакупках. Правовая регламентация вопросов применения документов, заверенных ЭЦП, осуществляется через нормы закона от 06.04.2011 г. № 63-ФЗ «Об электронной подписи». Выписка из ЕГРЮЛ налоговой по ИНН для предоставления в государственные структуры не требуется, так как госорганы самостоятельно оформляют запрос на такие документы через систему межведомственного взаимодействия.
Читайте также: Государственная регистрация юридических лиц и ИП: изменения 2019
Выписка из ЕГРЮЛ с электронной подписью налоговой
Выписка из ЕГРЮЛ с электронной подписью налоговой — документ, который требуется довольно часто и для разных целей: для участия в тендерах, проверки контрагентов, открытия банковских счетов, предоставления аудиторам и др. Мы расскажем и наглядно покажем, как ее можно получить без посещения налоговой инспекции — бесплатно и быстро.
Мы расскажем и наглядно покажем, как ее можно получить без посещения налоговой инспекции — бесплатно и быстро.
Можно ли заказать выписку из ЕГРЮЛ с ЭЦП на сайте ФНС?
Да, такая возможность есть, и сделать это совсем нетрудно. Вы можете получить сведения из ЕГРЮЛ/ЕГРИП как о себе, так и о другом юрлице или предпринимателе.
Сервис, предоставляющий такую возможность, разработан в соответствии с п. 1 ст. 7 закона от 08.08. № 129-ФЗ «О госрегистрации юридических лиц и ИП». Данная норма предусматривает бесплатное представление в электронном виде информации, имеющейся в госреестре, о конкретном хозяйственном субъекте.
Формируемая на сайте выписка, содержащая правовые сведения о том или ином лице, заверяется усиленной квалифицированной электронной подписью ФНС. Согласно п. 1, 3 ст. 6 закона от 06.04.2011 № 63-ФЗ «Об электронной подписи», документ в электронной форме, завизированный усиленной квалифицированной электронной подписью, имеет равную силу с тем документом, что сформирован в бумажном виде с «живой» подписью ответственного сотрудника ФНС и оттиском печати надзорного ведомства. При этом получателю этого документа сертификат ключа электронной подписи не нужен.
При этом получателю этого документа сертификат ключа электронной подписи не нужен.
Как информирует ФНС на странице сервиса, выписка из ЕГРЮЛ с электронной подписью будет готова на следующий день после отправки запроса. Она доступна для скачивания в течение 5 дней. В действительности же выписка часто бывает готова через несколько минут после подачи запроса.
Пошаговая инструкция получения выписки из ЕГРЮЛ с электронной подписью налоговиков
Шаг 1
Переходим в сервис формирования сведений из ЕГРЮЛ с электронной подписью ФНС по ссылке: https://service.nalog.ru/vyp/.
Шаг 2
Далее нужно авторизоваться. Это возможно сделать двумя способами: через личный кабинет налогоплательщика-физлица или пройдя регистрацию с использованием адреса электронной почты.
Шаг 3
Чтобы зарегистрироваться, вам потребуется ввести минимальное количество информации: свою почту, пароль, фамилию, имя, а также цифры с картинки. Чтобы начать пользоваться сервисом, нужно активировать свою учетную запись — пройдя по ссылке, которая содержится в письме, присланной ФНС на вашу почту.
Шаг 4
Авторизуемся и заходим в сервис получения выписок из ЕГРЮЛ/ЕГРИП. Нажимаем кнопку «Подать новый запрос на выписку».
Шаг 5
Далее сервис переводит нас в окно выбора: формирование выписки о юрлице либо об ИП. Выбираем нужную вкладку и заводим ОГРН (ОГРНИП) или ИНН того субъекта, сведения о котором мы хотим узнать. Нажимаем «Сформировать запрос».
Шаг 6
Через некоторое время — обычно через несколько минут — выписка будет готова (появится статус «Выписка сформирована»), и вы сможете скачать ее в формате PDF.
Как видим, она подписана усиленной квалифицированной ЭЦП, что нам и требовалось. Выписка из ЕГРЮЛ с усиленной электронной подписью ФНС готова. Она будет содержать практически все сведения об интересующем вас хозяйственном субъекте. Но только те, что относятся к числу открытых. А вот данные из документа, удостоверяющего личность гражданина, она не покажет, поскольку такая информация по закону может быть предоставлена только госорганам.
На странице своего сервиса по формированию выписки из ЕГРЮЛ с ЭЦП налоговая предупреждает: если открыть PDF-документ, завизированный электронной подписью, без настроек программного обеспечения, проверяющего эту подпись, появится сообщение о ее недействительности. Но ФНС предлагает подробную иллюстрированную инструкцию по проведению необходимых настроек — она находится здесь: https://service.nalog.ru/vyp/sign-help.html. Выполните рекомендованные действия, описанные в этой инструкции, — и в дальнейшем электронная подпись будет проверяться автоматически.
Часть 11, Электронные записи; Электронные подписи – объем и применение
Руководство для промышленности
1Часть 11, Электронные записи; Электронные подписи —
Сфера применения и применение
Содержит необязательные рекомендации
В этом руководстве представлены текущие взгляды Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) по этому вопросу.
I. ВВЕДЕНИЕ
Это руководство предназначено для описания текущего мнения Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) в отношении объема и применения части 11 раздела 21 Свода федеральных правил; электронные записи; Электронные подписи (21 CFR, часть 11). 2
Этот документ содержит руководство для лиц, которые в соответствии с требованием закона или другой части правил FDA ведут записи или представляют информацию в FDA 3 , решили вести записи или представлять назначенную информацию в электронном виде и в результате стали подпадать под действие части 11. Часть 11 применяется к записям в электронной форме, которые создаются, модифицируются, поддерживаются, архивируются, извлекаются или передаются. в соответствии с любыми требованиями к документации, изложенными в правилах Агентства. Часть 11 также применяется к электронным записям, представляемым в Агентство в соответствии с Федеральным законом о пищевых продуктах, лекарствах и косметических средствах (Закон) и Законом об общественном здравоохранении (Закон о PHS), даже если такие записи не указаны конкретно в правилах Агентства (§ 11.1). Основополагающие требования, изложенные в Законе, Законе о PHS и правилах FDA (кроме части 11), упоминаются в этом руководящем документе как 9.0028 правила предикатов .
Часть 11 применяется к записям в электронной форме, которые создаются, модифицируются, поддерживаются, архивируются, извлекаются или передаются. в соответствии с любыми требованиями к документации, изложенными в правилах Агентства. Часть 11 также применяется к электронным записям, представляемым в Агентство в соответствии с Федеральным законом о пищевых продуктах, лекарствах и косметических средствах (Закон) и Законом об общественном здравоохранении (Закон о PHS), даже если такие записи не указаны конкретно в правилах Агентства (§ 11.1). Основополагающие требования, изложенные в Законе, Законе о PHS и правилах FDA (кроме части 11), упоминаются в этом руководящем документе как 9.0028 правила предикатов .
В результате своей текущей инициативы по надлежащей производственной практике (CGMP) для лекарств и биологических препаратов для человека и животных, 4 FDA пересматривает часть 11, поскольку она применяется ко всем продуктам, регулируемым FDA. Мы ожидаем инициирования нормотворчества для изменения части 11 в результате повторной проверки. В этом руководстве поясняется, что мы будем узко интерпретировать объем части 11. Пока идет пересмотр части 11, мы намерены проявлять правоприменение по своему усмотрению в отношении определенных требований части 11. То есть мы не намерены предпринимать принудительные действия для обеспечения соблюдения требований части 11 в отношении проверки, контрольного журнала, хранения и копирования записей, как объясняется в этом руководстве. Тем не менее, записи должны храниться или представляться в соответствии с базовыми предикатными правилами, и Агентство может принять регулирующие меры в случае несоблюдения таких предикатных правил.
В этом руководстве поясняется, что мы будем узко интерпретировать объем части 11. Пока идет пересмотр части 11, мы намерены проявлять правоприменение по своему усмотрению в отношении определенных требований части 11. То есть мы не намерены предпринимать принудительные действия для обеспечения соблюдения требований части 11 в отношении проверки, контрольного журнала, хранения и копирования записей, как объясняется в этом руководстве. Тем не менее, записи должны храниться или представляться в соответствии с базовыми предикатными правилами, и Агентство может принять регулирующие меры в случае несоблюдения таких предикатных правил.
Кроме того, мы намерены действовать по своему усмотрению и не намерены предпринимать (или рекомендовать) действия для обеспечения соблюдения каких-либо требований части 11 в отношении систем, которые работали до 20 августа 1997 г., даты вступления в силу части 11 (обычно известной как устаревшие системы) при обстоятельствах, описанных в разделе III.C.3 настоящего руководства.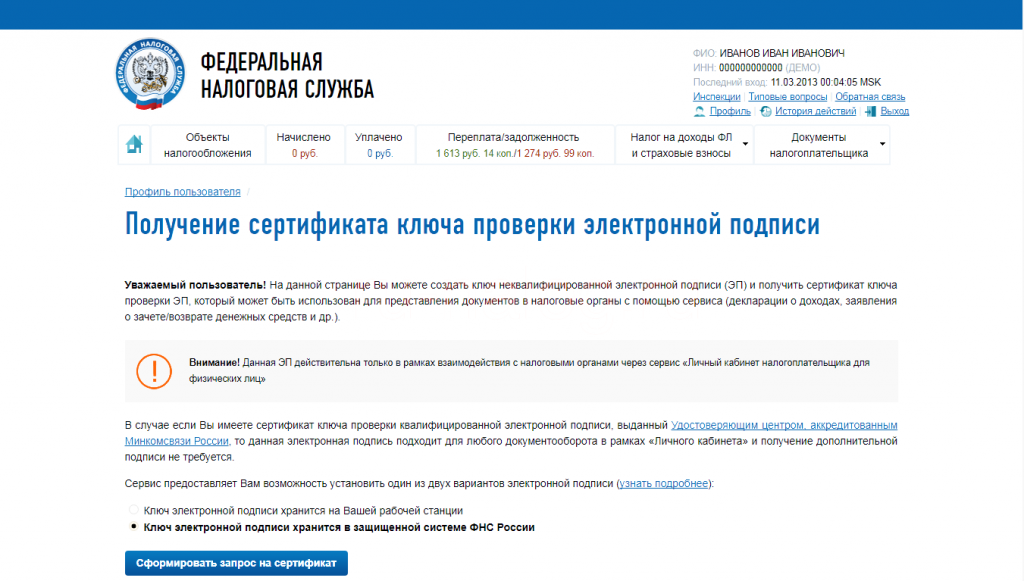
Обратите внимание, что часть 11 остается в силе.
Руководящие документыFDA, включая это руководство, не устанавливают юридически обязательных обязанностей. Вместо этого в руководствах описывается текущее мнение Агентства по теме, и их следует рассматривать только как рекомендации, если только не указаны конкретные нормативные или законодательные требования. Использование слова вместо в руководствах Агентства означает, что что-то предлагается или рекомендуется, но не требуется.
Содержание
II. ФОН
В марте 1997 г. FDA выпустило заключительную часть 11 правил, в которых изложены критерии для принятия FDA при определенных обстоятельствах электронных записей, электронных подписей и собственноручных подписей, выполненных на электронных записях, как эквивалентных бумажным записям и собственноручным подписям, выполненным на бумаге. Эти правила, которые применяются ко всем программным областям FDA, были предназначены для максимально широкого использования электронных технологий, совместимых с ответственностью FDA по защите здоровья населения.
После того, как часть 11 вступила в силу в августе 1997 года, между промышленностью, подрядчиками и Агентством последовали серьезные дискуссии относительно толкования и выполнения правил. FDA (1) говорило о части 11 на многих конференциях и неоднократно встречалось с отраслевой коалицией и другими заинтересованными сторонами, чтобы узнать больше о потенциальных проблемах, связанных с частью 11; (2) опубликовал руководство по политике соответствия, CPG 7153.17: Политика обеспечения соблюдения: 21 CFR, часть 11; электронные записи; электронные подписи; и (3) опубликовали многочисленные проекты руководящих документов, включая следующие:
- 21 CFR часть 11; электронные записи; Электронные подписи, проверка
- 21 CFR часть 11; электронные записи; Электронные подписи, глоссарий терминов
- 21 CFR часть 11; электронные записи; Электронные подписи, отметки времени
- 21 CFR часть 11; электронные записи; Электронные подписи, ведение электронных записей
- 21 CFR часть 11; электронные записи; Электронные подписи, электронные копии электронных записей
Во всех этих сообщениях высказывались опасения, что некоторые толкования требований части 11 могут (1) неоправданно ограничивать использование электронных технологий таким образом, который несовместим с заявленным намерением FDA при выпуске правила, (2) значительно увеличить затраты на соблюдение требований до такой степени, которая не предполагалась во время разработки правила, и (3) препятствовать инновациям и технологическим достижениям, не принося значительной пользы для общественного здравоохранения. Эти опасения были подняты, в частности, в областях требований части 11 для проверки, журналов аудита, хранения записей, копирования записей и устаревших систем.
Эти опасения были подняты, в частности, в областях требований части 11 для проверки, журналов аудита, хранения записей, копирования записей и устаревших систем.
В связи с этими опасениями мы решили пересмотреть документы части 11 и связанные с ними вопросы, особенно в свете инициативы Агентства по программе CGMP. В Федеральном реестре от 4 февраля 2003 г. (68 FR 5645) мы объявили об отзыве проекта руководства для промышленности, 21 CFR Part 11; электронные записи; Электронные подписи, электронные копии электронных записей . Мы решили, что хотим свести к минимуму время, затрачиваемое отраслью на рассмотрение и комментирование проекта руководства, поскольку этот проект руководства может больше не отражать наш подход в рамках инициативы CGMP. Затем в Федерального реестра от 25 февраля 2003 г. (68 FR 8775), мы объявили об отзыве части 11 проекта руководящих документов по проверке, словарю терминов, отметкам времени, 5 ведению электронных записей и CPG 7153. 17. Мы получили ценные комментарии общественности по этим проектам руководств и планируем использовать эту информацию для помощи в принятии будущих решений в отношении части 11. Мы не собираемся переиздавать эти проекты руководств или CPG.
17. Мы получили ценные комментарии общественности по этим проектам руководств и планируем использовать эту информацию для помощи в принятии будущих решений в отношении части 11. Мы не собираемся переиздавать эти проекты руководств или CPG.
В настоящее время мы пересматриваем часть 11 и ожидаем начала нормотворчества для пересмотра положений этого правила. Чтобы избежать ненужных затрат ресурсов для соблюдения требований части 11, мы выпускаем это руководство, чтобы описать, как мы намерены осуществлять правоприменение по усмотрению в отношении определенных требований части 11 во время повторной проверки части 11. Как упоминалось ранее, часть 11 остается в эффект в течение этого периода повторной экспертизы.
Содержание
III. ОБСУЖДЕНИЕ
Общий подход к требованиям Части 11
Как более подробно описано ниже, подход, изложенный в этом руководстве, основан на трех основных элементах:
- Часть 11 будет толковаться узко; сейчас мы уточняем, что меньшее количество записей будет считаться подпадающим под действие части 11.

- В отношении тех записей, которые по-прежнему подпадают под действие части 11, мы намерены осуществлять правоприменение по своему усмотрению в отношении требований части 11 в отношении проверки, журналов аудита, хранения и копирования записей в порядке, описанном в этом руководстве, и в отношении всех требований части 11. для систем, которые работали до даты вступления в силу части 11 (также известные как устаревшие системы).
- Мы будем применять все требования правил предикатов, включая требования к записи правил предикатов и ведению записей.
Важно отметить, что правоприменительные полномочия FDA, описанные в данном руководстве, ограничены конкретными требованиями части 11 (за исключением устаревших систем, в отношении которых степень правоприменительных полномочий при определенных обстоятельствах будет более широкой). Мы намерены обеспечить соблюдение всех остальных положений части 11, включая, помимо прочего, определенные элементы управления для закрытых систем в § 11.
 10. Например, мы намерены ввести в действие положения, касающиеся следующих средств контроля и требований:
10. Например, мы намерены ввести в действие положения, касающиеся следующих средств контроля и требований:- ограничение доступа к системе для уполномоченных лиц
- использование проверок операционной системы
- использование проверок полномочий
- использование проверок устройств
- определение того, что лица, которые разрабатывают, обслуживают или используют электронные системы, имеют образование, подготовку и опыт для выполнения возложенных на них задач
- установление и соблюдение письменных политик, предусматривающих ответственность отдельных лиц за действия, инициированные с использованием их электронных подписей
- надлежащий контроль системной документации
- средства управления для открытых систем, соответствующие средствам управления для закрытых систем, отмеченным выше (§ 11.30)
- требования, касающиеся электронных подписей (например, §§ 11.50, 11.70, 11.100, 11.200 и 11.300)
Мы ожидаем дальнейшего соблюдения этих положений и будем продолжать обеспечивать их соблюдение.
 Кроме того, лица должны соблюдать применимые предикатные правила, а записи, которые необходимо хранить или отправлять, должны оставаться безопасными и надежными в соответствии с предикатными правилами.
Кроме того, лица должны соблюдать применимые предикатные правила, а записи, которые необходимо хранить или отправлять, должны оставаться безопасными и надежными в соответствии с предикатными правилами.- Часть 11 будет толковаться узко; сейчас мы уточняем, что меньшее количество записей будет считаться подпадающим под действие части 11.
Детали подхода – Объем части 11
Узкое толкование области применения
Мы понимаем, что существует некоторая путаница в отношении сферы действия части 11. Некоторые понимают, что сфера действия части 11 очень широка. Мы считаем, что некоторые из этих широких интерпретаций могут привести к ненужному контролю и затратам и могут препятствовать инновациям и технологическим достижениям, не принося дополнительной пользы для общественного здравоохранения. В результате мы хотим уточнить, что Агентство намерено узко интерпретировать объем части 11.
В соответствии с узкой интерпретацией сферы применения части 11 в отношении записей, которые должны храниться в соответствии с предикатными правилами или представляться в FDA, когда лица предпочитают использовать записи в электронном формате вместо бумажного, будет применяться часть 11.
 С другой стороны, когда люди используют компьютеры для создания бумажных распечаток электронных записей, и эти бумажные записи отвечают всем требованиям применимых предикатных правил, и люди полагаются на бумажные записи для выполнения своей регулируемой деятельности, FDA, как правило, не считает, что лица быть «использованием электронных записей вместо бумажных записей» в соответствии с §§ 11.2 (a) и 11.2 (b). В этих случаях использование компьютерных систем для создания бумажных документов не приведет к срабатыванию части 119.0013
С другой стороны, когда люди используют компьютеры для создания бумажных распечаток электронных записей, и эти бумажные записи отвечают всем требованиям применимых предикатных правил, и люди полагаются на бумажные записи для выполнения своей регулируемой деятельности, FDA, как правило, не считает, что лица быть «использованием электронных записей вместо бумажных записей» в соответствии с §§ 11.2 (a) и 11.2 (b). В этих случаях использование компьютерных систем для создания бумажных документов не приведет к срабатыванию части 119.0013Определение записей части 11
В соответствии с этой узкой интерпретацией FDA считает, что часть 11 применима к следующим записям или подписям в электронном формате (записи или подписи части 11):
Записи, которые необходимо вести в соответствии с требованиями правила предиката и которые ведутся в электронном формате вместо бумажного формата . С другой стороны, записи (и любые связанные с ними подписи), которые не требуется хранить в соответствии с предикатными правилами, но которые, тем не менее, хранятся в электронном формате, не являются записями части 11.

Мы рекомендуем определить на основе правил предиката, являются ли определенные записи записями части 11. Мы рекомендуем документировать такие решения.
Записи, которые необходимо вести в соответствии с предикатными правилами, которые ведутся в электронном формате в дополнение к бумажному формату и на которые полагаются для выполнения регулируемых действий .
В некоторых случаях фактическая деловая практика может определять, с использованием электронных записей вместо бумажных записей в соответствии с § 11.2(a). Например, если запись требуется вести в соответствии с предикатным правилом, и вы используете компьютер для создания бумажной распечатки электронных записей, но, тем не менее, вы полагаетесь на электронную запись для выполнения регулируемых действий, Агентство может считать вас с использованием электронной записи вместо бумажной. То есть Агентство может принять во внимание вашу деловую практику при определении применимости части 11.

Соответственно, мы рекомендуем, чтобы для каждой записи, которую необходимо вести в соответствии с предикатными правилами, вы заранее определили, планируете ли вы полагаться на электронную или бумажную запись для выполнения регулируемых действий. Мы рекомендуем вам задокументировать это решение (например, в стандартной рабочей процедуре (СОП) или спецификации).
- Записи, представленные в FDA в соответствии с предикатными правилами (даже если такие записи не указаны конкретно в правилах Агентства) в электронном формате (при условии, что записи были идентифицированы в списке № 9).2S-0251 в качестве типов документов, которые Агентство принимает в электронном формате). Однако запись, которая сама по себе не представлена, но используется при создании представления, не является записью части 11, если иное не требуется в соответствии с правилом предиката, и она ведется в электронном формате.
- Электронные подписи, которые должны быть эквивалентом собственноручных подписей, инициалов и других общих подписей, требуемых правилами предикатов.
 Подписи Части 11 включают электронные подписи, которые используются, например, для документирования того факта, что определенные события или действия произошли в соответствии с правилом предиката (например, утверждено, рассмотрено, и проверено ).
Подписи Части 11 включают электронные подписи, которые используются, например, для документирования того факта, что определенные события или действия произошли в соответствии с правилом предиката (например, утверждено, рассмотрено, и проверено ).
- Подход к конкретным требованиям части 11
- Валидация
Агентство намеревается осуществлять правоприменение по своему усмотрению в отношении конкретных требований части 11 для проверки компьютеризированных систем (§ 11.10 (a) и соответствующие требования в § 11.30). Несмотря на то, что лица по-прежнему должны соблюдать все применимые требования правила предиката для проверки (например, 21 CFR 820.70(i)), это руководство не следует рассматривать как налагающее какие-либо дополнительные требования для проверки.
Мы предлагаем, чтобы ваше решение о проверке компьютеризированных систем и степень проверки учитывали влияние систем на вашу способность выполнять требования предикатных правил.
 Вы также должны учитывать влияние этих систем на точность, надежность, целостность, доступность и подлинность требуемых записей и подписей. Даже если для проверки системы не требуется предикатного правила, в некоторых случаях все же может быть важно проверить систему.
Вы также должны учитывать влияние этих систем на точность, надежность, целостность, доступность и подлинность требуемых записей и подписей. Даже если для проверки системы не требуется предикатного правила, в некоторых случаях все же может быть важно проверить систему.Мы рекомендуем вам основывать свой подход на обоснованной и задокументированной оценке рисков и определении потенциального влияния системы на качество и безопасность продукции, а также целостность записей. Например, проверка не будет важна для текстового процессора, используемого только для создания SOP.
Дополнительные рекомендации по валидации компьютеризированных систем см. в руководстве FDA для промышленности и персонала FDA Общие принципы валидации программного обеспечения , а также в отраслевых руководствах, таких как Руководство по GAMP 4 (см. ссылки).
Контрольный журнал
Агентство намеревается осуществлять правоприменение по своему усмотрению в отношении конкретных требований части 11, касающихся компьютерных контрольных журналов с отметками времени (§ 11.
 10 (e), (k) (2) и любые соответствующие требования в § 11.30). Лица по-прежнему должны соблюдать все применимые требования правила предиката, связанные с документированием, например, даты (например, § 58.130(e)), времени или последовательности событий, а также любые требования, гарантирующие, что изменения в записях не затеняют предыдущие записи.
10 (e), (k) (2) и любые соответствующие требования в § 11.30). Лица по-прежнему должны соблюдать все применимые требования правила предиката, связанные с документированием, например, даты (например, § 58.130(e)), времени или последовательности событий, а также любые требования, гарантирующие, что изменения в записях не затеняют предыдущие записи.Даже если нет требований предикатного правила для документирования, например, даты, времени или последовательности событий в конкретном случае, тем не менее может быть важно иметь контрольные журналы или другие физические, логические или процедурные меры безопасности для обеспечить достоверность и достоверность записей. 6 Мы рекомендуем основывать свое решение о применении контрольных журналов или других соответствующих мер на необходимости соблюдения требований предикатных правил, обоснованной и документально подтвержденной оценке рисков, а также на определении потенциального влияния на качество продукта и безопасность и целостность записи.
 Мы предлагаем вам применить соответствующие средства контроля на основе такой оценки. Журналы аудита могут быть особенно уместны, когда ожидается, что пользователи будут создавать, изменять или удалять регулируемые записи в ходе обычной работы.
Мы предлагаем вам применить соответствующие средства контроля на основе такой оценки. Журналы аудита могут быть особенно уместны, когда ожидается, что пользователи будут создавать, изменять или удалять регулируемые записи в ходе обычной работы.Устаревшие системы 7
Агентство намеревается осуществлять правоприменение по своему усмотрению в отношении всех требований части 11 для систем, которые в противном случае находились в рабочем состоянии до 20 августа 1997 года, даты вступления в силу части 11, при обстоятельствах, указанных ниже.
Это означает, что Агентство не намерено предпринимать принудительные действия для обеспечения соблюдения каких-либо требований части 11, если для конкретной системы выполняются все следующие критерии:
- Система работала до даты вступления в силу.
- Система выполнила все применимые требования правила предиката до даты вступления в силу.
- В настоящее время система соответствует всем применимым требованиям правил предикатов.

- У вас есть документальное подтверждение и обоснование того, что система пригодна для использования по назначению (включая наличие приемлемого уровня безопасности и целостности записей, если применимо).
Если система была изменена с 20.08.1997, и если изменения будут препятствовать выполнению системой требований предикатного правила, элементы управления Части 11 должны применяться к записям и подписям Части 11 в соответствии с политикой принудительного применения, изложенной в этом руководстве.
Копии записей
Агентство намеревается осуществлять правоприменение по своему усмотрению в отношении конкретных требований части 11 для создания копий записей (§ 11.10 (b) и любых соответствующих требований в § 11.30). Вы должны предоставить следователю разумный и полезный доступ к записям во время проверки. Все имеющиеся у вас записи подлежат проверке в соответствии с предикатными правилами (например, §§ 211.180(c), (d) и 108.35(c)(3)(ii)).

Мы рекомендуем вам предоставлять копии электронных документов по:
- Изготовление копий записей, хранящихся в обычных переносимых форматах, когда записи ведутся в этих форматах
Использование установленных методов автоматического преобразования или экспорта, если они доступны, для создания копий в более распространенном формате (примеры таких форматов включают, помимо прочего, PDF, XML или SGML)
В каждом случае мы рекомендуем, чтобы используемый процесс копирования производил копии, сохраняющие содержание и значение записи. Если у вас есть возможность искать, сортировать или отслеживать записи части 11, копии, предоставленные Агентству, должны обеспечивать такую же возможность, если это разумно и технически осуществимо. Вы должны разрешить проверку, просмотр и копирование записей в удобочитаемой форме на своем сайте с использованием вашего оборудования и в соответствии с установленными процедурами и методами доступа к записям.
Сохранение записи
Агентство намеревается осуществлять правоприменение по своему усмотрению в отношении требований части 11 по защите записей, чтобы обеспечить их точный и быстрый поиск в течение всего периода хранения записей (§ 11.
 10 (c) и любое соответствующее требование в § 11.30). Лица по-прежнему должны соблюдать все применимые требования предикатного правила для хранения и доступности записей (например, §§ 211.180(c),(d), 108.25(g) и 108.35(h)).
10 (c) и любое соответствующее требование в § 11.30). Лица по-прежнему должны соблюдать все применимые требования предикатного правила для хранения и доступности записей (например, §§ 211.180(c),(d), 108.25(g) и 108.35(h)).Мы предлагаем, чтобы ваше решение о том, как вести записи, основывалось на требованиях предикатного правила, и чтобы вы основывали свое решение на обоснованной и задокументированной оценке рисков и определении ценности записей с течением времени.
FDA не намерено возражать, если вы решите архивировать требуемые записи в электронном формате на неэлектронных носителях, таких как микрофильмы, микрофиши и бумага, или в стандартном электронном формате файлов (примеры таких форматов включают, но не ограничиваются, PDF , XML или SGML). Лица по-прежнему должны соблюдать все требования правила предиката, а сами записи и любые копии требуемых записей должны сохранять свое содержание и значение. Пока требования правила предиката полностью удовлетворены, а содержание и значение записей сохранены и заархивированы, вы можете удалить электронную версию записей.
 Кроме того, бумажные и электронные компоненты записи и подписи могут сосуществовать (т.0004 8 ) до тех пор, пока соблюдаются требования правила предиката и сохраняется содержимое и значение этих записей.
Кроме того, бумажные и электронные компоненты записи и подписи могут сосуществовать (т.0004 8 ) до тех пор, пока соблюдаются требования правила предиката и сохраняется содержимое и значение этих записей.
- Валидация
Содержание
IV. ССЫЛКИ
Справочные материалы Управления по санитарному надзору за качеством пищевых продуктов и медикаментов
- Глоссарий терминологии компьютеризированных систем и разработки программного обеспечения (Отдел полевых исследований, Управление региональных операций, Управление по вопросам регулирования, FDA 1995)
- Общие принципы проверки программного обеспечения; Окончательное руководство для промышленности и персонала FDA (FDA, Центр устройств и радиологического здоровья, Центр оценки и исследований биологических препаратов, 2002 г.)
- Руководство для промышленности, рецензенты FDA и соответствие требованиям по использованию готового программного обеспечения в медицинских устройствах (FDA, Центр устройств и радиологического здоровья, 1999 г.
 )
) - Фармацевтические CGMP для 21 века: подход, основанный на оценке риска; Научный подход и подход к регулированию качества продукции, основанный на оценке рисков, включающий комплексный подход к системам качества (FDA 2002)
Отраслевые ссылки
- Руководство по надлежащей практике автоматизированного производства (GAMP) для проверки автоматизированных систем, GAMP 4 (форум ISPE/GAMP, 2001 г.) (http://www.ispe.org/gamp/)
- ISO/IEC 17799:2000 (BS 7799:2000) Информационные технологии. Свод правил по управлению информационной безопасностью (ISO/IEC, 2000)
- ISO 14971:2002 Медицинские устройства. Применение управления рисками к медицинским устройствам (ISO, 2001)
Содержание
1 Это руководство было подготовлено Управлением по контролю за соблюдением нормативных требований Центра оценки и исследований лекарственных средств (CDER) в консультации с другими центрами Агентства и Управлением по регулированию Управления по санитарному надзору за качеством пищевых продуктов и медикаментов.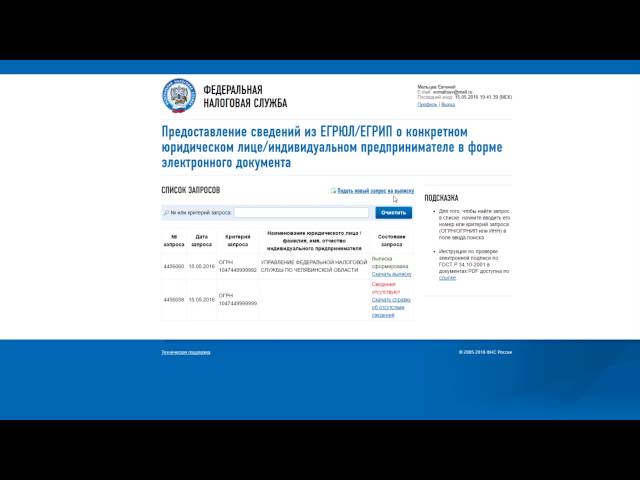
2 62 передняя 13430
3 Эти требования включают, например, определенные положения правил надлежащей производственной практики (21 CFR, часть 211), правил системы качества (21 CFR, часть 820) и правил надлежащей лабораторной практики для неклинических лабораторных исследований (21). Свод федеральных правил, часть 58).
4 См. Фармацевтические CGMP для 21 века: подход, основанный на оценке рисков; Подход к регулированию качества продукции, основанный на науке и оценке рисков, включающий комплексный подход к системам качества .
5 Несмотря на то, что мы отозвали проект руководства по отметкам времени, наше текущее мнение не изменилось в том смысле, что при использовании отметок времени для систем, охватывающих разные часовые пояса, мы не ожидаем, что вы будете записывать местное время подписывающей стороны. При использовании меток времени их следует реализовывать с четким пониманием используемой ссылки на часовой пояс. В таких случаях системная документация должна объяснять ссылки на часовые пояса, а также аббревиатуры зон или другие соглашения об именах.
В таких случаях системная документация должна объяснять ссылки на часовые пояса, а также аббревиатуры зон или другие соглашения об именах.
6 Доступны различные руководства по информационной безопасности (см. Ссылки).
7 В этом руководящем документе мы используем термин устаревшая система для описания систем, которые уже работали до даты вступления в силу части 11.
8 Примеры смешанных ситуаций включают комбинации бумажных документов (или других неэлектронных носителей) и электронных документов, бумажных документов и электронных подписей или собственноручных подписей, выполненных с электронными документами.
Содержание
eSignature — Начало работы
Как вы можете внедрить электронные подписи в государственном управлении или государственном учреждении. Все инструменты и услуги CEF доступны бесплатно.
1 Ознакомьтесь с законодательством и стандартами Регламент eIDAS (910/2014) устанавливает правовую основу для электронных подписей в ЕС. Он определяет, кто может использовать электронные подписи и в каком контексте. Для обеспечения возможности создания и проверки электронных подписей в любой точке Европы был определен ряд стандартов для их реализации.
Он определяет, кто может использовать электронные подписи и в каком контексте. Для обеспечения возможности создания и проверки электронных подписей в любой точке Европы был определен ряд стандартов для их реализации.
Ознакомьтесь с нашим кратким изложением законодательства и узнайте, что вам нужно сделать, чтобы соответствовать требованиям.
2 Определите свои потребностиРассмотрите потребности вашей организации и определите, какие типы документов должны быть подписаны цифровой подписью и в каких случаях использования. Как правило, это объемные соглашения с низким уровнем риска, такие как кадровые документы, но они также могут быть документами, используемыми при взаимодействии с гражданами.
3 Выберите тип электронной подписи Существуют разные типы электронных подписей с разным уровнем доверия: простые, расширенные и квалифицированные. Квалифицированные электронные подписи, например, имеют самый высокий уровень доверия и имеют такую же юридическую силу, как и собственноручная подпись. Оцените, какой тип электронной подписи подходит в вашем случае. Для этого примите во внимание практические детали и юридический риск, сбалансируйте стоимость внедрения и риск проиграть судебный процесс.
Оцените, какой тип электронной подписи подходит в вашем случае. Для этого примите во внимание практические детали и юридический риск, сбалансируйте стоимость внедрения и риск проиграть судебный процесс.
Имейте в виду, что электронные печати аналогичны электронным подписям, но используются юридическими лицами, например предприятиями или государственными организациями.
4 Определите свои ИТ-спецификацииВ зависимости от ваших потребностей и выбранного типа электронной подписи уточните свои требования и определите ИТ-спецификации для формирования рабочего процесса, архитектуры приложений и элементов управления безопасностью.
5 Решите, как включить цифровые подписи Чтобы подписать документ электронной подписью, вам потребуется цифровое приложение. Вы можете создать собственное решение самостоятельно или найти поставщика решений, который может адаптировать свой продукт к вашим потребностям. Ознакомьтесь с нашим обзором документации и службами поддержки, которые помогут вам найти решение. Подумайте о преимуществах перехода на цифровые технологии с помощью CEF eSignature и оцените свое право на получение финансирования CEF .
Подумайте о преимуществах перехода на цифровые технологии с помощью CEF eSignature и оцените свое право на получение финансирования CEF .
Если вы предпочитаете подход поставщика решений, вы можете пропустить два следующих шага и перейти к разделу 8.
6 Использовать открытую библиотеку eSignature DSS ) библиотека с открытым исходным кодом, чтобы гарантировать, что ваши электронные подписи и электронные печати создаются и проверяются в соответствии с европейским законодательством и стандартами. Вы можете принять DSS как таковой или использовать его в качестве эталонной реализации. Нужна помощь с этим шагом? Свяжитесь с нашей службой поддержки для получения информации и поддержки. 7 Обеспечение соответствия вашего решения Если ваше решение основано на DSS, оно уже соответствует требованиям, и вы можете пропустить этот шаг. Если вы разработали собственное приложение для подписи без DSS, вы можете проверить функциональную совместимость и соответствие своего решения для электронной подписи с помощью нашей Проверки соответствия подписи ETSI. Вы также можете проверять квалифицированные и расширенные подписи и печати, используя наш алгоритм проверки квалифицированной электронной подписи — QES.
Вы также можете проверять квалифицированные и расширенные подписи и печати, используя наш алгоритм проверки квалифицированной электронной подписи — QES.
Чтобы подписать документ цифровой подписью с использованием расширенной или квалифицированной электронной подписи, необходимо иметь действующий цифровой сертификат. Цифровые сертификаты аналогичны цифровому удостоверению и предоставляются поставщиками услуг доверия. Воспользуйтесь нашим браузером доверенных списков eSignature, чтобы выбрать из более чем 200 активных поставщиков услуг доверия.
Обратите внимание, что некоторые поставщики решений для подписи сотрудничают с TSP, чтобы облегчить предоставление цифровых сертификатов и упростить процесс.
9 Начало электронной подписи документовВы и ваше приложение готовы начать цифровую подпись документов.
Вопросы? Свяжитесь с нашей службой поддержки eSignature. Все инструменты и услуги CEF доступны бесплатно.
Все инструменты и услуги CEF доступны бесплатно.
Вы работаете в учреждении ЕС?
Запросить семинар с CEF Digital
Мы предлагаем экспертные консультации и консультации по электронным подписям и связанным с ними вопросам для учреждений и органов ЕС. Мы можем помочь вам начать работу с электронными подписями и электронными печатями, разобрать юридические и технические концепции и помочь интегрировать эти услуги в ваши текущие бизнес-платформы и процессы.
Как начать подписывать документы электронным способом в ЕС
1 Ознакомьтесь с законодательством и стандартамиРегламент eIDAS (910/2014) устанавливает правовую основу для электронных подписей в ЕС. Он определяет, кто может использовать электронные подписи и в каком контексте. Чтобы электронные подписи можно было создавать и проверять в любой точке Европы, для их реализации был определен ряд стандартов.
Ознакомьтесь с нашим кратким изложением законодательства и узнайте, что вам нужно сделать, чтобы соответствовать требованиям.
Рассмотрите потребности вашей организации и определите, какие типы документов должны быть подписаны цифровой подписью и в каких вариантах использования. Как правило, это соглашения с низким уровнем риска и большими объемами, такие как кадровые документы, но также могут быть документы о продажах и закупках или касаться адаптации клиентов.
3 Выберите тип электронной подписи Существуют разные типы электронных подписей с разными уровнями доверия: простые, расширенные и квалифицированные. Квалифицированные электронные подписи, например, имеют самый высокий уровень доверия и имеют такую же юридическую силу, как и собственноручная подпись. Оцените, какой тип электронной подписи подходит в вашем случае. Для этого примите во внимание практические детали и юридический риск, сбалансируйте стоимость внедрения и риск проиграть судебный процесс. Любая подпись может быть оспорена, но такие функции, как контрольный журнал электронной подписи, выбор реализации (одноразовый PIN-код через SMS; специальный щелчок, чтобы принять положения и условия) или добавление квалифицированной подписи дает вам уверенность, если вам придется защищать что-то в суде.
Обратите внимание, что вы также можете запрашивать подписи на основе сертификатов у подписывающих сторон за пределами вашей организации.
Имейте в виду, что электронные печати аналогичны электронным подписям, но используются юридическими лицами, например предприятиями или государственными организациями.
4 Определите свои ИТ-спецификацииВ зависимости от ваших потребностей и выбранного типа электронной подписи уточните свои требования и определите ИТ-спецификации для формирования рабочего процесса, архитектуры приложений и элементов управления безопасностью.
5 Решите, как включить цифровые подписи Чтобы подписать документ электронной подписью, вам потребуется цифровое приложение. Вы можете создать собственное решение самостоятельно или найти поставщика решений, который может адаптировать свой продукт к вашим потребностям. Ознакомьтесь с нашей документацией и службами поддержки, которые помогут вам найти решение. Рассмотрите преимущества перехода на цифровые технологии с помощью CEF eSignature и оцените свое право на финансирование CEF .
Рассмотрите преимущества перехода на цифровые технологии с помощью CEF eSignature и оцените свое право на финансирование CEF .
Если вы предпочитаете подход поставщика решений, вы можете пропустить два следующих шага и перейти к разделу 8.
6 Используйте библиотеку с открытым исходным кодом eSignature DSSВы можете использовать библиотеку с открытым исходным кодом программного обеспечения цифровой подписи (DSS), чтобы убедиться, что ваши электронные подписи и электронные печати созданы и проверены в соответствии с европейскими законодательства и стандартов. Вы можете принять DSS как таковой или использовать его в качестве эталонной реализации. Нужна помощь с этим шагом? Свяжитесь с нашей службой поддержки для получения информации и поддержки.
7 Сделайте свое решение совместимым Если ваше решение основано на DSS, оно уже соответствует требованиям, и вы можете пропустить этот шаг. Если вы разработали собственное приложение для подписи без DSS, вы можете проверить функциональную совместимость и соответствие ваших решений для электронной подписи с помощью нашего средства проверки соответствия подписи ETSI. Вы также можете проверить квалифицированные и расширенные подписи и печати, используя наш Квалифицированная электронная подпись — алгоритм проверки QES
Вы также можете проверить квалифицированные и расширенные подписи и печати, используя наш Квалифицированная электронная подпись — алгоритм проверки QES
Для цифровой подписи документа с помощью расширенной или квалифицированной электронной подписи необходимо иметь действующий цифровой сертификат. Цифровой сертификат аналогичен цифровому удостоверению личности и предоставляется поставщиками услуг доверия. Воспользуйтесь нашим браузером доверенных списков eSignature, чтобы выбрать из более чем 200 активных поставщиков услуг доверия.
Обратите внимание, что некоторые поставщики решений для подписи сотрудничают с TSP, чтобы облегчить предоставление цифровых сертификатов и упростить процесс.
9 Начало электронной подписи документовВы и ваше приложение готовы начать цифровую подпись документов.
Вопросы? Свяжитесь с нашей службой поддержки eSignature. Все инструменты и услуги CEF доступны бесплатно.
Все инструменты и услуги CEF доступны бесплатно.
Если вы хотите предложить решения для электронной подписи, соответствующие Регламенту eIDAS, вам нужно сделать несколько вещей в первую очередь.
1 Ознакомьтесь с законодательством и стандартамиРегламент eIDAS (910/2014) устанавливает правовую основу для электронных подписей в ЕС. Он определяет, кто может использовать электронные подписи и в каком контексте. Для обеспечения возможности создания и проверки электронных подписей в любой точке Европы был определен ряд стандартов для их реализации.
Ознакомьтесь с нашим кратким изложением законодательства и узнайте, что вам нужно сделать, чтобы соответствовать требованиям .
2 Объем вашего предложения Соберите бизнес-потребности рынка или целевой группы пользователей и преобразуйте их в требования. Имейте в виду, что электронные печати аналогичны электронным подписям, но используются юридическими лицами, например предприятиями или государственными организациями. Существуют разные типы электронных подписей и электронных печатей с разным уровнем доверия: простые, расширенные и квалифицированные. Квалифицированные электронные подписи, например, имеют самый высокий уровень доверия и имеют такую же юридическую силу, как и собственноручная подпись. Оцените требования для каждого типа и определите, какие типы продуктов для электронной подписи вы будете предлагать.
Существуют разные типы электронных подписей и электронных печатей с разным уровнем доверия: простые, расширенные и квалифицированные. Квалифицированные электронные подписи, например, имеют самый высокий уровень доверия и имеют такую же юридическую силу, как и собственноручная подпись. Оцените требования для каждого типа и определите, какие типы продуктов для электронной подписи вы будете предлагать.
Являясь поставщиком услуг, вы можете создать свое решение с помощью нашей библиотеки с открытым исходным кодом, ПО для цифровой подписи (DSS). DSS поддерживает создание и проверку интероперабельных и безопасных электронных подписей в соответствии с Регламентом eIDAS. Вы можете принять DSS как таковой или использовать его в качестве эталонной реализации. Ознакомьтесь с нашей документацией и службами поддержки, которые помогут вам найти решение. Рассмотрите преимущества перехода на цифровые технологии с помощью CEF eSignature и оцените свое право на получение финансирования CEF .
Если ваше решение основано на DSS, оно уже соответствует требованиям, и вы можете пропустить этот шаг. Если вы разработали собственное приложение для подписи без DSS, вы можете проверить функциональную совместимость и соответствие ваших решений для электронной подписи с помощью нашего средства проверки соответствия подписи ETSI. Вы также можете проверять квалифицированные и расширенные подписи и печати, используя наш алгоритм проверки квалифицированной электронной подписи — QES.
5 Войдите в наш Браузер списков доверенных лицВойдите в наш Браузер списков доверенных лиц, чтобы найти более 200 активных поставщиков доверенных услуг, которые аккредитованы для обеспечения высочайшего уровня соответствия Регламенту ЕС об электронной подписи eIDAS.
6 Предложение и продвижение услуг Вы готовы начать предлагать и продвигать свои услуги.
Вопросы? Обратитесь в нашу службу поддержки eSignature. Все инструменты и услуги CEF доступны бесплатно.
Пилотный проект по международной совместимости доверенных служб призван проиллюстрировать, как взаимное признание между ЕС и третьей страной (далее 3-я страна) квалифицированных поставщиков доверительных услуг (QTSP) и квалифицированных доверительных услуг (QTS), которые они предоставляют ( в дальнейшем совместно QTSP/QTS) могут быть (технически) реализованы в соответствии со статьей 14 eIDAS.
Для получения дополнительной информации нажмите здесь.
Обработка физических документов может потребовать больших усилий. Подсчитайте время, которое обычно требуется вам, чтобы распечатать документы один за другим, подписать документы, подготовить документы к отправке и дождаться прибытия почтового отделения или курьера к получателю.
Электронные подписи упрощают подписание документов. Когда у вас есть документ, все, что вам нужно сделать, это подписать его с помощью электронной подписи и отправить документ по электронной почте получателю.
Чтобы подписать документ цифровой подписью, необходимо иметь действующий цифровой сертификат, аналогичный цифровому удостоверению личности. Цифровые сертификаты предоставляются поставщиками услуг доверия. Получите доступ к нашему браузеру доверенных списков eSignature , чтобы выбрать из более чем 200 активных поставщиков услуг доверия.
Обратите внимание, что некоторые поставщики решений для подписи сотрудничают с поставщиками услуг доверия, чтобы облегчить предоставление цифровых сертификатов и упростить получение сертификатов пользователями.
Далее вам нужно выбрать приложение для подписи. Поставщики услуг доверия или поставщики решений для электронной подписи предлагают такие приложения и другие продукты для электронной подписи. Выберите поставщика, который соответствует вашим потребностям.

 д.
д.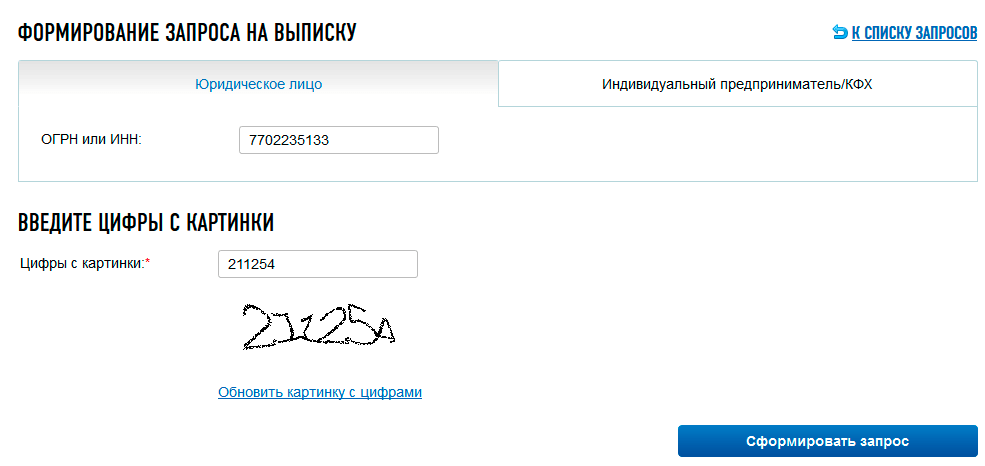

 10. Например, мы намерены ввести в действие положения, касающиеся следующих средств контроля и требований:
10. Например, мы намерены ввести в действие положения, касающиеся следующих средств контроля и требований: Кроме того, лица должны соблюдать применимые предикатные правила, а записи, которые необходимо хранить или отправлять, должны оставаться безопасными и надежными в соответствии с предикатными правилами.
Кроме того, лица должны соблюдать применимые предикатные правила, а записи, которые необходимо хранить или отправлять, должны оставаться безопасными и надежными в соответствии с предикатными правилами. С другой стороны, когда люди используют компьютеры для создания бумажных распечаток электронных записей, и эти бумажные записи отвечают всем требованиям применимых предикатных правил, и люди полагаются на бумажные записи для выполнения своей регулируемой деятельности, FDA, как правило, не считает, что лица быть «использованием электронных записей вместо бумажных записей» в соответствии с §§ 11.2 (a) и 11.2 (b). В этих случаях использование компьютерных систем для создания бумажных документов не приведет к срабатыванию части 119.0013
С другой стороны, когда люди используют компьютеры для создания бумажных распечаток электронных записей, и эти бумажные записи отвечают всем требованиям применимых предикатных правил, и люди полагаются на бумажные записи для выполнения своей регулируемой деятельности, FDA, как правило, не считает, что лица быть «использованием электронных записей вместо бумажных записей» в соответствии с §§ 11.2 (a) и 11.2 (b). В этих случаях использование компьютерных систем для создания бумажных документов не приведет к срабатыванию части 119.0013
 Подписи Части 11 включают электронные подписи, которые используются, например, для документирования того факта, что определенные события или действия произошли в соответствии с правилом предиката (например, утверждено, рассмотрено, и проверено ).
Подписи Части 11 включают электронные подписи, которые используются, например, для документирования того факта, что определенные события или действия произошли в соответствии с правилом предиката (например, утверждено, рассмотрено, и проверено ). Вы также должны учитывать влияние этих систем на точность, надежность, целостность, доступность и подлинность требуемых записей и подписей. Даже если для проверки системы не требуется предикатного правила, в некоторых случаях все же может быть важно проверить систему.
Вы также должны учитывать влияние этих систем на точность, надежность, целостность, доступность и подлинность требуемых записей и подписей. Даже если для проверки системы не требуется предикатного правила, в некоторых случаях все же может быть важно проверить систему. 10 (e), (k) (2) и любые соответствующие требования в § 11.30). Лица по-прежнему должны соблюдать все применимые требования правила предиката, связанные с документированием, например, даты (например, § 58.130(e)), времени или последовательности событий, а также любые требования, гарантирующие, что изменения в записях не затеняют предыдущие записи.
10 (e), (k) (2) и любые соответствующие требования в § 11.30). Лица по-прежнему должны соблюдать все применимые требования правила предиката, связанные с документированием, например, даты (например, § 58.130(e)), времени или последовательности событий, а также любые требования, гарантирующие, что изменения в записях не затеняют предыдущие записи. Мы предлагаем вам применить соответствующие средства контроля на основе такой оценки. Журналы аудита могут быть особенно уместны, когда ожидается, что пользователи будут создавать, изменять или удалять регулируемые записи в ходе обычной работы.
Мы предлагаем вам применить соответствующие средства контроля на основе такой оценки. Журналы аудита могут быть особенно уместны, когда ожидается, что пользователи будут создавать, изменять или удалять регулируемые записи в ходе обычной работы.

 10 (c) и любое соответствующее требование в § 11.30). Лица по-прежнему должны соблюдать все применимые требования предикатного правила для хранения и доступности записей (например, §§ 211.180(c),(d), 108.25(g) и 108.35(h)).
10 (c) и любое соответствующее требование в § 11.30). Лица по-прежнему должны соблюдать все применимые требования предикатного правила для хранения и доступности записей (например, §§ 211.180(c),(d), 108.25(g) и 108.35(h)). Кроме того, бумажные и электронные компоненты записи и подписи могут сосуществовать (т.0004 8 ) до тех пор, пока соблюдаются требования правила предиката и сохраняется содержимое и значение этих записей.
Кроме того, бумажные и электронные компоненты записи и подписи могут сосуществовать (т.0004 8 ) до тех пор, пока соблюдаются требования правила предиката и сохраняется содержимое и значение этих записей. )
)