Аммиак. Свойства аммиака. Получение аммиака. Соли аммония
Аммиак — одно из важнейших соединений азота.
Азот, входящий в состав белков и нуклеиновых кислот, является одним из компонентов, составляющих основу жизни. Поэтому очень важно было научиться синтезировать химические соединения с азотом. Сначала использовали электричество, но этот способ оказался очень дорогим. Более простым способом явилась химическая реакция соединения азота, находящегося в воздухе, с водородом в химическое соединение — аммиак!
Получение аммиака
Получение аммиака в промышленности связано с прямым его синтезом из простых веществ. Как уже отмечалось, источником азота служит воздух, а водород получают из воды.
3H2 + N2 → 2NH3 + Q
Аммиак. Водный раствор
Реакция синтеза аммиака обратима, поэтому важно подобрать условия, при которых выход аммиака в химической реакции будет наибольшим.
Получение аммиака в лабораторных условиях производят из смеси твёрдого хлорида аммония (NH4Cl) и гашенной извести. При нагревании интенсивно выделяется аммиак.
2NH4
Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2OСвойства аммиака
Аммиак при обычных условиях — газ с резким и неприятным запахом. Аммиак ядовит! При 20 0C в воде растворяется 700 л аммиака. Полученный раствор называют аммиачной водой. Из-за такой растворимости аммиак нельзя собирать и хранить над водой.
Аммиак ядовит! При 20 0C в воде растворяется 700 л аммиака. Полученный раствор называют аммиачной водой. Из-за такой растворимости аммиак нельзя собирать и хранить над водой.
Аммиак — активный восстановитель. Такое свойство у него за счёт атомов азота, имеющих степень окисления «-3». Восстановительные свойства азота наблюдаются при горении аммиака на воздухе. Так как для азота наиболее устойчивая степень окисления — 0, то в результате этой реакции выделяется свободный азот.
Если в реакции горения использовать катализаторы (платину Pt и оксид хрома Cr2O3
4NH3 + 5 O2 → 4NO + 6H2O
Аммиак может восстанавливать металлы из их оксидов. Так реакцию с оксидом меди используют для получения азота.
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Реакция гидроксида меди с аммиаком
Аммиак обладает свойствами оснований и щелочей. При растворении его в воде образуется ион аммония и гидроксид-ион. При этом соединения NH4OH — не существует! Поэтому формулу аммиачной воды лучше записать, как формулу аммиака!
При растворении его в воде образуется ион аммония и гидроксид-ион. При этом соединения NH4OH — не существует! Поэтому формулу аммиачной воды лучше записать, как формулу аммиака!
Основные свойства аммиака проявляются также и в реакциях с кислотами.
NH3 + HCl → NH4Cl (нашатырь)
NH 3 + HNO3 → NH4NO3 (аммиачная селитра)
Аммиак реагирует с органическими веществами. Например, искусственные аминокислоты получают с помощью реакции аммиака и A-хлорзамещёнными карбоновыми кислотами. Выделяющийся в результате реакции хлороводород (газ HCl) связывают с избытком аммиака, в результате которого образуется нашатырь (или хлорид аммония NH4Cl).
Многие комплексные соединения содержат в качестве лиганда аммиак. Аммиачный раствор оксида серебра, который используется для обнаружения альдегидов, представляет собой комплексное соединение — гидроксиддиаммин серебра.
Ag2O + 4NH3 + H2O →2[Ag(NH3)2]OH
Соли аммония
Соли аммония — твёрдые кристаллические вещества, не имеющие окраски. Почти все они растворяются в воде, и им характерны все те же свойства, которые имеют известные нам соли металлов. Они взаимодействуют со щелочами, при этом выделяется аммиак.
NH4Cl + KOH → KCl + NH3 + H2O
При этом, если дополнительно воспользоваться индикаторной бумагой, то эту реакцию можно использовать — как качественную реакцию на соли аммония. Соли аммония взаимодействуют с другими солями и кислотами. Например,
(NH4)2SO4 + BaCl2 → BaSO4 + 2NH4Cl
(NH4)2CO3 + 2HCl2 → 2NH4Cl + CO2 + H2O
Соли аммония неустойчивы к нагреванию.
NH4Cl → NH3 + HCl
NH4NO2 → N2 + 2H2O
Последняя химическая реакция — разложение нитрита аммония — используется в химических лабораториях для получения чистого азота.
Аммиак — это слабое основание, поэтому соли, образованные аммиаком в водном растворе подвергаются гидролизу. В растворах этих солей имеется большое количество ионов гидроксония, поэтому реакция солей аммония — кислая!
NH4+ + H2O → NH3 + H3O+
Применение аммиака и его солей основано на специфических свойствах.
 Водный раствор аммиака можно купить в аптеках под названием нашатырный спирт.
Водный раствор аммиака можно купить в аптеках под названием нашатырный спирт.
Аммиак — Что такое Аммиак?
Аммиак представляет собой бинарное неорганическое химическое соединение азота и водорода
Аммиак (Ammonia, нитрид водорода) — химическое соединение азота и водорода с формулой Nh4, при нормальных условиях — бесцветный газ с резким характерным запахом.Плотность аммиака почти в 2 раза меньше, чем у воздуха, ПДКр.з. 20 мг/м3 — IV класс опасности (малоопасные вещества) по ГОСТ 12.1.007.
Растворимость Nh4 в воде чрезвычайно велика — около 1200 объемов (при 0°C) или 700 объемов (при 20°C) в объеме воды.
В холодильной технике носит название R717, где R — Refrigerant (хладагент), 7 — тип хладагента (неорганическое соединение), 17 — молекулярная масса.
Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство превышает 180 млн т.
Молекула аммиака имеет форму треугольной пирамиды с атомом азота в вершине. 3 неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами 3х атомов водорода (связи N − H), 4я пара внешних электронов является неподеленной, она может образовать ковалентную связь по донорно-акцепторному механизму с ионом водорода, образуя ион аммония Nh5+.
3 неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами 3х атомов водорода (связи N − H), 4я пара внешних электронов является неподеленной, она может образовать ковалентную связь по донорно-акцепторному механизму с ионом водорода, образуя ион аммония Nh5+.
Несвязывающее 2х-электронное облако строго ориентировано в пространстве, поэтому молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
В жидком аммиаке молекулы связаны между собой водородными связями. Сравнение физических свойств жидкого аммиака с водой показывает, что аммиак имеет более низкие температуры кипения (t
Это в некоторой степени объясняется тем, что прочность водородных связей в жидком аммиаке существенно ниже, чем у воды; а также тем, что в молекуле аммиака имеется лишь одна пара неподеленных электронов, в отличие от двух пар в молекуле воды, что не дает возможность образовывать разветвленную сеть водородных связей между несколькими молекулами.
Аммиак легко переходит в бесцветную жидкость с плотностью 681,4 кг/м3, сильно преломляющую свет.
Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счет образования водородных связей.
Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений.
Физические и химические свойства аммиака
Формула – NH3. Молярная масса – 17 г/моль.
Физические свойства аммиака
Аммиак (NH3) – бесцветный газ с резким запахом (запах «нашатырного спирта»), легче воздуха, хорошо растворим в воде (один объем воды растворят до 700 объемов аммиака). Концентрированный раствор аммиака содержит 25% (массовых) аммиака и имеет плотность 0,91 г/см3.
Связи между атомами в молекуле аммиака – ковалентные. Общий вид молекулы AB3. В гибридизацию вступают все валентные орбитали атома азота, следовательно, тип гибридизации молекулы аммиака – sp3. Аммиак имеет геометрическую структуру типа AB3E – тригональная пирамида (рис.
1).
Аммиак имеет геометрическую структуру типа AB3E – тригональная пирамида (рис.
1).
Химические свойства аммиака
В химическом отношении аммиак довольно активен: он вступает в реакции взаимодействия со многими веществами. Степень окисления азота в аммиаке «-3» — минимальная, поэтому аммиак проявляет только восстановительные свойства.
При нагревании аммиака с галогенами, оксидами тяжелых металлов и кислородом образуется азот:
2NH3 + 3Br2 = N2 + 6HBr
2NH3 + 3CuO = 3Cu + N2 + 3H2O
4NH3 +3O2 = 2N2 + 6H2O
В присутствии катализатора аммиак способен окисляться до оксида азота (II):
4NH3 + 5O2 = 4NO + 6H2O (катализатор – платина)
В отличие от водородных соединений неметаллов VI и VII групп, аммиак не проявляет кислотные свойства. Однако, атомы водорода в его молекуле все же способны замещаться на атомы металлов. При полном замещении водорода металлом происходит образование соединений, называемых нитридами, которые также можно получить и при непосредственном взаимодействии азота с металлом при высокой температуре.
Однако, атомы водорода в его молекуле все же способны замещаться на атомы металлов. При полном замещении водорода металлом происходит образование соединений, называемых нитридами, которые также можно получить и при непосредственном взаимодействии азота с металлом при высокой температуре.
Основные свойства аммиака обусловлены наличием неподеленной пары электронов у атома азота. Раствор аммиака в воде имеет щелочную среду:
NH3 + H2O ↔ NH4OH ↔ NH4+ + OH—
При взаимодействии аммиака с кислотами образуются соли аммония, которые при нагревании разлагаются:
NH3 + HCl = NH4Cl
NH4Cl = NH3 + HCl (при нагревании)
Получение аммиака
Выделяют промышленные и лабораторные способы получения аммиака. В лаборатории аммиак получают действием щелочей на растворы солей аммония при нагревании:
NH4Cl + KOH = NH3↑ + KCl + H2O
NH4+ + OH— = NH3↑+ H2O
Эта реакция является качественной на ионы аммония.
Применение аммиака
Производство аммиака – один из важнейших технологических процессов во всем мире. Ежегодно в мире производят около 100 млн. т. аммиака. Выпуск аммиака осуществляют в жидком виде или в виде 25%-го водного раствора – аммиачной воды. Основные направления использования аммиака – производство азотной кислоты (производство азотсодержащих минеральных удобрений в последствии), солей аммония, мочевины, уротропина, синтетических волокон (нейлона и капрона). Аммиак применяют в качестве хладагента в промышленных холодильных установках, в качестве отбеливателя при очистке и крашении хлопка, шерсти и шелка.
Примеры решения задач
Формула аммиака в химии
Определение и формула аммиака
Химическая формула –
Молярная масса равна г/моль.
Физические свойства – аммиак представляет из себя бесцветный газ с резким запахом, температура плавления , температура кипения , он хорошо растворяется в воде (при 30 массовых с плотностью 0,892 г/мл), спирте и ряде других органических растворителей.
Химические свойства аммиака
- проявляет амфотерные свойства (кислотные свойства очень слабые) поэтому взаимодействует с щелочными металлами, с кислотами, с окислителями, с ионами переходных металлов:
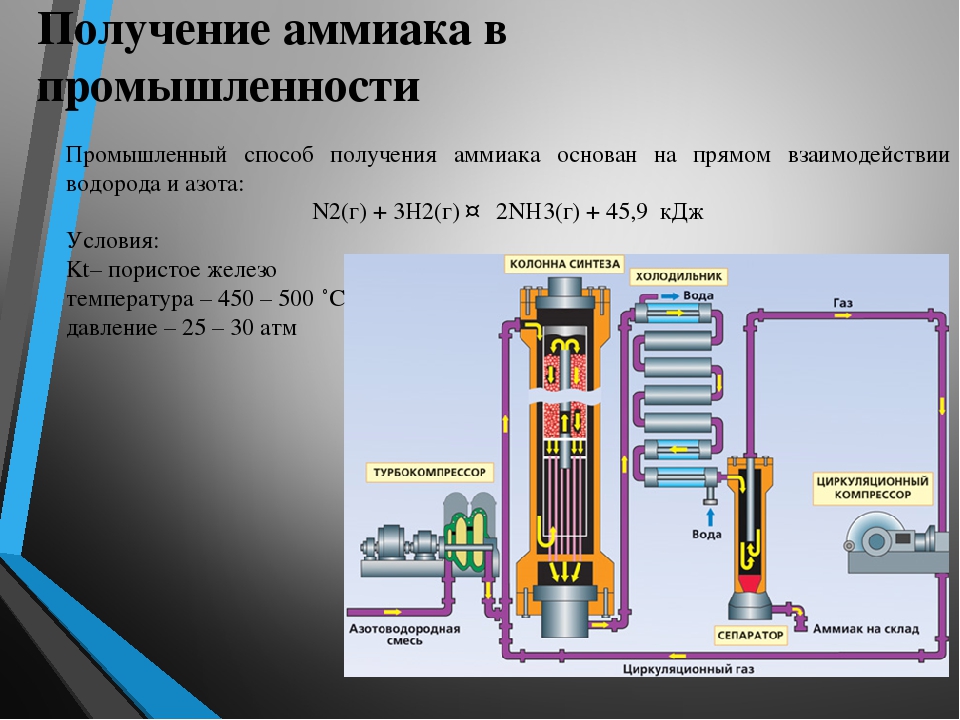
Получение аммиака
В промышленности аммиак получают прямым взаимодействием водорода и азота в присутствии различных катализаторов (платина, никель, железо):
В лаборатории аммиак получают действием сильных щелочей на соли аммония при нагревании:
Применение
Аммиак применяется для получения азотных удобрений, взрывчатых веществ, различных полимеров, используется в производстве азотной кислоты, соды и других продуктов химической промышленности, также нашёл применение в медицине в качестве возбудителя дыхания, стимулятора рвоты, примочек. Жидкий аммиак применяется как растворитель.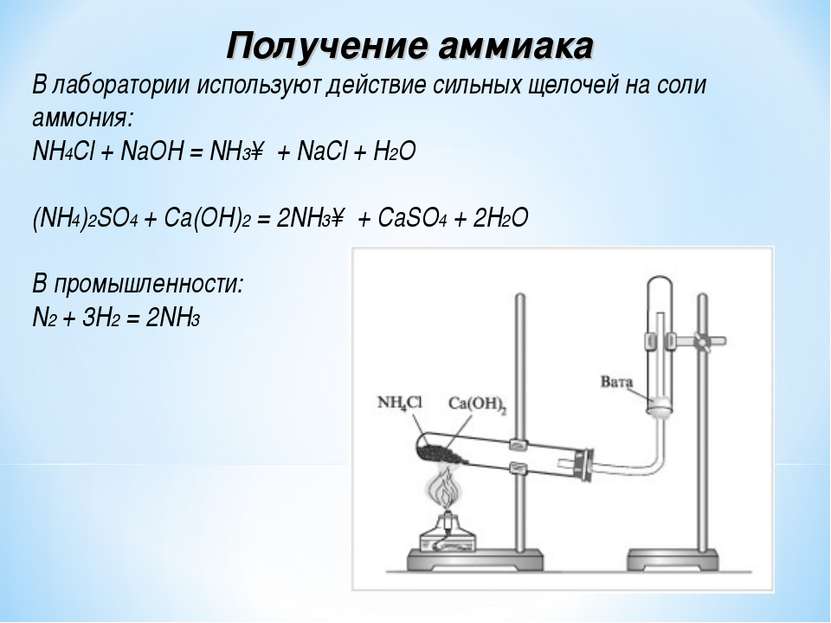
Качественная реакция
Качественной реакцией на аммиак является посинение смоченной водой лакмусовой бумаги. Другая качественная реакция на аммиак – это образование жёлто-бурого осадка при взаимодействие аммиака с реактивом Несслера:
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Современный процесс производства аммиака.
Современный процесс получения аммиака основан на его синтезе из азота и водорода при температурах 380 — 450 0C и давлении 250 атм с использованием железного катализатора:
N2 (г. ) + 3h3 (г.) = 2Nh4 (г.)
) + 3h3 (г.) = 2Nh4 (г.)
Азот получают из воздуха. Водород получают восстановлением воды (пара) с помощью метана из природного газа либо из лигроина. Лигроин (нафта) представляет собой жидкую смесь алифатических углеводородов, которая получается при переработке сырой нефти (см. гл. 18).
Работа современного аммиачного завода очень сложна. На рис. 7.2 показана упрощенная схема действия аммиачного завода, работающего на природном газе. Эта схема действия включает восемь стадий.
1-я стадия. Удаление серы из природного газа. Это необходимо, поскольку сера представляет собой каталитический яд (см. разд. 9.2).
2-я стадия. Получение водорода восстановлением пара при 750 0C и давлении 30 атм с помощью никелевого катализатора:
Ch5 (г.) + h3O (г.) = СО (г.) + ЗН 2 (г.)
3-я стадия. Впуск воздуха и сгорание части водорода в кислороде вводимого воздуха:
2h3 (г.) + O2 (г.) = 2h3O (г.) В результате получается смесь водяного пара, моноксида углерода и азота. Водяной пар восстанавливается с образованием водорода, как на 2-й стадии.
Водяной пар восстанавливается с образованием водорода, как на 2-й стадии.
4-я стадия. Окисление моноксида углерода, образующегося на стадиях 2 и 3, до диоксида углерода по следующей реакции «сдвига»: СО (г.) + h3O (г.) = CO2 (г.) + h3 (г.)
Этот процесс проводится в двух «реакторах сдвига». В первом из них используется катализатор из оксида железа и процесс проводится при температуре порядка 400 0C Во втором используется медный катализатор и процесс проводится при температуре 220°С.
5-я стадия. Вымывание диоксида углерода из газовой смеси при помощи буферного щелочного раствора карбоната калия или раствора какого-либо амина, например этаноламина Nh3Ch3Ch3OH. Диоксид углерода в конце концов сжижают и используют для производства мочевины, либо выпускают в атмосферу.
6-я стадия. После 4-й стадии в газовой смеси остается еще около 0,3% моноксида углерода. Поскольку он может отравлять железный катализатор во время синтеза аммиака (на 8-й стадии), моноксид углерода удаляют путем конверсии водородом в метан на никелевом катализаторе при температуре 325°С.
7-я стадия. Газовую смесь, которая теперь содержит приблизительно 74% водорода и 25% азота, подвергают сжатию; при этом ее давление возрастает от 25-30 атм до 200 атм. Поскольку это приводит к повышению температуры смеси, ее сразу же после сжатия охлаждают.
8-я стадия. Газ из компрессора поступает теперь в «цикл синтеза аммиака». Схема, приведенная на рис. 7.2, дает упрощенное представление об этой стадии. Сначала газовая смесь попадает в каталитический конвертер, в котором используется железный катализатор и поддерживается температура 380-450°С. Газовая смесь, выходящая из этого конвертера, содержит не более 15% аммиака. Затем аммиак сжижают и направляют в приемный бункер, а непрореагировавшие газы возвращают в конвертер.
Оглавление:
Практическое занятие «Получение аммиака и опыты с ним. Знакомство со свойствами водного раствора аммиака»
Цель: закрепить знания о свойствах
соединений азота со степенью окисления — 3,
добиться использования учащимися этих знаний
для объяснения наблюдаемых явлений.
Задачи.
Образовательные: формирование у учащихся необходимых теоретических навыков и умений, необходимых для выполнения лабораторных и практических работ; осуществление контроля за приобретенными знаниями.
Развивающие: развитие умений обобщать знания по данной теме, совершенствование учебных умений, развитие интереса к предмету.
Воспитательные: воспитание осознанной потребности в знаниях.
Задачи для учащихся: учащиеся должны собрать прибор для получения аммиака, получить аммиак, используя лабораторный способ, изучить физические свойства аммиака, взаимодействие данного вещества с водой и кислотами; провести реакции, подтверждающие основной характер гидроксида аммония; рассмотреть химизм процессов с точки зрения теории электролитической диссоциации; объяснить наблюдаемые явления.
Методы проведения занятия:
частично-поисковый, практические исследования,
самостоятельные работы учащихся.
Формы деятельности: индивидуальная, парная, групповая, фронтальная.
Оборудование: штатив, пробирка, вата, пробка с газоотводной трубкой, ложечка или шпатель, стеклянные палочки, нагревательный прибор, концентрированные азотная и соляная кислота, вода в химическом стакане, фенолфталеин, растворы серной кислоты и хлорида железа (111).
Ход урока
1. Организационный момент.
— Добрый день! Я рада видеть вас сегодня на уроке. Думаю, что наша совместная работа будет полезной и интересной. Давайте улыбнемся друг другу, настроимся на поиск и творчество и начинаем наш урок.
2. Повторение ранее изученного.
Часть В (задания с кратким ответом)
Среди перечисленных свойств укажите те свойства, которые характерны для аммиака:
- легче воздуха;
- тяжелее воздуха;
- газ желто-зеленого цвета;
- бесцветный газ;
- ядовитый;
- неядовитый;
- газ с резким запахом;
- газ без запаха.

Ответ дайте в виде последовательности цифр в порядке их возрастания.
Ответ: 1457.
3. Подготовка к выполнению работы.
1. Фронтальное обсуждение хода практической работы.
2. Составление схемы опытов.
3. Схема записывается на доске и несколько раз “озвучивается” технологическим планом. Это необходимо, так как учащимся надо быстро выполнить большое количество действий, а их последовательность забывается.
4. Фронтальное обсуждение вопросов.
- Как должна быть расположена в штативе пробирка для получения аммиака? Почему?
- Иногда пробирка для получения аммиака при нагревании лопается. Почему? Каким образом нужно нагревать?
- Как определить выделение аммиака? По каким признакам вы установите, что пробирка заполнена аммиаком?
- Почему аммиак собирают в пробирку, держа ее вверх дном?
- Что будем наблюдать при опускании пробирки с аммиаком в воду?
4. Повторение правил по технике безопасности.
Повторение правил по технике безопасности.
Следует обратить внимание учащихся на то, что запах аммиака очень резок. Настолько, что может привести в чувство человека, потерявшего сознание, когда к его носу подносят ватку, смоченную нашатырным спиртом(10%-ным водным раствором аммиака). Вдыхание больших количеств аммиака сопровождается удушьем, слезотечением, головокружением и болями в желудке.
Поэтому желательно провести все опыты быстро, перенести прибор под тягу и не вдыхать аммиак.
5. Выполнение работы.
Перед началом работы целесообразно разделить класс на группы, с тем чтобы каждая группа выполняла свой вариант заданий. Если реактивов достаточное количество, можно разделить на три группы.
В ходе выполнения работы использовать инструктивную карточку.
Дифференцированные самостоятельные работы
Вариант 1 — задания этой группы необходимы
умения: проводить эксперимент, правильно
описывать наблюдаемые явления, анализировать
результаты эксперимента, формулировать частные
и общие выводы.
Вариант 2 — они должны провести теоретический анализ, экспериментально подтвердить высказанные предложения, объяснить наблюдения и сформулировать вывод.
Вариант 3 — теоретически обосновать гипотезу и экспериментально ее проверить.
Цель: познакомиться со способом получения аммиака и изучить его свойства.
Вариант 1
1. Получить аммиак.
Опыт №1
Инструкция.
1) Возьмите два кристаллических вещества: хлорид аммония и гидроксид кальция. Какие вещества образуются при взаимодействии хлорида аммония и гидроксида кальция? Напишите уравнение реакции.
2) Соберите прибор для получения аммиака.
3) Получите аммиак и соберите его в пробирку. Для этого равные объемы хлорида аммония и гидроксида кальция перемешайте в ступке и поместите в сухую пробирку. Осторожно нагрейте смесь.
4) Назовите четыре физических свойства аммиака,
которые вы обнаружили в этом опыте.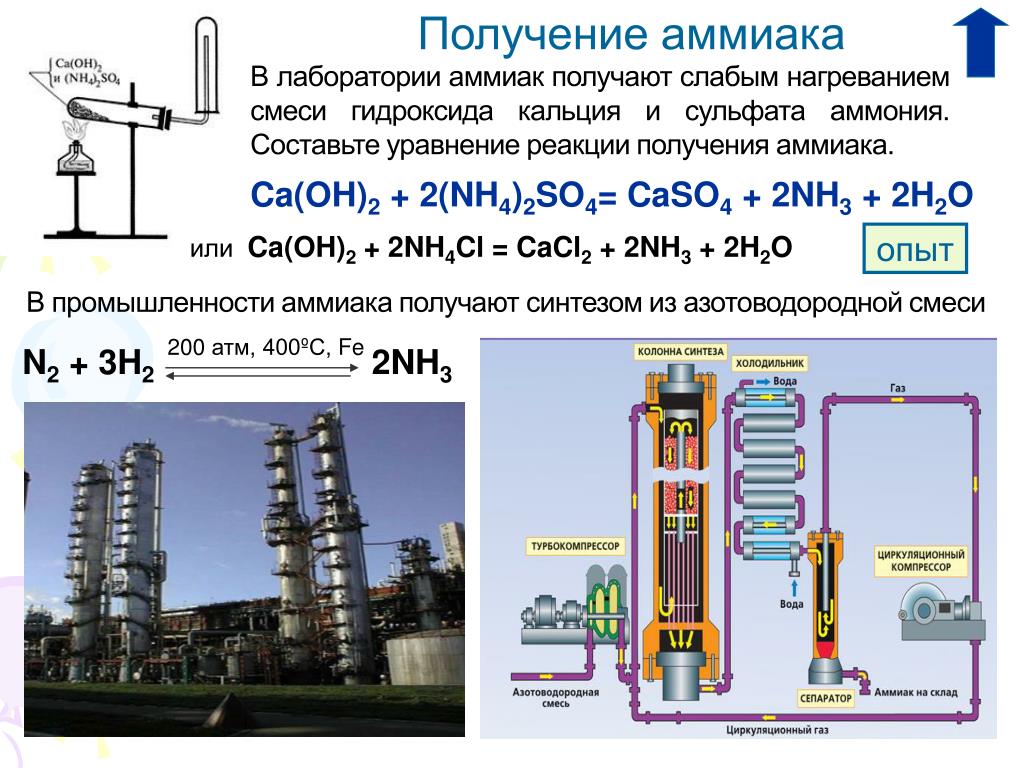
5) Изучите растворимость аммиака в воде.
Опыт №2
Инструкция.
1) Пробирку с аммиаком закройте пробкой, в которую вставлена пипетка с водой. Выдавите воду из пипетки в пробирку с аммиаком и опустите пробирку с аммиаком в сосуд с водой. Под водой снимите с пипетки колпачок. Опишите наблюдения и объясните их. Обобщите, какими физическими свойствами обладает аммиак.
2) К полученному раствору аммиака прилейте каплю раствора фенолфталеина. Объясните наблюдения. Сделайте вывод, к какому классу соединений относится продукт взаимодействия аммиака с водой. Запишите уравнение реакции.
3) Изучите взаимодействие аммиака с кислотами.
Опыт №3
Инструкция.
1) Нагрейте смесь хлорида аммония и гидроксида кальция, поднесите к отверстию газоотводной трубки палочку, смоченную концентрированной соляной кислотой.
2) Опишите наблюдения, объясните их.
3) Запишите уравнение реакции.
4) Изучите свойства водного раствора аммиака.
Опыт №4
Инструкция.
1) Нагрейте водный раствор аммиака, в который добавлен раствор фенолфталеина; опишите наблюдения и объясните их. Запишите уравнение реакции.
2) Исследуйте раствор хлорида аммония на лакмус. На основании исследования среды раствора сделайте вывод о силе гидроксида аммония как основания.
3) Проведите реакцию гидроксида аммония с раствором серной кислоты: в пробирку налейте раствор аммиака в воде объемом 4-5 мл. Добавьте в него 2-3 капли раствора фенолфталеина и прилейте к нему по каплям раствор серной кислоты до исчезновения малиновой окраски. Объясните наблюдения, запишите ионные уравнения реакций (полное и сокращенное).
4) Проведите реакцию гидроксида аммония с
раствором хлорида алюминия: в пробирку налейте
раствор хлорида алюминия объемом 2-3 мл и добавьте
раствор аммиака в воде того же объема. Объясните
наблюдения, запишите ионные уравнения реакций
(полное и сокращенное).
Объясните
наблюдения, запишите ионные уравнения реакций
(полное и сокращенное).
5) Сформулируйте вывод о свойствах водного раствора аммиака.
Вариант 2
1. Получите аммиак и изучите его свойства: растворимость в воде; химический характер продукта его взаимодействие аммиака с кислотами.
Опыт №1
Инструкция.
1) Выберите из стоящих на столе реактивов те, которые вам необходимы для получения аммиака и изучения его свойств.
2) Соберите прибор для получения аммиака и изучения его свойств.
3) Проведите опыты. Оформите результаты опытов. Запишите уравнения реакций в молекулярном и ионном виде.
4) Сформулируйте вывод о физических свойствах аммиака.
5) Нагрейте водный раствор аммиака, в который
добавлен раствор фенолфталеина. Опишите
наблюдения и объясните их. Запишите уравнение
реакции. Сформулируйте вывод.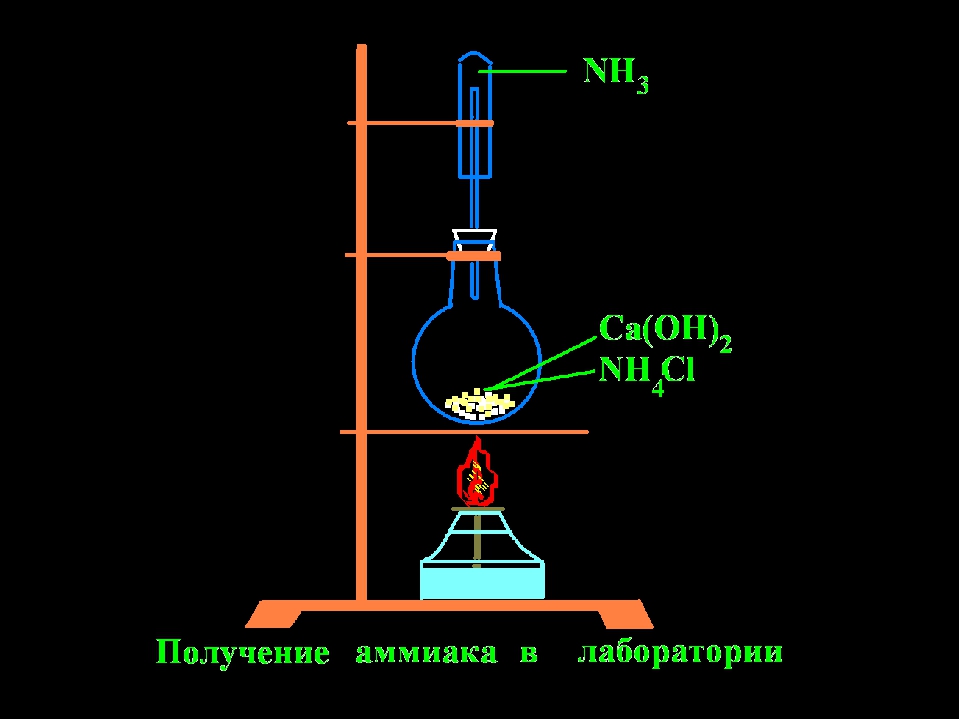
6) Исследуйте раствор хлорида аммония на лакмус. Напишите уравнение реакции гидролиза хлорида аммония.
7) С какими из предложенных веществ: хлорид натрия, хлорид алюминия, серная кислота, азотная кислота, сульфат калия – будет взаимодействовать водный раствор аммиака? Докажите правильность ваших ответов. Оформите результаты опытов. Сделайте вывод о свойствах водного раствора аммиака.
Вариант 3
1. Получите аммиак и изучите его свойства: растворимость в воде; свойства продукта взаимодействия его с водой; взаимодействие с кислотами.
Опыт №1
Инструкция.
1) Выскажите обоснованные предположения о том, какие из предложенных веществ: гидроксид кальция, хлорид аммония, гидроксид натрия, серная кислота – можно использовать для получения аммиака.
2) Выберите наиболее простой способ получения
аммиака. Отберите реактивы, необходимые для
получения аммиака и изучения его свойств.
Соберите прибор для получения аммиака. Проведите
опыты.
Отберите реактивы, необходимые для
получения аммиака и изучения его свойств.
Соберите прибор для получения аммиака. Проведите
опыты.
3) Оформите результаты опытов. Уравнения реакций запишите в молекулярном и ионном виде.
4) На основании результатов опытов сформулируйте вывод о физических и химических свойствах аммиака.
5) Предложите и проведите опыт, доказывающий, что водный раствор аммиака – слабый электролит.
6) Выберите из предложенных вам реактивов те, с которыми будет реагировать водный раствор аммиака: гидроксид калия, соляная кислота, азотная кислота, сульфат натрия, хлорид алюминия. Экспериментально проверьте правильность вашего выбора. Оформите результаты опытов. Уравнения реакций запишите в молекулярном и ионном виде.
7) Сформулируйте вывод о свойствах водного раствора аммиака.
2. Оформление результатов практического занятия.
| № опыта | Действия | Наблюдения (рисунки) |
Объяснения, выводы |
Запись молекулярных и ионных уравнений реакций |
Закрепление знаний
Задание №1
Установите соответствие между индикатором и
окраской этого индикатора в водном растворе
аммиака. Ответ дайте в виде последовательности
цифр, соответствующих буквам по алфавиту.
Ответ дайте в виде последовательности
цифр, соответствующих буквам по алфавиту.
| Индикатор | Окраска индикатора |
| А) метилоранж, | 1) малиновая, |
| Б) лакмус, | 2) синяя, |
| В) фенолфталеин, | 3) фиолетовая, |
| 4) желтая. |
Ответ: 421.
Задание №2
В ходе синтеза аммиака из азота и водорода было
израсходовано 140 г азота. Образовавшийся аммиак
полностью прореагировал с избытком соляной
кислоты. Определите массу (в граммах)
образовавшегося хлорида аммония.
Определите массу (в граммах)
образовавшегося хлорида аммония.
Задание №3
Аммиак реагирует с кислородом в присутствии металлической платины. Определите массу в граммах образовавшегося оксида азота (II), если прореагировало 1000 л (н.у) аммиака, а выход продукта реакции равен 70,9 %. Ответ дайте в виде целого числа без указания единиц измерения.
Задание №4
Укажите, какое суждение является правильным:
А) аммиак получают методои вытеснения воздуха, держа пробирку кверху дном; Б) в лаборатории аммиак получают, нагревая смесь сухих гидроксида кальция и хлорида аммония.
1) верно только А,
3) верны оба суждения,
2) верно только Б,
4) оба суждения неверны.
Ответ: 3.
Итог урока. После заполнения таблицы
учащиеся делают вывод о том, что они научились
делать в результате практической работы.
Они должны записать название и химическую формулу, сделать пояснения.
Домашнее задание: закончить оформление практической работы. Подготовить сообщение: “Нитраты”.
Аммоний получение аммиака — Справочник химика 21
Получение аммиака из хлорида аммония. Приготовьте смесь, состоящую из 1—2 микрошпателей хлорида аммония [c.164]Лабораторный способ получения аммиака основан на взаимодействии хлорида аммония с гашеной известью при нагревании. [c.131]
Определить массу нитрата аммония, полученного прп взаимодействии избытка аммиака с 50%-ным раствором азотной кислоты массой 25 т. [c.180]
Лабораторный метод получения нитрата аммония из аммиака и азотной кислоты лежит в основе промышленных решений. В рассматриваемом случае проблема сводится к нахождению экономичных методов промышленного производства аммиака и азотной кислоты.
 [c.59]
[c.59]Водородистые соединения. Их электролитическая и восстановительная характеристика. Методы получения. Аммиак. Нитриды и фосфаты. Аммоний как комплексный ион. Соли аммония и их химические свойства. Аммиакаты. [c.250]
Необходимую при этом способе двуокись углерода получают обжигом известняка. Остающийся после обжига СаСОд СаО идет для приготовления известкового молока, применяемого для регенерации (обратного получения) аммиака из хлорида аммония, образующегося наряду с гидрокарбонатом натрия. [c.473]
Получение нитрата аммония действием аммиака ца водный раствор азотной кислоты. [c.175]
Фиксация атмосферного азота. Получение аммиака. До конца прошлого столетия аммиак получался в промышленном масштабе исключительно как побочный продукт при коксовании каменного угля. Каменный уголь содержит от 1 до 2% азота. При сухой перегонке угля почти весь этот азот выделяется в виде аммиака и солей аммоння. Отделение аммиака и солей аммония от других газообразных продуктов сухой перегонки достигается пропусканием коксового газа через воду. Из этой аммиачной или, как ее на -)ывают, газовой воды аммиак выделяется при нагревании с известью. [c.404]
Отделение аммиака и солей аммония от других газообразных продуктов сухой перегонки достигается пропусканием коксового газа через воду. Из этой аммиачной или, как ее на -)ывают, газовой воды аммиак выделяется при нагревании с известью. [c.404]
Сколько граммов хлористого аммония взаимодействуют при получении аммиака с а) 28 г окиси кальция [c.84]
Написать уравнение реакции образования азотнокислого аммония из аммиака и азотной кислоты. Вычислить по составленному уравнению, сколько каждого реагента необходимо для получения соли в количестве а) 40 г [c.84]
Исследуемый раствор, содержащий ионы магния (- 5-10 моль), помещают в мерную колбу емкостью 25 мл и доводят раствор дистиллированной водой до метки. Переносят пипеткой в два стакана емкостью 200 мл пробы раствора по 10 мл. В каждый стакан добавляют по 5 мл 25%-ного раствора аммиака и 5 г хлорида аммония. Полученный раствор дистиллированной водой доводят до 50 мл, помещают в кристаллизатор со льдом п затем вводят в него трубку с пористым фильтром прибора для радиометрического титрования (см. рис. 135). [c.351]
рис. 135). [c.351]
При введении в эту систему ионов водорода происходит свя зывание ОН , вследствие чего в кислой среде равновесие реакции смещается вправо. Увеличение же концентрации ионов ОН ,, напротив, смещает равновесие реакции влево. Именно на этом основан лабораторный способ получения аммиака взаимодействием солей аммония со щелочами. На этом же основан и один из способов качественного открытия иона аммония при действии щелочи на раствор, содержащий ионы МН , выделяется аммиак, который обнаруживается по запаху либо по его действию на лакмусовую бумагу. [c.170]
Написать уравнение реакции получения аммиака действием едкого натра на гидрофосфат аммония. [c.196]
Основа — медь и ее сплавы. Кадион И растворяют в воде из расчета 2 г на 100 см раствора (раствор I). Персульфат аммония и аммиак (плотность 0,91 г/см ) растворяют в воде нз расчета 10 г (первого) и 10 см- (второго) на 100 см раствора (раствор 2). Растворы 1 и 2 смешивают в отношении объемов 1 1 и добавляют пропиловый спирт в отиошеинн 4 1. Диоксид титана замешивают на полученной смеси из расчета 12—15 г на [c.275]
Растворы 1 и 2 смешивают в отношении объемов 1 1 и добавляют пропиловый спирт в отиошеинн 4 1. Диоксид титана замешивают на полученной смеси из расчета 12—15 г на [c.275]
Для получения аммиака используйте прибор, показанный на рис. 52. В фарфоровой ступке приготовьте небольшое количество смеси из хлорида аммония и гашеной извести (по объема пробирки каждого вещества) и тщательно разотрите пестиком. Обратите внимание на запах. Наблюдается ли взаимодействие между взятыми веществами при обычных условиях [c.136]
Напишите уравнения реакций получения аммиака при условии, что одним из исходных веществ будет являться а) азот, б) соль аммония, в) азотная кислота, г) нитрид алюминия. [c.152]
В своем учебипке Г. И. Гесс широко применял химические урав-ненля, что было для того времени большим нововведением. Например, получение аммиака из хлорида аммония и оксида кальция и образование мочевипы оп выразил так [c. 142]
142]
Соли аммония могут быть использованы для получения аммиака в лабораторных условиях [c.85]
В лаборатории аммиак получают действием сильных Получение аммиака оснований на соли аммония [c.465]
Укажите названия и формулы аммониевых солей ортофосфорной кислоты. Почему аммиак может быть получен из них путем простого нагревания, тогда как для получения аммиака из хлористого аммония последний необходимо предварительно смешать с известью или едким натром и т. п. [c.229]
Аммиак. Строение молекулы. Окислительно-зосстановительные свойства. Растворение в воде, гидрат аммиака и e o свойства. Соли аммония, их гидролиз и термическое разлсясенис. Получение аммиака в лаборатории и в промышленности. [c.133]
Соединенные вместе кислотные вытяжки помеш ают в 3-лит-ровую круглодонную колбу и кипятят с обратным холодильником в течение 2 час. (примечание 1). Продукт гидролиза разбавляют водой, доводя объем раствора до 2 и подвергают его перегонке в вакууме (20—30 мм), для того чтобы удалить весь бензальдегид и прочие летучие примеси (примечание 2).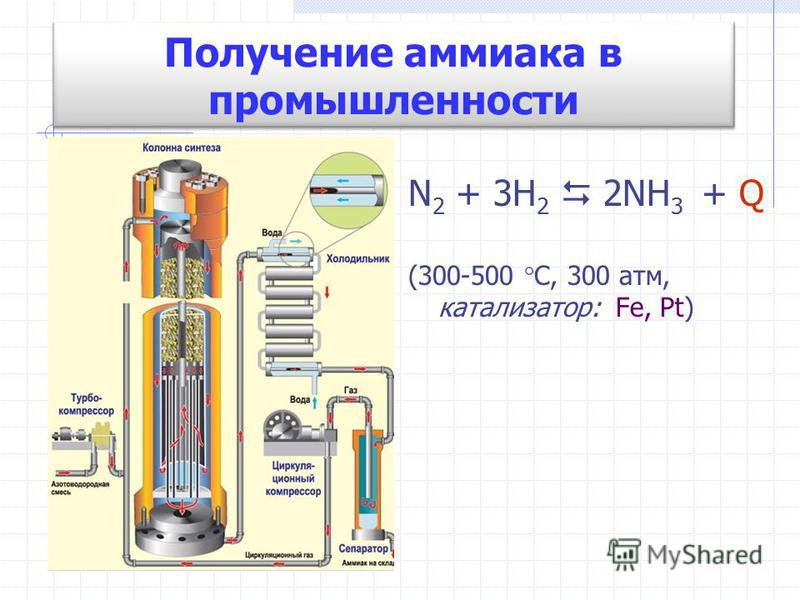 Чтобы освободиться от некоторого количества смолистых примесей, выпавших в осадок во время гидролиза, смесь обрабатывают 10 г активированного березового угля и фильтруют через воронку Бюхнера, Желтый фильтрат переносят в 3-литровый стакан и при перемешивании от руки толстой стеклянной палочкой приливают к нему через капельную воронку аммиак (уд. вес 0,90) до тех пор, пока реакция жидкости на лакмус не станет слегка щелочной (примечание 3). Смесь разогревается, появляется сильный запах бензальдегида, и аминокислота выпадает в осадок в виде желтых кристаллов. Смесь охлаждают до комнатной температуры и кристаллы отфильтровывают на воронке Бюхнера диаметром 15 см. Для удаления хлористого аммония полученные кристаллы промывают небольшими порциями воды (всего 1 л), а затем последовательно 150 мл этилового эфира, тремя порциями горячего 95%-ного этилового спирта по 50 мл и, наконец, 500 мл воды. Кристаллы тщательно отсасывают и отжимают. Выход составляет 220—240 г (примечание 4). Окончательное высушивание кристаллов производят в вакуум-эксикаторе над фосфорным ангидридом.
Чтобы освободиться от некоторого количества смолистых примесей, выпавших в осадок во время гидролиза, смесь обрабатывают 10 г активированного березового угля и фильтруют через воронку Бюхнера, Желтый фильтрат переносят в 3-литровый стакан и при перемешивании от руки толстой стеклянной палочкой приливают к нему через капельную воронку аммиак (уд. вес 0,90) до тех пор, пока реакция жидкости на лакмус не станет слегка щелочной (примечание 3). Смесь разогревается, появляется сильный запах бензальдегида, и аминокислота выпадает в осадок в виде желтых кристаллов. Смесь охлаждают до комнатной температуры и кристаллы отфильтровывают на воронке Бюхнера диаметром 15 см. Для удаления хлористого аммония полученные кристаллы промывают небольшими порциями воды (всего 1 л), а затем последовательно 150 мл этилового эфира, тремя порциями горячего 95%-ного этилового спирта по 50 мл и, наконец, 500 мл воды. Кристаллы тщательно отсасывают и отжимают. Выход составляет 220—240 г (примечание 4). Окончательное высушивание кристаллов производят в вакуум-эксикаторе над фосфорным ангидридом. Выход неочищенной аминокислоты составляет 102— 116 г (34—39% теоретич.). [c.64]
Выход неочищенной аминокислоты составляет 102— 116 г (34—39% теоретич.). [c.64]
Образование нересыщенного раствора илн нара при. химической реакции может происходить в результате химического взаи.модей-ствия двух исходных веществ или разложения одного вещества. К реакциям первого тина относятся получение элементарных металлов, оксидов, гидроксид.ов и других соединений металлов из их растворимых солей н соответствующих реагентов, синтез солей аммония из аммиака и парообразных кислот, гидратация и гидролиз различит,IX иоиов н соединений как в жидкой водной среде, так и парами воды в воздухе, К реакциям второго тнна относится, наиример, фотохимическое разложение некоторых металлорганн-ческих С едниеипй. [c.191]
По Nh5OH неустойчив и ра сиадается на аммнак и воду, поэтому прн взаимодействии соли аммония со щелочами выделяется аммиак. Эта реакция лежит в основе лабораторного способа получения аммиака [c.206]
Получение аммиака.
 В лаборатории аммиак получают при взаимодействии хлорида аммония Nh5 I с гидроксидом кальция Са(ОН)г [c.381]
В лаборатории аммиак получают при взаимодействии хлорида аммония Nh5 I с гидроксидом кальция Са(ОН)г [c.381] Способы получения. Получение чистого кобальта довольно затруднительно. Для выделения чистого металлического кобальта обычно используются его мышьяковистые руды, которые обжигом при доступе воздуха сначала переводят в смесь оксидов и арсенатов. Полученную смесь растворяют в соляной кислоте, затем осаждают сероводородом сульфиды меди, висмута и других металлов, а остаток окисляют хлором. К окисленному остатку прибавляют карбонат кальция, который вызывает осаждение гидроксида железа и арсената кальция. Выпавший осадок отфильтровывают. К фильтрату прибавляют точно необходимое количество хлорной извести для образования осадка черного оксида С02О3 (НзО) . Большая часть никеля при этом остается в растворе. Во время процесса следят за тем, чтобы не было добавлено избытка хлорной извести. Полученный оксид кобальта (П1) восстанавливают водородом и растворяют в кислотах.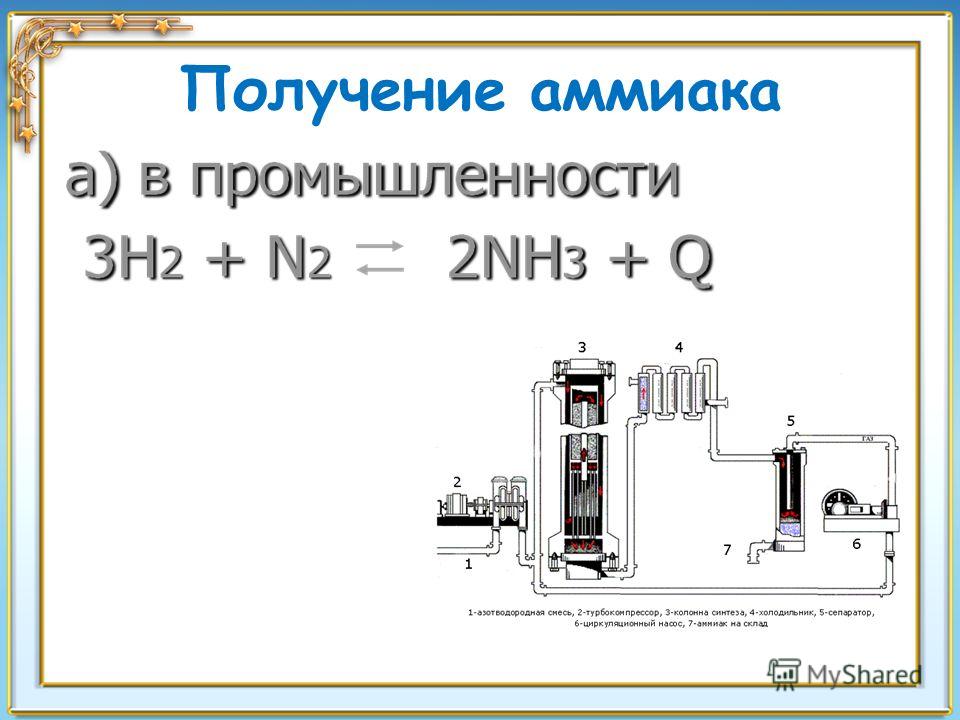 Электролизом полученных при этом солей кобальта выделяют химически чистый металл. Особенно чистый кобальт получают электролизом раствора сульфата кобальта, к которому прибавляют сульфат аммония и аммиак. [c.370]
Электролизом полученных при этом солей кобальта выделяют химически чистый металл. Особенно чистый кобальт получают электролизом раствора сульфата кобальта, к которому прибавляют сульфат аммония и аммиак. [c.370]
Свойство солей аммония отщеплять при действии на них щелочей аммиак используется для получения аммиака в лаборатории. Это же свойство используют для распознавания солей аммония. В пробирку с испытуемой солью или ее раствором приливают раствор щелочи и смесь подогревакЛ. По запаху или по посинению смоченной водой красной лакмусовой бумажки, которую подносят к отверстию пробирки, заключают, происходит ли выделение аммиака. Если аммиак выделяется, то, значит, в растворе соли содержались ионы аммония. [c.51]
Со—Re — Р-покрытие Для получения этих покрытий использовался раствор следующего состава (г/л) хлористый кобальт 30, гнпофосфит натрия 20, лимоннокислый натрий 80 хлористый аммоний 50, аммиак (25 % ный) 60 мл/л В указанный раствор вводился перренат калия в количестве О—0 8 г/л, pH 8—9, температура — 95 °С В качестве основы использовались медные пластины -Результаты исследования представлены на рис 29 [c. 72]
72]
Получение сульфата аммония из аммиака коксового газа. В коксовом газе содержится 7—10 г/м аммиака, который перерабатывают в сульфат аммония чаще всего по так называемому полупрямому способу. Процесс, проводимый по этому способу, состоит из следующих стадий первичного охлаждения коксового газа и выделения из него смолы переработки надсмоль-ной воды, образующейся при охлаждении газа, с последующей отгонкой аммиака переработки аммиака в сульфат аммония. [c.229]
Полученный раствор, состоящий из карбамата аммонии, карбамида, аммиака и воды, из реактора поступает в стриппер, где при 170—190 °С н 14,3—15,2 МПа происходит разложение карбамата (как указано выше). После стриппера 5 раствор карбамида поступает в разлагатель низкого давлении 7, у которого имеются встроенный теплообменник и вверху ректификационная колонна. В разлагателе 7 при 0,25 МПа и 130—140 °С происходит разложение оставшегося карбамата и отгон аммиака н диоксида углерода из раствора.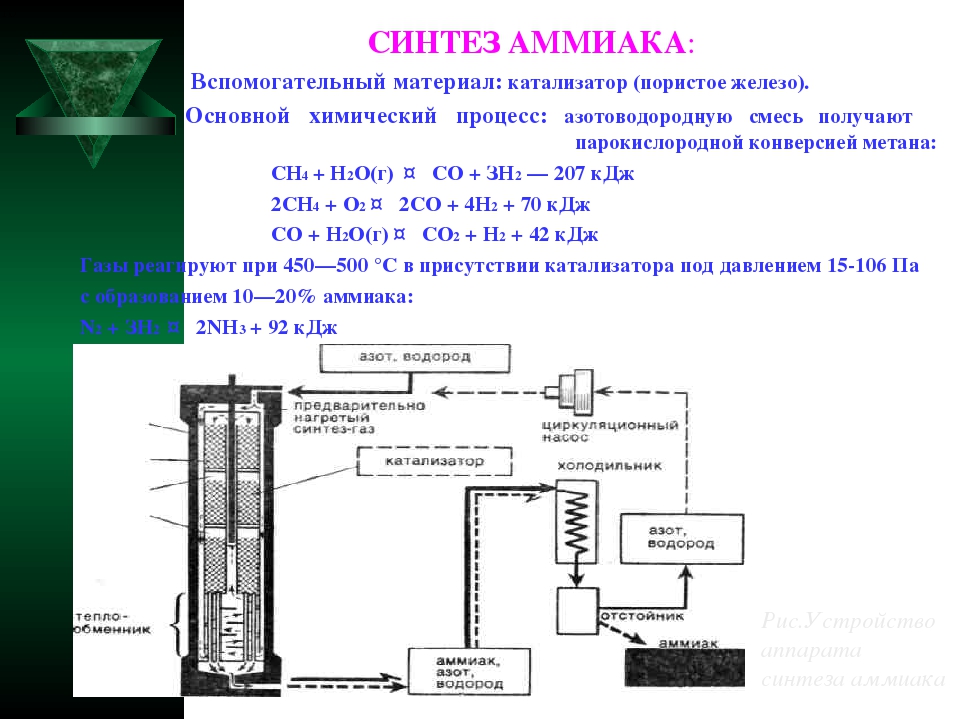 Тепло, необходимое для разложения карбамата аммония, обеспечивается подачей пара во встроенный теплообменник. После этого раствор через сепаратор 8 и емкость 9 насосом 10 подают на выпарку, а упаренный раствор на граиулицию. Готовый продукт в виде гранул 1—4 мм поступает на склад. [c.271]
Тепло, необходимое для разложения карбамата аммония, обеспечивается подачей пара во встроенный теплообменник. После этого раствор через сепаратор 8 и емкость 9 насосом 10 подают на выпарку, а упаренный раствор на граиулицию. Готовый продукт в виде гранул 1—4 мм поступает на склад. [c.271]
Аланин может быть получен нагреванием этилового эфира а-хлорпропионовой кислоты с концентрированным водным аммиаком при 100° обработкой а-бромпропионовой кислоты спиртовым или водным раствором аммиака каталитическим восстановлением раствора аммонийной соли пировиноградной кислоты в присутствии аммиака или же оксима пировиноградной кислоты действием синильной кислоты на альдегид-аммиак действием цианистого аммония и аммиака на ацетальдегид с последующим омылением щелочью а также метилированием этилового эфира бензиминомалоновой кислоты с последующим омылением и декарбоксилированием . Пропись, приведенная в разделе Л, основана на видоизмененном методе с синильной кислотой и альдегид-аммиаком, разработанном Зелинским и Стадниковым . Имеется тщательное исследование метода получения аланина, исходя из цианистого аммония и ацетальдегида i . [c.24]
Имеется тщательное исследование метода получения аланина, исходя из цианистого аммония и ацетальдегида i . [c.24]
Протекающая в обратном направлении реакция между аммиаком и водой используется как один из удобных лабораторных методов получения аммиака. Обрабатывая сильным основанием какую-нибудь соль аммония, например Nh5 1, можно получить аммиак [c.336]
На предприятиях азотной промышленности для первой стадии регенерации катионитовых фильтров, насыщенных катионами жесткости, рационально применять вместо хлорида натрия хлорид или нитрат аммония, а вместо содово-щелочной смеси использовать раствор смеси карбоната аммония с аммиаком (либо водный раствор аммиака, наполовину карбонизованный диоксидом углерода дымовых газов или содержащимся в воздухе, использованном в декарбонизациопных колоннах ионообменных установок). В результате обработки катионита раствором соли аммония на первой стадии регенерацит он переходит в ЫН4+-форму. На второй стадии регенерации катионита 20%-ным раствором серной кислоты отработанный раствор содержит сульфат аммония и после нейтрализации остаточной кислоты аммиаком может быть направлен в производство сульфата аммония непосредственно или в смеси с отработанным раствором после регенерации ОН -фильтров I ступени (находящихся в 5042—форме). Возможно также получение твердого кристаллического или гранулированного сульфата аммония в распылительных сушилках-грануляторах кипящего слоя. [c.228]
Возможно также получение твердого кристаллического или гранулированного сульфата аммония в распылительных сушилках-грануляторах кипящего слоя. [c.228]
После охлаждения тигель помещают в фарфоровую чашку, наливают в него горячую воду, нагревают и смывают в чашку Через 15 мин вводят еще 50 мл воды, нагревают на водяной бане до полного разложения плава Жидкость декантируют через фишьтр, а остаток в чашке снова растирают г 50 мл воды, дают осесть и декантируют Такое выщелачивание повторяют несколько раз Полученный фильтрат, кроме калия и натрия, может содержать магний, кальций, сульфаты и другие элементы Кальций удаляют осаждением карбонатом аммония и аммиаком при кипячении Фильтруют, промывают горячей водой Осадок растворяют в соляной кислоте и снова осаждают карбонат кальция, фильтруют Все фильтраты выпаривают досуха, прокаливают для удаления соли аммония Остаток растворяют в 25 мл воды, и для осаждения следов кальция добавляют оксалат аммония и подщелачивают аммиаком Помещают на водяную баню на 30 мин, фильтруют и промывают осадок 0,17о-ным раствором оксалата аммония Фильтрат выпаривают досуха в платиновом тигле, прокаливают, остаток смачивают соляной кислотой, снова выпаривают, сушат 30 мин при 110° С, затем нагревают до начала плавления солей, охлаждают и взвешивают сумму хлоридов щелочных металлов [2584] [c. 28]
28]
Кремнефтороводородная кислота. В свободном (от воды) виде не выделен. Существует в растворе тетрафторида кремния в жидком HF. Устойчив в бесцветном водном растворе (максимальная массовая доля 0,61), перегоняется без разложения в виде 13,3 /о-го раствора. Твердые белые кристаллогидраты HiiSiF ] 4Н 0 (г = -53 С (с разл.)] и H (SiF ] 2H 0 (/ +19 С) имеют ионное строение (Hj02)2[SiF ] и (h40 ) [SiF ]. Не разлагается разбавленными кислотами. Нейтрализуется щелочами, гидратом аммиака, реагирует с карбонатами щелочных, щелочноземельных металлов и аммония. Получение см. 222 -, 226 232 [c.118]
Герцснбсргит. Коричневый и темногидратом аммиака, сульфидами щелочных металлов. Разлагается кислотами, щелочами. Переводится в раствор действием полисульфида аммония. Получение см. 246, 248 , 252, 255. [c.128]
Желтый, мягкий, жирный на ощупь как графит ( сусальное золото ). Устойчив на воздухе, при нагревании темнеет и разлагается. Не растворяется в воде. Образует коричневый кристаллогидрат SnS 2HjO. Не реагирует с разбавленными кислотами, щелочами, гидратом аммиака. Разлагается в концентрированной хлороводородной кислоте. Переводится в раствор концентрированными щелочами, сульфидами щелочных металлов, гидросульфидом аммония. Получение см. 246 , 25б . [c.128]
Не растворяется в воде. Образует коричневый кристаллогидрат SnS 2HjO. Не реагирует с разбавленными кислотами, щелочами, гидратом аммиака. Разлагается в концентрированной хлороводородной кислоте. Переводится в раствор концентрированными щелочами, сульфидами щелочных металлов, гидросульфидом аммония. Получение см. 246 , 25б . [c.128]
Бесцветная жидкость, низкокипящая, термически устойчивая. Разлагается во влажном воздухе ( дымит ). Гидролизуется водой, реагирует со щелочами, фтороводородом, аммиаком. Апротонный растворитель, еренно растворяет хлориды металлов и аммония. Получение см. 319, 348 , 349 . [c.182]
Процесс Хабера — Chemistry LibreTexts
- Последнее обновление
- Сохранить как PDF
- Состав
- Температура
- Давление
- Катализатор
- Участники и атрибуты
Процесс Габера используется при производстве аммиака из азота и водорода, а затем объясняются причины условий, используемых в процесс. В этом процессе азот из воздуха объединяется с водородом, полученным в основном из природного газа (метана), в аммиак. Реакция обратима, и образование аммиака является экзотермическим.
В этом процессе азот из воздуха объединяется с водородом, полученным в основном из природного газа (метана), в аммиак. Реакция обратима, и образование аммиака является экзотермическим.
\ [\ ce {N2 (g) + 3h3 (g) <=> 2Nh4 (g)} \ label {eq1} \]
с \ (ΔH = -92,4 кДж / моль \).
Блок-схема процесса Габера выглядит так:
Рисунок \ (\ PageIndex {1} \): Схема процесса ГабераОбщие условия процесса
- Катализатор: Катализатор на самом деле немного сложнее чистого железа.К нему в качестве промотора добавлен гидроксид калия — вещество, повышающее его эффективность.
- Давление : Давление варьируется от одного завода к другому, но всегда высокое. Вы не ошибетесь в экзамене на 200 атмосфер.
- Рециркуляция: При каждом прохождении газов через реактор только около 15% азота и водорода превращается в аммиак. (Эта цифра также варьируется от завода к предприятию.) При непрерывной рециркуляции непрореагировавших азота и водорода общее преобразование составляет около 98%.

Композиция
Пропорции азота и водорода: Смесь азота и водорода, поступающая в реактор, находится в соотношении 1 объем азота к 3 объемам водорода. Закон Авогадро гласит, что равные объемы газов при одинаковой температуре и давлении содержат равное количество молекул. Это означает, что газы поступают в реактор в соотношении 1 молекула азота к 3 молекулам водорода. Это пропорция, требуемая уравнением.
В некоторых реакциях вы можете использовать избыток одного из реагентов. Вы бы сделали это, если особенно важно израсходовать как можно больше другого реагента — например, если бы он был намного дороже. В данном случае это не применимо. Всегда есть обратная сторона использования чего-либо, кроме пропорций уравнения. Если у вас есть избыток одного реагента, через реактор будут проходить молекулы, которые не могут реагировать, потому что им не с чем реагировать.Это тратит впустую пространство реактора, особенно пространство на поверхности катализатора.
Температура
- Соображения о равновесии : Вам необходимо сместить положение равновесия (Уравнение \ (\ ref {eq1} \)) как можно дальше вправо, чтобы произвести максимально возможное количество аммиака в равновесной смеси. Прямая реакция является экзотермической с \ (ΔH = -92,4 кДж / моль \). Согласно принципу Ле-Шателье, это будет лучше, если вы снизите температуру.Система будет реагировать, перемещая положение равновесия, чтобы противодействовать этому — другими словами, производя больше тепла. Чтобы получить как можно больше аммиака в равновесной смеси, вам нужна как можно более низкая температура. Однако 400–450 ° C — это не низкая температура!
- Рекомендации по скорости : Чем ниже температура, которую вы используете, тем медленнее становится реакция. Производитель старается производить как можно больше аммиака в день. Нет смысла пытаться достичь равновесной смеси, которая содержит очень высокую долю аммиака, если реакция достигает этого равновесия в течение нескольких лет.
 Вам нужно, чтобы газы достигли равновесия за очень короткое время, в течение которого они будут контактировать с катализатором в реакторе.
Вам нужно, чтобы газы достигли равновесия за очень короткое время, в течение которого они будут контактировать с катализатором в реакторе. - Компромисс: 400–450 ° C — это компромиссная температура, обеспечивающая достаточно высокую долю аммиака в равновесной смеси (даже если она составляет всего 15%), но за очень короткое время.
Давление
Обратите внимание, что в левой части уравнения \ (\ ref {eq1} \) находятся 4 молекулы, а в правой — только 2. Согласно принципу Ле Шателье, если вы увеличите давление, система отреагирует на реакцию, в результате которой образуется меньше молекул.Это заставит давление снова упасть. Чтобы получить как можно больше аммиака в равновесной смеси, необходимо как можно более высокое давление. 200 атмосфер — это высокое давление, но не особо высокое.
- Соображения по скорости: Повышение давления сближает молекулы. В данном конкретном случае это увеличит их шансы удариться и прилипнуть к поверхности катализатора, где они могут вступить в реакцию.
 Чем выше давление, тем лучше скорость газовой реакции.
Чем выше давление, тем лучше скорость газовой реакции. - Экономические соображения: Производство очень высоких давлений очень дорого по двум причинам. Вы должны построить чрезвычайно прочные трубы и защитные сосуды, чтобы выдерживать очень высокое давление. Это увеличивает ваши капитальные затраты при строительстве завода. Производство и обслуживание высокого давления обходятся дорого. Это означает, что эксплуатационные расходы вашего завода очень высоки.
- Компромиссное давление : 200 атмосфер — это компромиссное давление, выбранное по экономическим соображениям.Если используемое давление слишком высокое, затраты на его создание превышают цену, которую вы можете получить за дополнительный производимый аммиак.
Катализатор
- Соображения о равновесии: Катализатор не оказывает никакого влияния на положение равновесия. Добавление катализатора не приводит к увеличению процентного содержания аммиака в равновесной смеси.
 Его единственная функция — ускорить реакцию.
Его единственная функция — ускорить реакцию. - Соображения скорости: В отсутствие катализатора реакция настолько медленная, что практически не происходит никакой реакции в любое разумное время.Катализатор обеспечивает достаточно быструю реакцию для установления динамического равновесия за очень короткое время, когда газы фактически находятся в реакторе.
- Отделение аммиака : Когда газы покидают реактор, они горячие и находятся под очень высоким давлением. Аммиак легко сжижается под давлением, если он не слишком горячий, поэтому температура смеси понижается настолько, чтобы аммиак превратился в жидкость. Азот и водород остаются в виде газов даже при таком высоком давлении и могут быть переработаны.
При смешивании одной части аммиака с девятью частями воздуха с использованием катализатора аммиак окисляется до азотной кислоты .
\ [4 NH_3 + 5 O_2 \ вправо 4 NO + 6 H_2O \]
\ [2 NO + O_2 \ вправо 2 NO_2 \]
\ [2 NO_2 + 2 H_2O \ вправо 2 HNO_3 + H_2 \]
Авторы и авторство
ПРОИЗВОДСТВО И МЕТОДЫ ПРОИЗВОДСТВА АММИАКА.
 . ФОРМУЛЫ АММИАКА | СТАТЬИ | СОЛЬВЕР ХИМ
. ФОРМУЛЫ АММИАКА | СТАТЬИ | СОЛЬВЕР ХИМИЗДЕЛИЯ / ПРОИЗВОДСТВО И МЕТОДЫ АММИАКА..ФОРМУЛЫ АММОНИЯ
Производство аммиака имеет решающее значение для мирового сельского хозяйства, поскольку из него производятся все удобрения, содержащие азот.Использование аммиака
Производство удобрений, безусловно, является наиболее важным применением аммиака. К ним относятся мочевина, соли аммония (фосфаты аммония, нитрат аммония, нитрат аммония кальция) и растворы аммиака.
Рисунок 1 Использование аммиака.
Увеличивающееся количество аммиака, хотя и небольшое по сравнению с другими применениями, используется в качестве концентрированного раствора для борьбы с выбросами оксидов азота из электростанций.
Годовое производство аммиака
Аммиак занимает второе место после серной кислоты как химическое вещество с наибольшим тоннажем. Его все чаще производят в странах с дешевыми источниками природного газа и угля (на Китай и Россию приходится или 40%). Крупнейшие заводы производят около 3000 тонн в день, и есть планы построить заводы, производящие 4000-5000 тонн в день, что означает, что общим мировым производством можно будет управлять с помощью 100 таких единиц. Текущее производство:
Крупнейшие заводы производят около 3000 тонн в день, и есть планы построить заводы, производящие 4000-5000 тонн в день, что означает, что общим мировым производством можно будет управлять с помощью 100 таких единиц. Текущее производство:
| Мир | 140 млн тонн |
| Европа | 16 млн тонн |
| Северная Америка | 15 млн тонн |
| США | 8 млн тонн |
| Азия | 74 млн тонн |
| Россия | 12.5 млн тонн 1 |
| Ближний Восток | 13 млн тонн |
Данные от:
1. Федеральная служба государственной статистики: Российская Федерация, 2011 г.
Федеральная служба государственной статистики: Российская Федерация, 2011 г.
Население мира увеличивается примерно на 1,4% в год, и рост объема производимого аммиака практически не отстает.
Производство аммиака
Производство аммиака из азота и водорода происходит в два основных этапа:
а) производство водорода
б) синтез аммиака (процесс Габера)
Производство водорода включает несколько различных процессов.На рисунке 2 показана их последовательность и расположение на заводе по производству аммиака (шаги 1–5). Также показан конвертер, используемый для получения аммиака из водорода (этап 6). Что происходит на каждом из этих шагов, описано ниже.
| | 1 Установки обессеривания |
а) Производство водорода
Водород производится из разнообразного сырья, в основном из природного газа, угля или нафты. Способы получения водорода из этого сырья рассматриваются отдельно.
Водород из природного газа (метан)
Это включает в себя два этапа:
i) производство синтез-газа (смесь окиси углерода и водорода (паровой риформинг))
> ii) удаление окиси углерода и получение смеси водорода и азота (реакция сдвига)
(i) Производство синтез-газа
Каким бы способом ни был получен метан, он будет содержать некоторые органические соединения серы и сероводород, оба из которых необходимо удалить.В противном случае они отравят катализатор, необходимый для производства синтез-газа. В установке обессеривания органические соединения серы часто сначала превращаются в сероводород до реакции с оксидом цинка. Сырье смешивают с водородом и пропускают через катализатор из смешанных оксидов кобальта и молибдена на инертном носителе (специально обработанный оксид алюминия) при температуре около 700 К.
Затем газы пропускают через оксид цинка при температуре ~ 700 К и удаляют сероводород:
Первичный риформинг с водяным паром преобразует метан и водяной пар в синтез-газ, смесь оксида углерода и водорода:
Высокие температуры и низкие давления способствуют образованию продуктов (принцип Ле Шателье).На практике реагенты пропускаются через никелевый катализатор, тонко разделенный на поверхности подложки из оксида кальция / оксида алюминия, содержащейся в вертикальных трубках из никелевого сплава. Трубки, до 350 параллельно включенных, нагреваются в печи выше 1000 К и под давлением 90–110–90–1–30 атм. Это пример трубчатого реактора.
Вторичный риформинг с водяным паром реагирует на кислород из воздуха с некоторым количеством присутствующего водорода, и полученная смесь пропускается через никелевый катализатор.Пар и тепло, образующиеся при сгорании, преобразовывают большую часть остаточного метана. Среди ключевых реакций:
Среди ключевых реакций:
Выходящий из этой чистой экзотермической стадии газ имеет температуру – 1200 К и охлаждается в теплообменниках. Пар, образующийся из воды, используемой для охлаждения газов, используется для работы турбин и, следовательно, компрессоров, а также для предварительного нагрева реагентов.
В некоторых последних разработках используется отходящее тепло от установки вторичного риформинга непосредственно для обеспечения теплом установки первичного риформинга.
На этой стадии газ содержит водород, азот, окись углерода и двуокись углерода и около 0,25% метана. Поскольку воздух содержит 1% аргона, он также накапливается в синтез-газе.
(ii) Реакция сдвига
В этом процессе окись углерода преобразуется в двуокись углерода, при этом образуется больше водорода.
Он проходит в два этапа. В первой реакции высокотемпературного сдвига газ смешивается с паром и пропускается над катализатором на основе оксида железа / хрома (III) при температуре ~ 700 К в реакторе с неподвижным слоем.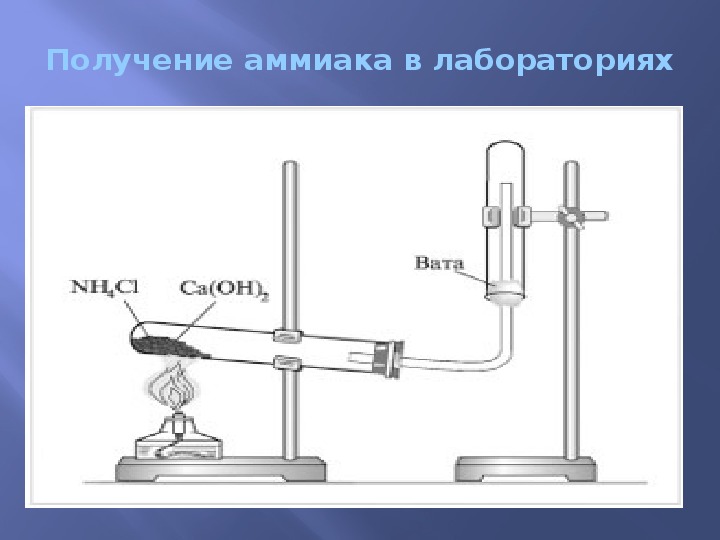 Это снижает концентрацию окиси углерода с 11%:
Это снижает концентрацию окиси углерода с 11%:
На второй стадии, реакция низкотемпературного сдвига , смесь газов проходит над медно-цинковым катализатором при примерно 500 К. Концентрация монооксида углерода дополнительно снижается до 0,2%.
Реакция проходит в два этапа по нескольким причинам. Реакция экзотермическая. Однако при высокой температуре выходная концентрация окиси углерода все еще довольно высока из-за контроля равновесия.Медный катализатор, используемый на низкотемпературной стадии, очень чувствителен к высоким температурам и не может эффективно работать на высокотемпературной стадии. Таким образом, основная часть реакции проводится при высокой температуре для рекуперации большей части тепла. Затем газ удаляют при низкой температуре, где равновесие гораздо более благоприятно, на очень активном, но нестабильном медном катализаторе.
Теперь газовая смесь содержит около 18% диоксида углерода, который удаляют путем промывки газа раствором основания с использованием одного из нескольких доступных методов. Предпочтение отдается органическому основанию (в поглотителе углекислого газа ), раствору этаноламина, часто 2,2 ‘- (метилимино) бис-этанола (N-метилдиэтаноламин).
Предпочтение отдается органическому основанию (в поглотителе углекислого газа ), раствору этаноламина, часто 2,2 ‘- (метилимино) бис-этанола (N-метилдиэтаноламин).
Двуокись углерода выделяется при нагревании раствора в стриппере диоксида углерода (). Большая часть его сжижается и продается, например, для газированных напитков, в качестве охлаждающей жидкости для атомных электростанций и для стимулирования роста растений в теплицах.
Последние следы оксидов углерода удаляются пропусканием газов через никелевый катализатор при 600 К:
Этот процесс известен как метанирование.Получается газ типичного состава: 74% водорода, 25% азота, 1% метана вместе с некоторым количеством аргона.
Водород из нафты
Если в качестве сырья используется нафта, необходима дополнительная стадия риформинга. Нафта нагревается с образованием пара, смешивается с паром и проходит по трубам, нагревается до 750 К и набивается катализатором, никелем, нанесенным на смесь оксидов алюминия и магния.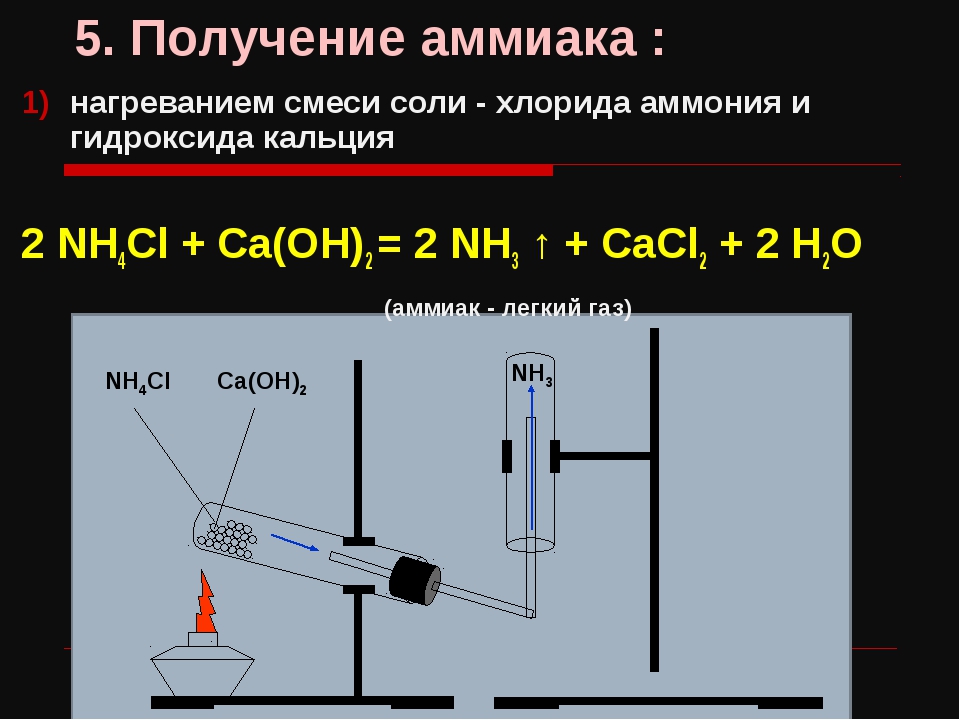 Основным продуктом является метан вместе с оксидами углерода, который затем обрабатывается паровой конверсией, как если бы это был природный газ, с последующей реакцией сдвига.
Основным продуктом является метан вместе с оксидами углерода, который затем обрабатывается паровой конверсией, как если бы это был природный газ, с последующей реакцией сдвига.
Водород угольный
Если используется уголь, его сначала мелко измельчают и нагревают в атмосфере кислорода и пара. Часть угля очень быстро сгорает в кислороде (менее 0,1 с), вызывая повышение температуры в печи, а остальная часть угля вступает в реакцию с паром:
Выбрасываемый газ содержит около 55% окиси углерода, 30% водорода, 10% двуокиси углерода и небольшое количество метана и других углеводородов. Эту смесь обрабатывают реакцией сдвига.
Основные проблемы использования угля включают в себя большое количество диоксида и триоксида серы, образующегося при сжигании угля, и значительное количество других примесей, таких как мышьяк и бром, которые очень вредны для атмосферы и все они являются серьезными ядами для окружающей среды. катализаторы в процессе. Также существует серьезная проблема с удалением золы.
(б) Производство аммиака (процесс Габера)
В основе процесса лежит реакция между водородом и азотом в реакторе с неподвижным слоем.Газы в стехиометрических пропорциях нагреваются и пропускаются под давлением над катализатором (рис. 3).
Рисунок 3 — Схема, показывающая обычный реактор синтеза (конвертер).
Доля аммиака в равновесной смеси увеличивается с увеличением давления и падением температуры (принцип Ле Шателье). Количественные данные приведены в таблице 1. Для получения приемлемого выхода и благоприятной скорости используются высокие давления, умеренные температуры и катализатор.
| Давление / атм | Процент аммиака, находящегося в состоянии равновесия в диапазоне температур | |||||
|---|---|---|---|---|---|---|
| 373 К | 473 К | 573 К | 673 К | 773 К | 973 К | |
| 10 | — | 50. 7 7 | 14,7 | 3,9 | 1,2 | 0,2 |
| 25 | 91,7 | 63,6 | 27,4 | 8,7 | 2,9 | — |
| 50 | 94,5 | 74.0 | 39,5 | 15,3 | 5,6 | 1,1 |
| 100 | 96,7 | 81,7 | 52,5 | 25,2 | 10,6 | 2,2 |
| 200 | 98.4 | 89,0 | 66,7 | 38,8 | 18,3 | — |
| 400 | 99,4 | 94,6 | 79,7 | 55,4 | 31,9 | — |
| 1000 | — | 98.3 | 92,6 | 79,8 | 57,5 | 12,9 |
Таблица 1 Объемное процентное содержание аммиака в равновесной смеси для реакции
между азотом и водородом в диапазоне температур и давлений.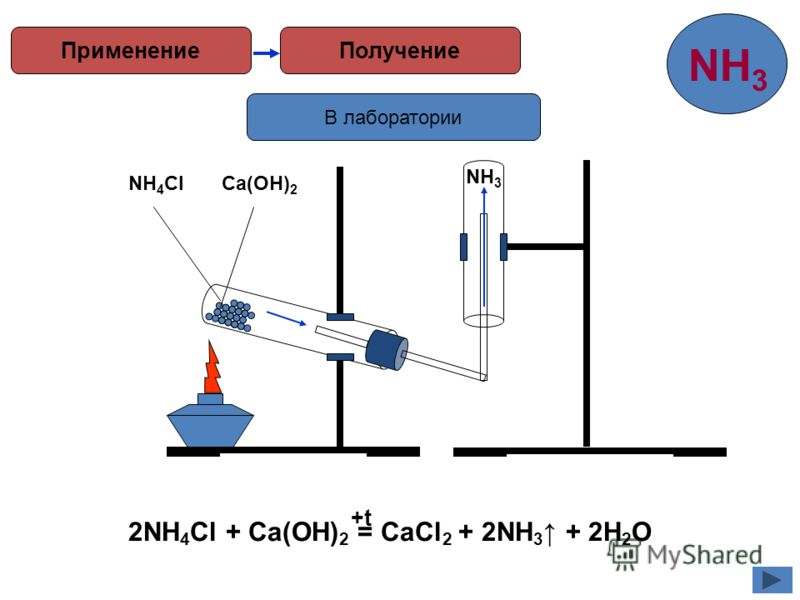
В зависимости от конструкции реактора используется широкий диапазон условий. Используемые температуры варьируются от 600 до 700 К, а давление от 50 до 100 атмосфер.
Поскольку реакция является экзотермической, добавляются холодные реагенты (азот и водород) для снижения температуры реакторов (рис. 3).
Аммиак обычно хранится на месте (шаг 7) и перекачивается в другую часть завода, где он превращается в удобрение (мочевину или соль аммония). Однако иногда его транспортируют по морю (рис. 4) или по дороге для использования на другом заводе.
СВЯЗАННЫЕ МЕТКИ: ЧТО ТАКОЕ АММИАК, ГДЕ ИСПОЛЬЗОВАТЬ АММИАК, MSDS АММИАКА, АММИАК ДЛЯ ПРОИЗВОДСТВА, АММИАК ДЛЯ ПРОИЗВОДСТВА, ВЫРАБОТКА АММИАКА ЖИДКОГО, КОНЦЕНТРИРОВАННОГО АММИАКА, ФОРМУЛЫ АММИАКА, КАК ПРОИЗВОДИТЬ АММИАК, АММИАК.АЗОТ, ВОДОРОД.
СОЛЬВЕР ХИМ
границ | Процессы устойчивого производства аммиака
Введение
По данным Организации Объединенных Наций (ООН), население мира увеличится до более чем 9 миллиардов человек в следующие 35 лет (FAO, 2009). Такой рост населения ложится бременем на природные ресурсы Земли, например истощение запасов воды. Этот рост в то же время приведет к увеличению количества отходов.По данным Агентства по охране окружающей среды США (EPA), в Соединенных Штатах 30% производимого метана (CH 4 ) происходит из навоза домашнего скота, который вносит такой же вклад в выбросы метана, как и нефтегазовая промышленность. Неконтролируемое разложение отходов на свалках, если его не обрабатывать, приводит к выбросу метана, который является выбросом парниковых газов (ПГ) и примерно в 30 раз сильнее углекислого газа (CO 2 ) для удержания тепла в течение первых 10 лет. с момента разряда.На метан приходится 20% глобального потепления, которое наблюдается в настоящее время (IPCC, 2013; MIT News, 2017). Продовольственная и сельскохозяйственная организация ООН (ФАО) также заявляет, что мировое производство продуктов питания должно будет увеличиться на 70%, чтобы соответствовать растущему спросу из-за роста населения (ООН, 2015).
Такой рост населения ложится бременем на природные ресурсы Земли, например истощение запасов воды. Этот рост в то же время приведет к увеличению количества отходов.По данным Агентства по охране окружающей среды США (EPA), в Соединенных Штатах 30% производимого метана (CH 4 ) происходит из навоза домашнего скота, который вносит такой же вклад в выбросы метана, как и нефтегазовая промышленность. Неконтролируемое разложение отходов на свалках, если его не обрабатывать, приводит к выбросу метана, который является выбросом парниковых газов (ПГ) и примерно в 30 раз сильнее углекислого газа (CO 2 ) для удержания тепла в течение первых 10 лет. с момента разряда.На метан приходится 20% глобального потепления, которое наблюдается в настоящее время (IPCC, 2013; MIT News, 2017). Продовольственная и сельскохозяйственная организация ООН (ФАО) также заявляет, что мировое производство продуктов питания должно будет увеличиться на 70%, чтобы соответствовать растущему спросу из-за роста населения (ООН, 2015). Около 40–60% мирового производства продуктов питания связано с использованием коммерческих удобрений (Roberts, 2009). Ископаемое топливо является основным сырьем для процессов производства удобрений.
Около 40–60% мирового производства продуктов питания связано с использованием коммерческих удобрений (Roberts, 2009). Ископаемое топливо является основным сырьем для процессов производства удобрений.
Согласно статистике, мировое производство аммиака (NH 3 ) в 2019 году составило 235 миллионов тонн, что делает его вторым по величине производимым химическим товаром после серной кислоты (H 2 SO 4 ) (Soloveichik, 2017a ).Аммиак играет важную роль в сельском хозяйстве при производстве удобрений. Другие промышленные применения аммиака включают его использование в качестве энергоносителя для хранения и транспортировки энергии, его также можно использовать в производстве полиимидов, азотной кислоты, нейлона, фармацевтических препаратов, взрывчатых материалов, хладагентов, красителей, чистящих растворов и других промышленных химикатов. . (CICE, 2016).
Аммиак состоит из 17,6 мас.% Водорода, что указывает на то, что аммиак является косвенным накопителем водорода (Michael et al. , 2015). Плотность энергии аммиака составляет 4,32 кВтч / литр, что аналогично метанолу (CH 3 OH) и примерно вдвое больше, чем у жидкого водорода (Соловейчик, 2017b). Филибер (2018) указывает, что сжижение водорода сложнее по сравнению с аммиаком, поскольку аммиак сжижается при -33,4 ° C и при атмосферном давлении: водород необходимо сжижать путем охлаждения до температур ниже -253 ° C. Одной из основных проблем использования водорода в качестве энергоносителя является сложность его транспортировки и хранения без рассеивания, и поэтому он недоступен для предполагаемого конечного использования.Еще одна проблема, связанная с этим рассеиванием, — это его безопасность при транспортировке и хранении. Еще одна проблема, связанная с водородом, используемым в качестве энергоносителя, — это его низкая плотность энергии и сложность обращения (Nordvang, 2017). Это связано с объемной плотностью энергии водорода в жидком безводном аммиаке (10,1 МДж / л), которая примерно в 1,5 раза выше, чем в жидком водороде, как показано в таблице 1.
, 2015). Плотность энергии аммиака составляет 4,32 кВтч / литр, что аналогично метанолу (CH 3 OH) и примерно вдвое больше, чем у жидкого водорода (Соловейчик, 2017b). Филибер (2018) указывает, что сжижение водорода сложнее по сравнению с аммиаком, поскольку аммиак сжижается при -33,4 ° C и при атмосферном давлении: водород необходимо сжижать путем охлаждения до температур ниже -253 ° C. Одной из основных проблем использования водорода в качестве энергоносителя является сложность его транспортировки и хранения без рассеивания, и поэтому он недоступен для предполагаемого конечного использования.Еще одна проблема, связанная с этим рассеиванием, — это его безопасность при транспортировке и хранении. Еще одна проблема, связанная с водородом, используемым в качестве энергоносителя, — это его низкая плотность энергии и сложность обращения (Nordvang, 2017). Это связано с объемной плотностью энергии водорода в жидком безводном аммиаке (10,1 МДж / л), которая примерно в 1,5 раза выше, чем в жидком водороде, как показано в таблице 1. С точки зрения безопасности газообразный аммиак почти не отличается от воздуха. , поэтому в случае утечки аммиак быстро улетучивается в атмосферу.Однако, в отличие от водорода, аммиак обычно не взрывоопасен. Это опасное химическое вещество, и с ним следует обращаться осторожно из-за его едкости и токсичности (Brown, 2016). Из-за вышеупомянутых факторов аммиак рассматривается как практический вектор энергии для водорода. В мире, где все больше и больше внедряется возобновляемая генерация с низким содержанием углерода, способная обеспечивать первичную электроэнергию для электролиза водорода, этот аммиак можно назвать зеленым аммиаком.
С точки зрения безопасности газообразный аммиак почти не отличается от воздуха. , поэтому в случае утечки аммиак быстро улетучивается в атмосферу.Однако, в отличие от водорода, аммиак обычно не взрывоопасен. Это опасное химическое вещество, и с ним следует обращаться осторожно из-за его едкости и токсичности (Brown, 2016). Из-за вышеупомянутых факторов аммиак рассматривается как практический вектор энергии для водорода. В мире, где все больше и больше внедряется возобновляемая генерация с низким содержанием углерода, способная обеспечивать первичную электроэнергию для электролиза водорода, этот аммиак можно назвать зеленым аммиаком.
Согласно Соловейчику (2017a), аммиак считается не только удобрением, но и энергоносителем.Кроме того, с глобальным переходом от ископаемого топлива к переменным возобновляемым источникам энергии, таким как солнце и ветер, возрастает потребность в решениях по хранению энергии, которые могут охватывать различные временные рамки для хранения энергии. Особый интерес представляет возможность экономно хранить энергию в течение длительных периодов времени без значительного снижения энергии, транспортировать накопленную энергию на большие расстояния (также без значительного снижения энергии) и иметь возможность хранить энергию в тераваттном режиме. часов (ТВт-ч) экономично масштабируется, возможно, требуется только заряжать и разряжать небольшое количество раз в течение года (Wilson and Styring, 2017).Это общие характеристики ископаемого топлива, которые помогают объяснить, почему оно так широко распространено. Кажется очевидным, что топливо (газообразное, жидкое или твердое) особенно полезно для удовлетворения этих характеристик и, следовательно, по-прежнему будет необходимо в будущих энергетических системах из-за постоянной необходимости обеспечения межсезонного хранения (Wilson and Styring, 2017) и торговли энергией по всему миру. каналы поставок. Поэтому в будущих низкоуглеродных энергетических системах их следует рассматривать как низкоуглеродные виды топлива, а аммиак — как синтетическое топливо, способное удовлетворить эти требования.
часов (ТВт-ч) экономично масштабируется, возможно, требуется только заряжать и разряжать небольшое количество раз в течение года (Wilson and Styring, 2017).Это общие характеристики ископаемого топлива, которые помогают объяснить, почему оно так широко распространено. Кажется очевидным, что топливо (газообразное, жидкое или твердое) особенно полезно для удовлетворения этих характеристик и, следовательно, по-прежнему будет необходимо в будущих энергетических системах из-за постоянной необходимости обеспечения межсезонного хранения (Wilson and Styring, 2017) и торговли энергией по всему миру. каналы поставок. Поэтому в будущих низкоуглеродных энергетических системах их следует рассматривать как низкоуглеродные виды топлива, а аммиак — как синтетическое топливо, способное удовлетворить эти требования.
Широко применяемые технологии производства аммиака
Технологии производства аммиака, которые используются в настоящее время, требуют либо стабильной подачи дистиллированной воды в больших объемах, либо приводят к высокому производству диоксида углерода.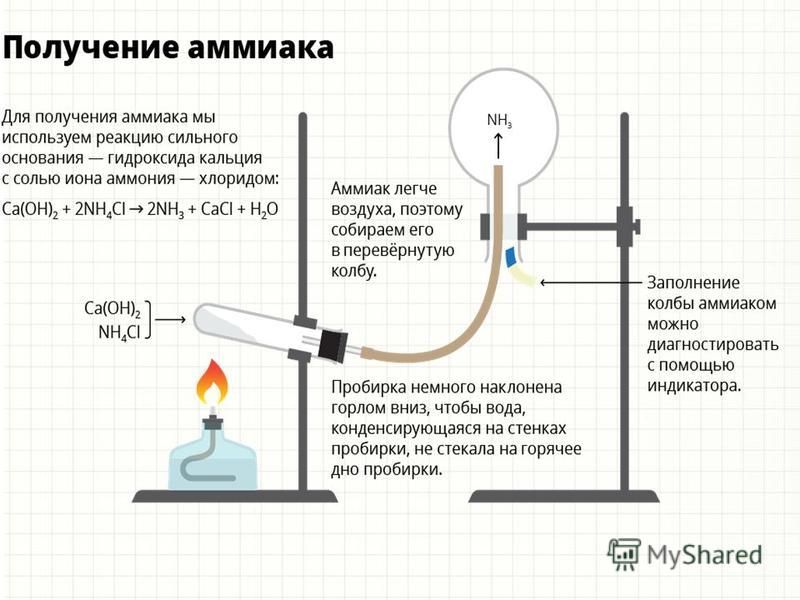 Наиболее часто используемый метод производства аммиака — это процесс Хабера-Боша, который имеет недостатки, заключающиеся в высоких выбросах парниковых газов и большом потреблении энергии, в основном из-за высокого рабочего давления и температуры. Для устойчивого производства аммиака наиболее широко применяемой технологией является электролиз воды в сочетании с такими возобновляемыми технологиями, как энергия ветра и солнца для производства водорода.Как правило, для работы водного электролизера требуется непрерывный поток предварительно обработанной воды высокой степени чистоты. Причем для производства 1 тонны водорода требуется 9 тонн воды. В 2016 году объем произведенного аммиака во всем мире составил 146 миллионов тонн (Cong et al., 2019). Исходя из этих данных, для производства того же количества аммиака путем электролиза воды требуется 233,6 миллиона тонн (233,6 миллиарда литров) воды.
Наиболее часто используемый метод производства аммиака — это процесс Хабера-Боша, который имеет недостатки, заключающиеся в высоких выбросах парниковых газов и большом потреблении энергии, в основном из-за высокого рабочего давления и температуры. Для устойчивого производства аммиака наиболее широко применяемой технологией является электролиз воды в сочетании с такими возобновляемыми технологиями, как энергия ветра и солнца для производства водорода.Как правило, для работы водного электролизера требуется непрерывный поток предварительно обработанной воды высокой степени чистоты. Причем для производства 1 тонны водорода требуется 9 тонн воды. В 2016 году объем произведенного аммиака во всем мире составил 146 миллионов тонн (Cong et al., 2019). Исходя из этих данных, для производства того же количества аммиака путем электролиза воды требуется 233,6 миллиона тонн (233,6 миллиарда литров) воды.
Аммиак производится на крупных предприятиях (от 1000 до 1500 т / сутки) по технологии Габера-Боша (Соловейчик, 2017а). Во всем мире более 90% аммиака производится из ископаемого топлива с помощью этого метода (Hughes et al., 2015; Guerra et al., 2020). Процесс Хабера-Боша обычно основан на ископаемом топливе, которое функционирует при температурах в диапазоне 400–500 ° C и давлении в диапазоне 150–300 бар, обычно в присутствии катализатора на основе железа (Fe) (Garagounis et al. др., 2014; Wang et al., 2018). Около 96% водорода (H 2 ), необходимого для производства аммиака с помощью процесса Габера-Боша, получают из ископаемого топлива (Parkinson et al., 2018). Остальные 4% вырабатываются за счет электроэнергии, которая будет включать косвенное использование ископаемого топлива из угля или природного газа для выработки электроэнергии (Michael et al., 2015). Типичный процесс парового риформинга метана (SMR) дает примерно 9–10 тонн эквивалента диоксида углерода (CO 2 экв. ) на каждую тонну произведенного водорода (Parkinson et al., 2018). Во всем мире 72% водорода, производимого для производства аммиака, получают в процессе SMR, а 26% — из угля (IEA, 2012; Kevin Breen, 2012).
Во всем мире более 90% аммиака производится из ископаемого топлива с помощью этого метода (Hughes et al., 2015; Guerra et al., 2020). Процесс Хабера-Боша обычно основан на ископаемом топливе, которое функционирует при температурах в диапазоне 400–500 ° C и давлении в диапазоне 150–300 бар, обычно в присутствии катализатора на основе железа (Fe) (Garagounis et al. др., 2014; Wang et al., 2018). Около 96% водорода (H 2 ), необходимого для производства аммиака с помощью процесса Габера-Боша, получают из ископаемого топлива (Parkinson et al., 2018). Остальные 4% вырабатываются за счет электроэнергии, которая будет включать косвенное использование ископаемого топлива из угля или природного газа для выработки электроэнергии (Michael et al., 2015). Типичный процесс парового риформинга метана (SMR) дает примерно 9–10 тонн эквивалента диоксида углерода (CO 2 экв. ) на каждую тонну произведенного водорода (Parkinson et al., 2018). Во всем мире 72% водорода, производимого для производства аммиака, получают в процессе SMR, а 26% — из угля (IEA, 2012; Kevin Breen, 2012). В 2016 году аммиак из угля составлял более 82% производства аммиака в Китае (Heffer and Prud’homme, 2016).
В 2016 году аммиак из угля составлял более 82% производства аммиака в Китае (Heffer and Prud’homme, 2016).
Недостатком процесса Haber-Bosch являются высокие выбросы парниковых газов, превышающие 2,16 тонны CO 2 на тонну NH 3 , и высокое потребление энергии, превышающее 30 ГДж / тонну NH 3 , в основном из-за высокого давления. и температура (Yoo, et al., 2013). Примерно 3–5% добываемого в мире природного газа используется для производства аммиака с помощью процесса Габера-Боша (Wang et al., 2018). Этот показатель составляет около 1-2% мирового энергоснабжения (Hughes et al., 2015; Wang et al., 2018). Как правило, при производстве удобрений требуется много энергии. Примерно 1,2% мировой энергии используется для производства удобрений, 93% из которых основаны на азоте (IFA, 2009).
Это исследование направлено на ответ на вопрос, какие технологии могут решить основные проблемы, связанные с производством водорода, необходимого для синтеза аммиака, который используется в настоящее время, например, необходимость постоянной подачи деионизированной воды в больших объемах и / или или высокое производство двуокиси углерода. Чтобы ответить на вопрос исследования, был проведен систематический обзор литературы. Результаты, полученные в соответствующей литературе, были затем классифицированы и систематизированы с помощью контент-анализа. Таким образом, в данной статье представлен всесторонний обзор литературы по технологиям производства аммиака и различным процессам производства водорода, необходимым для синтеза аммиака.
Чтобы ответить на вопрос исследования, был проведен систематический обзор литературы. Результаты, полученные в соответствующей литературе, были затем классифицированы и систематизированы с помощью контент-анализа. Таким образом, в данной статье представлен всесторонний обзор литературы по технологиям производства аммиака и различным процессам производства водорода, необходимым для синтеза аммиака.
В доступной литературе имеется пробел в исследованиях по устойчивым процессам производства водорода, таким как CH 4 с твердооксидным топливным электролизером (SOFEC), паровым электролизом с использованием природного газа (NGASE) и темной ферментацией в сочетании с другими биологическими технологиями, объединенными в исследование синтеза аммиака.Увеличение доступности отходов заставляет нас сосредоточиться на использовании темной ферментации, интегрированной с другими биологическими технологиями, которые могут использовать отходы в качестве исходного сырья, или на процессе, который может использовать биогаз в качестве входного потока, например, CH 4 Assisted-SOFEC / NGASE. Биоконверсия отходов с помощью вышеупомянутых биологических технологий в важные химические соединения, такие как аммиак, может быть новым альтернативным путем восстановления ресурсов для химических веществ на основе ископаемых. Эти технологии будут описаны и рассмотрены в документах CH 4 Электролизная ячейка с твердым оксидным топливом и вспомогательным топливом и Процессы биологического производства водорода с точки зрения эффективности, экономики и по сравнению с другими процессами.В статье Производство водорода с использованием солнечной энергии и фотоэлектрохимии рассматривается устойчивое производство водорода с использованием солнечной энергии и обсуждаются проблемы, связанные с его расширением. В A Review of Sustainable Technologies for Ammonia Production. Критический обзор новых технологий производства аммиака, состоящих из электрохимической, нетепловой плазмы, Университета Западной Вирджинии (WVU) и катализатора с пептидными функциональными группами, основанного на нитрогеназе, для электрохимического синтеза аммиака.
Биоконверсия отходов с помощью вышеупомянутых биологических технологий в важные химические соединения, такие как аммиак, может быть новым альтернативным путем восстановления ресурсов для химических веществ на основе ископаемых. Эти технологии будут описаны и рассмотрены в документах CH 4 Электролизная ячейка с твердым оксидным топливом и вспомогательным топливом и Процессы биологического производства водорода с точки зрения эффективности, экономики и по сравнению с другими процессами.В статье Производство водорода с использованием солнечной энергии и фотоэлектрохимии рассматривается устойчивое производство водорода с использованием солнечной энергии и обсуждаются проблемы, связанные с его расширением. В A Review of Sustainable Technologies for Ammonia Production. Критический обзор новых технологий производства аммиака, состоящих из электрохимической, нетепловой плазмы, Университета Западной Вирджинии (WVU) и катализатора с пептидными функциональными группами, основанного на нитрогеназе, для электрохимического синтеза аммиака. Эти технологии, которые находятся на стадии исследований и разработок, не были расширены в коммерческом масштабе, чтобы конкурировать или заменять процесс Хабера-Боша.
Эти технологии, которые находятся на стадии исследований и разработок, не были расширены в коммерческом масштабе, чтобы конкурировать или заменять процесс Хабера-Боша.
Взаимосвязь между ценами на аммиак и природный газ
Доступ к доступным и богатым источникам производства аммиака критически важен для стабильных и экономически жизнеспособных поставок в мировой сельскохозяйственный сектор. Влияние волатильности цен на природный газ существенно влияет на конечную цену производства аммиака.При производстве аммиака 70–90% затрат связаны с ценами на природный газ (Dincer and Bicer, 2018). Таким образом, рыночная цена аммиака колеблется вместе с ценами на природный газ. Цена как на природный газ, так и на аммиак увеличивалась в большинстве лет: первая с примерно 0,141 доллара за м 3 в 1975 году до 0,53 доллара за м 3 в 2015 году, а вторая — с 290 долларов за тонну NH 3. в 1975 году до примерно 850 долларов за тонну NH 3 в 2015 году и достигли максимума в 2015 году. В период с 2012 по 2016 год цена на природный газ снизилась во всем мире из-за увеличения добычи природного газа, главным образом в США (Schnitkey, 2016).
В период с 2012 по 2016 год цена на природный газ снизилась во всем мире из-за увеличения добычи природного газа, главным образом в США (Schnitkey, 2016).
Производство аммиака с использованием морского ветра
Morgan et al. (2017) также определили, что производство аммиака с использованием водорода за счет энергии морского ветра технически осуществимо при существующих технологиях, а его экономическая целесообразность основана на цене природного газа при использовании традиционных методов. Этот процесс включает: опреснение морской воды, производство газообразного водорода, отделение азота, синтез аммиака и хранение аммиака.Это исследование показывает, что заводы по производству аммиака, использующие современные технологии, работающие исключительно на электроэнергии, нуждаются в значительной помощи со стороны сети в качестве резерва для работы. Результат анализа чувствительности, проведенного Морганом (2013), показал, что окончательная стоимость аммиака в значительной степени зависит от стоимости производства ветровой электроэнергии на море.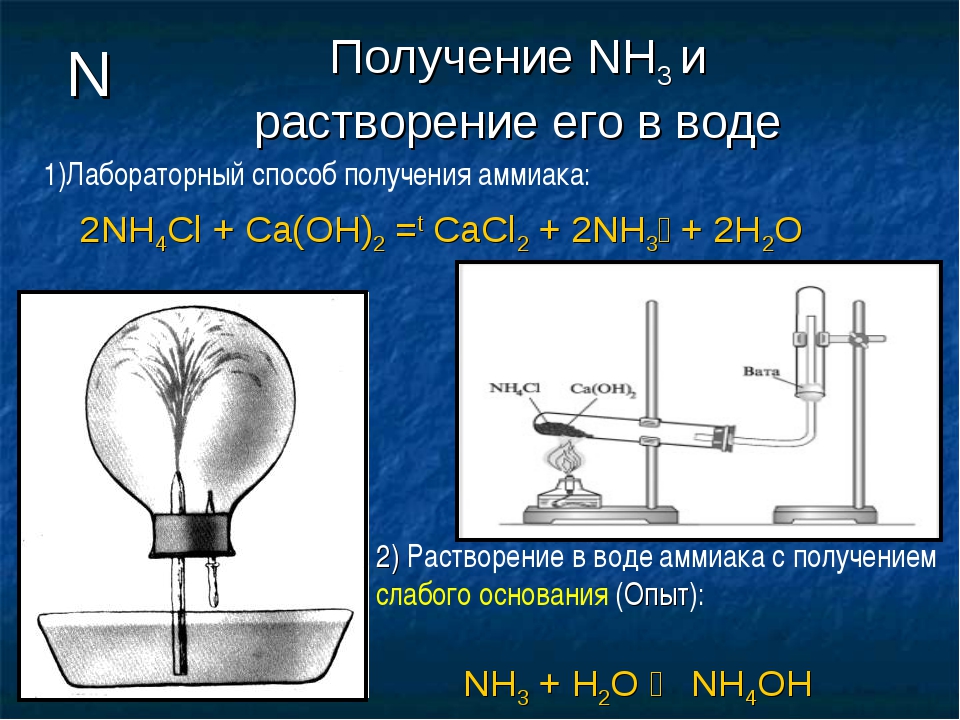
Методы
Целью данного исследования является обзор литературы по традиционным и новым методам устойчивого производства аммиака.Основываясь на тщательном обзоре литературы, ряд основных очевидных недостатков в устойчивых технологиях производства аммиака описан в Введении и подробно описан в Решение проблем, связанных с текущими возобновляемыми технологиями производства аммиака . Более устойчивые и низкоуглеродные способы производства аммиака, описанные в этом исследовании, имеют решающее значение для обеспечения продовольственной безопасности и хранения энергии таким образом, чтобы это было совместимо с усилиями по глубокой декарбонизации.В этой работе был проведен систематический обзор на основе сформулированного исследовательского вопроса: «Как устойчиво производить аммиак?» Темы исследований были разделены на три основные категории: 1) Поиск наиболее устойчивых путей производства водорода, необходимого для синтеза аммиака 2) Поиск устойчивых новых появляющихся технологий производства аммиака 3) Проблемы, связанные с устойчивым производством водорода / аммиака. Производство зеленого аммиака, рассматриваемое в этой работе, ориентировано на использование водорода, полученного из возобновляемых источников.Различные технологии производства водорода, необходимые для синтеза аммиака, оцениваются в A Review of Hydrogen Production Technologies for Ammonia Synthesis . Поскольку водород является ключевым компонентом синтеза аммиака, мы должны сосредоточиться на экологически безопасных способах производства водорода. Мы оценили две наиболее часто используемые технологии для производства аммиака, а именно SMR и электролиз воды в сочетании с Haber-Bosch, с точки зрения выбросов парниковых газов, электроэнергии и потребления воды.Другие технологии устойчивого производства водорода, рассмотренные в этом исследовании, производятся электрохимическим способом (CH 4 Assisted-SOFEC / NGASE) и биологическим способом (темная ферментация в сочетании с другими технологиями, такими как фото-ферментация и анаэробное сбраживание). Обоснование выбора этих конкретных процессов заключается в том, что в доступной литературе имеется пробел в исследованиях, позволяющих консолидировать оценку этих технологий для устойчивого производства водорода, необходимого для синтеза аммиака.
Производство зеленого аммиака, рассматриваемое в этой работе, ориентировано на использование водорода, полученного из возобновляемых источников.Различные технологии производства водорода, необходимые для синтеза аммиака, оцениваются в A Review of Hydrogen Production Technologies for Ammonia Synthesis . Поскольку водород является ключевым компонентом синтеза аммиака, мы должны сосредоточиться на экологически безопасных способах производства водорода. Мы оценили две наиболее часто используемые технологии для производства аммиака, а именно SMR и электролиз воды в сочетании с Haber-Bosch, с точки зрения выбросов парниковых газов, электроэнергии и потребления воды.Другие технологии устойчивого производства водорода, рассмотренные в этом исследовании, производятся электрохимическим способом (CH 4 Assisted-SOFEC / NGASE) и биологическим способом (темная ферментация в сочетании с другими технологиями, такими как фото-ферментация и анаэробное сбраживание). Обоснование выбора этих конкретных процессов заключается в том, что в доступной литературе имеется пробел в исследованиях, позволяющих консолидировать оценку этих технологий для устойчивого производства водорода, необходимого для синтеза аммиака. Стоимость производства водорода за счет использования CH 4 Assisted-SOFEC сравнима с SMR в дополнение к тому, что производство производится экологически безопасным способом. Сырьем для этой технологии может служить биогаз, полученный в результате биоконверсии отходов. Согласно статистическим данным, упомянутым во введении, сообщенным EPA, переизбыток потоков отходов представляет большую угрозу для контроля выбросов парниковых газов. Таким образом, биоконверсия отходов путем темной ферментации, фотоферментации и т. Д. В важные химические соединения, такие как аммиак, может быть новой альтернативой извлечения ресурсов для химических веществ на основе ископаемых.Различные новые устойчивые технологии производства аммиака представлены в A Review of Sustainable Technologies for Ammonia Production и, наконец, критический обзор различных технологий производства аммиака с использованием метода оценки жизненного цикла (LCA) описан в Влияние различных процессов производства аммиака на окружающую среду .
Стоимость производства водорода за счет использования CH 4 Assisted-SOFEC сравнима с SMR в дополнение к тому, что производство производится экологически безопасным способом. Сырьем для этой технологии может служить биогаз, полученный в результате биоконверсии отходов. Согласно статистическим данным, упомянутым во введении, сообщенным EPA, переизбыток потоков отходов представляет большую угрозу для контроля выбросов парниковых газов. Таким образом, биоконверсия отходов путем темной ферментации, фотоферментации и т. Д. В важные химические соединения, такие как аммиак, может быть новой альтернативой извлечения ресурсов для химических веществ на основе ископаемых.Различные новые устойчивые технологии производства аммиака представлены в A Review of Sustainable Technologies for Ammonia Production и, наконец, критический обзор различных технологий производства аммиака с использованием метода оценки жизненного цикла (LCA) описан в Влияние различных процессов производства аммиака на окружающую среду . Исходя из цели данной работы, были определены ключевые слова и количество найденных связанных статей: «зеленый» И «производство водорода» (23 825 статей), «производство зеленого аммиака» (83 059 статей), «энергоноситель» (15 887 статей). ), «Устойчивое производство аммиака» (37 539 статей) и «производство аммиака» И «Оценка жизненного цикла» (241 статья).Анализ статей проводился исходя из качества исследования и релевантности теме обзора. При выборе документов для оценки для этого обзора мы решили сосредоточиться исключительно на экологически чистых и / или устойчивых технологиях производства водорода, необходимого для синтеза аммиака и технологий производства аммиака. Особое внимание уделяется технической и экологической оценке и исключению экономических аспектов этих технологий, чтобы избежать тенденции ценить экономические факторы выше технических и экологических.Более того, оценка местоположения для определения пригодности площадки для производства аммиака не была включена в этот обзор.
Исходя из цели данной работы, были определены ключевые слова и количество найденных связанных статей: «зеленый» И «производство водорода» (23 825 статей), «производство зеленого аммиака» (83 059 статей), «энергоноситель» (15 887 статей). ), «Устойчивое производство аммиака» (37 539 статей) и «производство аммиака» И «Оценка жизненного цикла» (241 статья).Анализ статей проводился исходя из качества исследования и релевантности теме обзора. При выборе документов для оценки для этого обзора мы решили сосредоточиться исключительно на экологически чистых и / или устойчивых технологиях производства водорода, необходимого для синтеза аммиака и технологий производства аммиака. Особое внимание уделяется технической и экологической оценке и исключению экономических аспектов этих технологий, чтобы избежать тенденции ценить экономические факторы выше технических и экологических.Более того, оценка местоположения для определения пригодности площадки для производства аммиака не была включена в этот обзор. Хотя это исследование направлено на критический обзор устойчивых процессов производства водорода и аммиака, ископаемые технологии (например, традиционные производственные маршруты с использованием ископаемого топлива) также включены в документ для сравнения данных / результатов. Однако стратегия исследования заключалась в поиске соответствующих научных статей, опубликованных в научных журналах, с использованием одной из самых известных академических баз данных.Для целей обзора были выбраны следующие базы данных: Science Direct, Web of Science, Springer, Wiley и т. Д. Исследование проводилось с учетом периода публикации с 1992 г. по май 2020 г. После поиска в различных базах данных результаты были затем отфильтрованы. и рассматривается в три этапа: на основе заголовка, ключевых слов, аннотации и после прочтения всей статьи. Мы исключили статьи, которые не были связаны с вопросами нашего исследования или были дубликатами. Кроме того, метод снежного кома использовался для поиска дополнительных подходящих документов путем проверки ссылок на собранные документы и их оценки, как указано выше.
Хотя это исследование направлено на критический обзор устойчивых процессов производства водорода и аммиака, ископаемые технологии (например, традиционные производственные маршруты с использованием ископаемого топлива) также включены в документ для сравнения данных / результатов. Однако стратегия исследования заключалась в поиске соответствующих научных статей, опубликованных в научных журналах, с использованием одной из самых известных академических баз данных.Для целей обзора были выбраны следующие базы данных: Science Direct, Web of Science, Springer, Wiley и т. Д. Исследование проводилось с учетом периода публикации с 1992 г. по май 2020 г. После поиска в различных базах данных результаты были затем отфильтрованы. и рассматривается в три этапа: на основе заголовка, ключевых слов, аннотации и после прочтения всей статьи. Мы исключили статьи, которые не были связаны с вопросами нашего исследования или были дубликатами. Кроме того, метод снежного кома использовался для поиска дополнительных подходящих документов путем проверки ссылок на собранные документы и их оценки, как указано выше. В результате было выявлено в общей сложности 118 соответствующих публикаций, из которых 116 статей на английском языке и две на итальянском языке. Что касается типа публикации, то 43 исследования были опубликованы в виде журнальных статей, а остальные были опубликованы в виде диссертаций, материалов конференций, правительственных документов, отчетов и справочников. Данные были собраны из всех соответствующих статей, цитируемых в ссылках.
В результате было выявлено в общей сложности 118 соответствующих публикаций, из которых 116 статей на английском языке и две на итальянском языке. Что касается типа публикации, то 43 исследования были опубликованы в виде журнальных статей, а остальные были опубликованы в виде диссертаций, материалов конференций, правительственных документов, отчетов и справочников. Данные были собраны из всех соответствующих статей, цитируемых в ссылках.
Обзор технологий производства водорода для синтеза аммиака
Аммиак является результатом экзотермической реакции между водородом и азотом, показанной равновесием в уравнении.1.
12N2 (г) + 32h3↔Nh4 (г) △ H = -93 (кДж / моль) (1) Основная задача производства аммиака — найти экономически жизнеспособный, энергоэффективный и более устойчивый способ производства. водорода. Более того, весьма желателен процесс, в котором равновесие сдвигается вправо. Обзор различных способов производства водорода, необходимого для синтеза аммиака, представлен на рисунке 1.
Рисунок 1 . Различные маршруты производства водорода.
Сравнение различных процессов производства водорода (термохимических, биохимических и электрохимических) вместе с кратким описанием их сырья и источников энергии показано в таблице 2.
Различные технологии производства водорода с их энергозатратами и состоянием коммерциализация описана в таблице 2. Эти технологии производят водород напрямую, без необходимости превращения его в чистый водород.
CH
4 Ячейка для электролиза твердого оксидного топлива с добавкой твердого оксида Технология SOFEC — это тип электролиза, целью которого является производство водорода с меньшими затратами по сравнению с другими доступными технологиями электролиза.В SOFEC метан добавляется к анодной стороне электролизера, потенциал разложения (напряжение) воды снижается, что приводит к более низкому потреблению энергии и более высокому коэффициенту преобразования электроэнергии для производства водорода. КПД системы до 70% по первичной энергии. Wijers (2011) также упоминает лабораторный тест на основе SOFEC, который показал снижение потребности в электроэнергии на 85% по сравнению с лучшими доступными альтернативными методами электролиза. Pham et al., (2000) было первым исследованием, предлагавшим добавлять топливо (метан) к аноду, тем самым снижая напряжение, необходимое для процесса электролиза. Окончательная стоимость водорода через CH 4 Assisted-SOFEC является конкурентоспособной по сравнению с ценами на водород через метод SMR (Luo et al., 2014). Однако его высокие рабочие температуры и длительная нестабильность ограничивают его практическое применение. На рисунке 2 показана схема CH 4 вспомогательного SOFEC с вовлеченными химическими реакциями (рисунок 2).
КПД системы до 70% по первичной энергии. Wijers (2011) также упоминает лабораторный тест на основе SOFEC, который показал снижение потребности в электроэнергии на 85% по сравнению с лучшими доступными альтернативными методами электролиза. Pham et al., (2000) было первым исследованием, предлагавшим добавлять топливо (метан) к аноду, тем самым снижая напряжение, необходимое для процесса электролиза. Окончательная стоимость водорода через CH 4 Assisted-SOFEC является конкурентоспособной по сравнению с ценами на водород через метод SMR (Luo et al., 2014). Однако его высокие рабочие температуры и длительная нестабильность ограничивают его практическое применение. На рисунке 2 показана схема CH 4 вспомогательного SOFEC с вовлеченными химическими реакциями (рисунок 2).
РИСУНОК 2 .Схема CH 4 Assisted-SOFEC.
Паровой электролизер с добавлением природного газа
Martinez-Frias et al. (2003) создали лабораторную модель, известную как NGASE, в которой рабочее напряжение этого электролизера могло быть уменьшено на целых 1 В (с примерно 1,2 В – 0,2 В). Это снижение напряжения является результатом подачи природного газа на анодную сторону электролизера. В этой технологии природный газ заменяет воздух на анодной стороне, в то время как катодная сторона заполнена водой.Таким образом, этот подход работает аналогично топливному элементу, вырабатывая электричество с помощью электрохимической реакции (Gross, 2008). NGASE — это особый тип CH 4 Assisted-SOFEC, в котором метан добавлен на анодную сторону электролизера для производства водорода. Первоначально NGASE был основан на теории, согласно которой добавление метана к аноду снижает напряжение электролиза.
Это снижение напряжения является результатом подачи природного газа на анодную сторону электролизера. В этой технологии природный газ заменяет воздух на анодной стороне, в то время как катодная сторона заполнена водой.Таким образом, этот подход работает аналогично топливному элементу, вырабатывая электричество с помощью электрохимической реакции (Gross, 2008). NGASE — это особый тип CH 4 Assisted-SOFEC, в котором метан добавлен на анодную сторону электролизера для производства водорода. Первоначально NGASE был основан на теории, согласно которой добавление метана к аноду снижает напряжение электролиза.
Фотоэлектрохимическое производство водорода
Оба исследования, проведенные Wang et al.(2018) и Bicer (2017) сосредоточены на производственном процессе H 2 / NH 3 с использованием систем на основе солнечной энергии. Wang et al. (2018) утверждают, что если бы аммиак мог производиться непосредственно из азота и воды, питаясь солнечным светом, эффективным и рентабельным способом и с помощью технологически продвинутого процесса, этот так называемый процесс зеленого аммиака мог бы изменить мир. Байсер (2017) приходит к выводу, что использование фотоэлектрохимических и каталитических процессов производства водорода развивается, но необходимо провести технико-экономическое обоснование этих методов, чтобы изучить их жизнеспособность.В фотоэлектрохимических подходах требуется светочувствительный материал, такой как полупроводник, в котором в основном используется система электроосаждения. Существуют различные типы маршрутов осаждения, которые работают при разных температурах (некоторые из них превышают 100 ° C). Wang et al. (2018) представили различные процессы производства аммиака, такие как исследование, проведенное Али и др. (2016) с использованием солнечной энергии. Полученные результаты показывают, что выходы солнечного аммиака вместе с процессами восстановления азота с помощью света в настоящее время находятся в нмоль г cat -1 ч -1 до мкмоль г cat -1 ч -1 и их недостаточно для реализации в промышленных масштабах.
Байсер (2017) приходит к выводу, что использование фотоэлектрохимических и каталитических процессов производства водорода развивается, но необходимо провести технико-экономическое обоснование этих методов, чтобы изучить их жизнеспособность.В фотоэлектрохимических подходах требуется светочувствительный материал, такой как полупроводник, в котором в основном используется система электроосаждения. Существуют различные типы маршрутов осаждения, которые работают при разных температурах (некоторые из них превышают 100 ° C). Wang et al. (2018) представили различные процессы производства аммиака, такие как исследование, проведенное Али и др. (2016) с использованием солнечной энергии. Полученные результаты показывают, что выходы солнечного аммиака вместе с процессами восстановления азота с помощью света в настоящее время находятся в нмоль г cat -1 ч -1 до мкмоль г cat -1 ч -1 и их недостаточно для реализации в промышленных масштабах.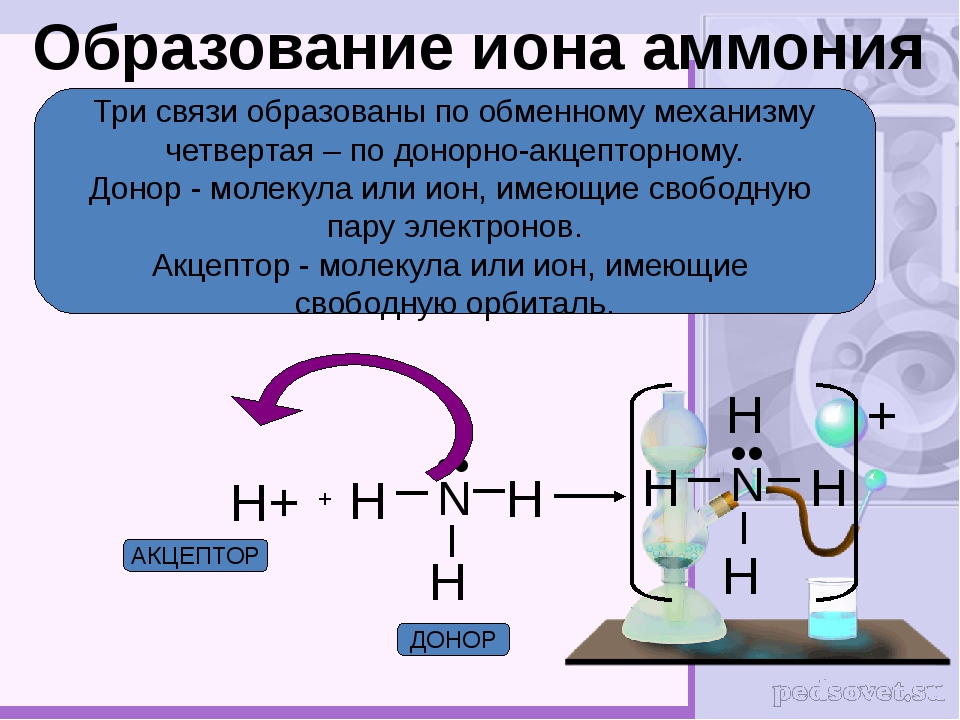
Биологические процессы производства водорода
Одна из основных проблем производства аммиака из биомассы с использованием процесса биологического производства водорода согласно Arora et al. (2016) заключается в том, что производство аммиака из биомассы возможно только в больших объемах (производство аммиака на мировом уровне). Из-за экономии на масштабе более мелкие предприятия находятся в невыгодном положении по сравнению с крупномасштабными предприятиями. Arora et al. (2016) также упомянули, что транспортировка биомассы на большие расстояния (> 100 км) экономически нецелесообразна, поскольку стоимость транспортировки будет превышать стоимость энергии биомассы.Это связано с тем, что биомасса имеет более низкую плотность энергии по сравнению с ископаемым топливом. При оценке процессов производства водорода для производства аммиака этот вопрос необходимо учитывать.
Темное брожение
Темное брожение — это ферментативное преобразование и универсальный биопроцесс для производства молекулярного биогидрогена из различного биоразлагаемого возобновляемого сырья с помощью широкого спектра различных типов бактерий (Kothari et al. , 2017; Yaswanth, 2018).Этот процесс происходит в бескислородных и анаэробных условиях (в отсутствие кислорода), в которых во время этого процесса возникает широкий спектр анаэробных ферментативных бактерий, таких как клостридий , факультативных анаэробов, таких как энтеробактер , , и аэробов, таких как палочка . участвуют в процессе ферментации (Ghimire et al., 2015). Основным механизмом этого процесса является разложение богатых углеводами субстратов с помощью таких микроорганизмов, как Clostridia Sp., Enterobacter Sp . к газам водорода и углекислого газа и другим промежуточным продуктам, таким как летучие жирные кислоты (ЛЖК) и спирты. Основными побочными продуктами процесса темного брожения являются летучие жирные кислоты, молочные кислоты, спирты и гидролизованные остатки. Эти побочные продукты могут использоваться в других биологических процессах для повышения ценности за счет рекуперации энергии или могут использоваться в качестве сырья для химического производства.
, 2017; Yaswanth, 2018).Этот процесс происходит в бескислородных и анаэробных условиях (в отсутствие кислорода), в которых во время этого процесса возникает широкий спектр анаэробных ферментативных бактерий, таких как клостридий , факультативных анаэробов, таких как энтеробактер , , и аэробов, таких как палочка . участвуют в процессе ферментации (Ghimire et al., 2015). Основным механизмом этого процесса является разложение богатых углеводами субстратов с помощью таких микроорганизмов, как Clostridia Sp., Enterobacter Sp . к газам водорода и углекислого газа и другим промежуточным продуктам, таким как летучие жирные кислоты (ЛЖК) и спирты. Основными побочными продуктами процесса темного брожения являются летучие жирные кислоты, молочные кислоты, спирты и гидролизованные остатки. Эти побочные продукты могут использоваться в других биологических процессах для повышения ценности за счет рекуперации энергии или могут использоваться в качестве сырья для химического производства. Редди (2016) утверждает, что температура является одним из факторов, влияющих на процесс ферментации, который сдвигает метаболический путь к производству водорода.Эти температурные диапазоны следующие: мезофильные (работают при температурах в диапазоне 25–40 ° C), термофильные (работают при температурах в диапазоне 40–70 ° C), экстремально термофильные (работают при температурах в диапазоне 65–80 ° C). ° C), так и гипертермофильный (работают при температуре выше 80 ° C). Анаэробные бактерии, которые более активны при мезофильных и термофильных температурах, используются для преобразования широкого спектра отходов, таких как сахароза, целлюлоза, глюкоза и крахмалы, с чистыми штаммами и генетически улучшенными культурами, как показано в реакции в уравнении.2 (Арслан и др., 2015). Увеличение выхода водорода с 4 моль H 2 / моль глюкозы до 12 моль H 2 / моль глюкозы может дать выходы производства водорода, как показано в уравнении. 4 (Сен и др., 2008). Повышение выхода водорода связано с процессом ферментации и конечными продуктами (Ghimire et al.
Редди (2016) утверждает, что температура является одним из факторов, влияющих на процесс ферментации, который сдвигает метаболический путь к производству водорода.Эти температурные диапазоны следующие: мезофильные (работают при температурах в диапазоне 25–40 ° C), термофильные (работают при температурах в диапазоне 40–70 ° C), экстремально термофильные (работают при температурах в диапазоне 65–80 ° C). ° C), так и гипертермофильный (работают при температуре выше 80 ° C). Анаэробные бактерии, которые более активны при мезофильных и термофильных температурах, используются для преобразования широкого спектра отходов, таких как сахароза, целлюлоза, глюкоза и крахмалы, с чистыми штаммами и генетически улучшенными культурами, как показано в реакции в уравнении.2 (Арслан и др., 2015). Увеличение выхода водорода с 4 моль H 2 / моль глюкозы до 12 моль H 2 / моль глюкозы может дать выходы производства водорода, как показано в уравнении. 4 (Сен и др., 2008). Повышение выхода водорода связано с процессом ферментации и конечными продуктами (Ghimire et al. , 2015). Если уксусная кислота (CH 3 COOH) является побочным продуктом реакции в уравнении 2, теоретический максимум 4 моль H 2 / моль глюкозы будет достигнут, как (Ghimire et al., 2015; Sen et al., 2008):
, 2015). Если уксусная кислота (CH 3 COOH) является побочным продуктом реакции в уравнении 2, теоретический максимум 4 моль H 2 / моль глюкозы будет достигнут, как (Ghimire et al., 2015; Sen et al., 2008):
Кроме того, когда бутират является единственным продуктом в процессе, согласно реакции в Уравнение 3 теоретический максимум 2 моль H 2 / моль глюкозы получается как:
C6h22O6 + 2h3O → 2h3 + 2Ch4Ch3Ch3COOH + 2CO2 (3)Для полного окисления глюкозы до водорода и диоксида углерода, как показано в реакции (4 ), теоретический максимум 12 моль H 2 / моль глюкозы получается как (Sen et al., 2008):
C6h22O6 + 6h3O → 12h3 + 6CO2 △ G = -3.2 (кДж / моль) (4) Реакция в уравнении. 4 предназначен для полного окисления и основан на теории и еще не применен экспериментально. Фактический выход водорода всегда будет ниже теоретического. Основная проблема темного брожения, по мнению Sen et al. (2008) — низкая концентрация водорода, которая находится в диапазоне 40–60%. Увеличение выхода водорода до более чем 4 моль H 2 / моль глюкозы делает водород экономически выгодным. Еще один способ увеличить выход водорода при темной ферментации — объединить его с другими процессами, такими как фото-ферментация, метаногенез, микробная электролизная ячейка (MEC) и микробная топливная ячейка (MFC) (Reddy, 2016; De Gioannis et al., 2013). Схема биохимических стадий разложения органических отходов для производства биогаза показана на рисунке 3. Эти стадии состоят из гидролиза, ацидогенеза и ацетогенеза.
(2008) — низкая концентрация водорода, которая находится в диапазоне 40–60%. Увеличение выхода водорода до более чем 4 моль H 2 / моль глюкозы делает водород экономически выгодным. Еще один способ увеличить выход водорода при темной ферментации — объединить его с другими процессами, такими как фото-ферментация, метаногенез, микробная электролизная ячейка (MEC) и микробная топливная ячейка (MFC) (Reddy, 2016; De Gioannis et al., 2013). Схема биохимических стадий разложения органических отходов для производства биогаза показана на рисунке 3. Эти стадии состоят из гидролиза, ацидогенеза и ацетогенеза.
РИСУНОК 3 . Биохимический процесс разложения отходов для производства биогаза (Apadted и модифицированный по, Ghimire et al., 2015).
Темное брожение в сочетании с анаэробным сбраживанием
Согласно Liu et al. (2008) двухстадийный процесс, который сочетает в себе производство биоводорода и биометана, является одним из возможных решений для повышения эффективности процесса темной ферментации. Производство водорода исключительно путем темной ферментации экономически нецелесообразно из-за низкого выхода водорода и сложных рабочих условий со многими переменными, такими как поддержание pH, температуры, скорости органической загрузки (OLR) и удельной скорости загрузки органических веществ на заданном уровне. Например, были проведены эксперименты с пищевыми отходами для двухэтапного анаэробного процесса разложения при различных рабочих условиях (pH, температура, скорость органической нагрузки и гидравлическое время удерживания (HRT)), как показано в таблице 3 (Cavinato and Pavan, 2011). ; Bolzonellaa et al., 2018). Это показывает, что наивысшая скорость удельной добычи водорода (SHP) и удельной добычи газа (SGP) была достигнута при pH 5,5 и HRT 1,3, что является самым низким значением по сравнению с двумя другими упомянутыми исследованиями. Однако скорость рециркуляции самая высокая по сравнению с другими исследованиями. Ингибирование метаногенной активности может быть достигнуто путем мониторинга рабочих параметров, таких как pH, температура (тепловая обработка посевного материала может инактивировать гидрогентрофные метаногены, усилить водород-продуцирующие бактерии и выбрать анаэробы, образующие споры.
Производство водорода исключительно путем темной ферментации экономически нецелесообразно из-за низкого выхода водорода и сложных рабочих условий со многими переменными, такими как поддержание pH, температуры, скорости органической загрузки (OLR) и удельной скорости загрузки органических веществ на заданном уровне. Например, были проведены эксперименты с пищевыми отходами для двухэтапного анаэробного процесса разложения при различных рабочих условиях (pH, температура, скорость органической нагрузки и гидравлическое время удерживания (HRT)), как показано в таблице 3 (Cavinato and Pavan, 2011). ; Bolzonellaa et al., 2018). Это показывает, что наивысшая скорость удельной добычи водорода (SHP) и удельной добычи газа (SGP) была достигнута при pH 5,5 и HRT 1,3, что является самым низким значением по сравнению с двумя другими упомянутыми исследованиями. Однако скорость рециркуляции самая высокая по сравнению с другими исследованиями. Ингибирование метаногенной активности может быть достигнуто путем мониторинга рабочих параметров, таких как pH, температура (тепловая обработка посевного материала может инактивировать гидрогентрофные метаногены, усилить водород-продуцирующие бактерии и выбрать анаэробы, образующие споры.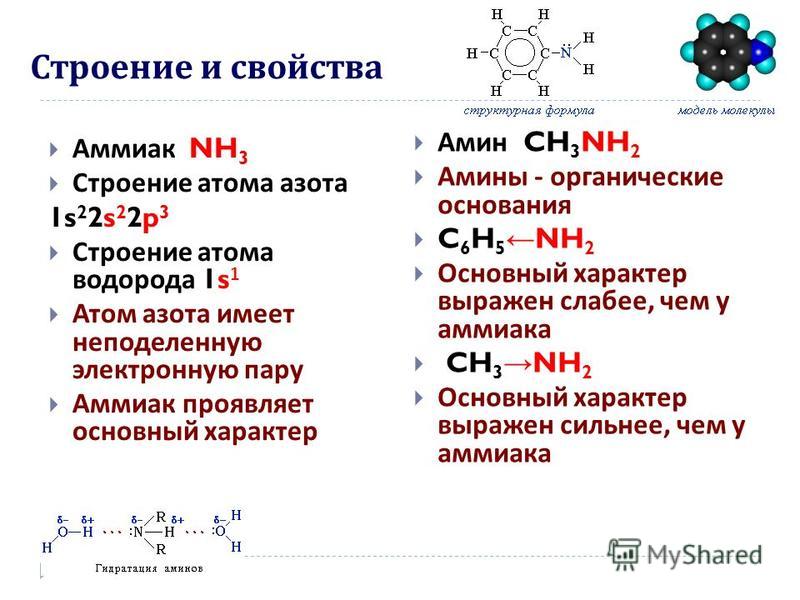 ), OLR или с использованием добавок (De Gioannis et al., 2013).
), OLR или с использованием добавок (De Gioannis et al., 2013).
ТАБЛИЦА 3 . Влияние изменения скорости рециркуляции на двухступенчатую темную ферментацию в сочетании с анаэробным сбраживанием.
Анаэробное сбраживание — это непрерывный биохимический процесс, в котором сложные субстраты разлагаются и перевариваются под действием микробов и превращаются в биогаз (Pengyu et al., 2017). Процесс анаэробного пищеварения происходит в отсутствие кислорода и проходит через четыре основных этапа: гидролиз, ацидогенез, ацетогенез и метаногенез.Производство биогаза в результате процессов анаэробного сбраживания представляет собой сложный механизм, в котором происходят несколько химических и биохимических явлений. На этих этапах крупные органические материалы, из которых состоит биомасса, расщепляются на более мелкие молекулы с помощью микроорганизмов в отсутствие кислорода. Продукты реакции одной группы микроорганизмов являются субстратами для следующего набора реакций. В результате процесса анаэробного сбраживания биомасса превращается в биогаз, состоящий из: метана, диоксида углерода, а также соединений серы, таких как сероводород (H 2 S), и некоторых незначительных следов других газов, таких как аммиак, азот, метан. , пар и др.
В результате процесса анаэробного сбраживания биомасса превращается в биогаз, состоящий из: метана, диоксида углерода, а также соединений серы, таких как сероводород (H 2 S), и некоторых незначительных следов других газов, таких как аммиак, азот, метан. , пар и др.
В двухстадийном процессе получения водорода и биометана с твердыми бытовыми отходами в качестве субстрата, работающего при температуре 37 o ° C, был достигнут выход водорода 43 мл / г VS (Liu et al., 2008). Кроме того, производство метана в двухстадийном процессе было на 21% выше, чем в обычном одностадийном процессе метаногенеза, поскольку он усиливал гидролиз бытовых отходов, что оказалось основным препятствием для анаэробного сбраживания твердых бытовых отходов. Micolucci et al.(2018) провели эксперимент по одностадийному анаэробному процессу разложения пищевых отходов в лабораторных масштабах и сообщили о выходе метана 0,45 м 3 CH 4 / кг VS, при этом достигнутая степень удаления летучих твердых веществ составила 83%. Анаэробное сбраживание также проводилось в двухфазном процессе и показало существенное снижение выхода летучих твердых веществ с 1751 кг / день до 1233 кг / день по сравнению с одностадийным процессом. Полученный баланс энергии и массы демонстрирует, что однофазные процессы были на 33% лучше с точки зрения производства биогаза и выхода энергии (Micolucci et al.2018). Однако, сравнивая баланс энергии и массы с двухступенчатым реактором, окончательные результаты показывают, что средняя концентрация метана для двухфазного процесса составляла 68% с растворимыми микробными продуктами (SMP) 351 LCH 4 / кг VS . Для одноступенчатой стадии концентрация метана составила 55% с 404 LCH 4 / кг VS. В конце концов, автор отмечает, что двухэтапный процесс анаэробного сбраживания может увеличить восстановление энергии из биомассы по сравнению с одноступенчатым процессом. Micolucci et al.(2018) также провели эксперимент, чтобы определить, как анаэробное сбраживание органического сырья с химической потребностью в кислороде (ХПК) составляет почти 1 г / л пищевых отходов или органической фракции твердых бытовых отходов (OFMSW).
Анаэробное сбраживание также проводилось в двухфазном процессе и показало существенное снижение выхода летучих твердых веществ с 1751 кг / день до 1233 кг / день по сравнению с одностадийным процессом. Полученный баланс энергии и массы демонстрирует, что однофазные процессы были на 33% лучше с точки зрения производства биогаза и выхода энергии (Micolucci et al.2018). Однако, сравнивая баланс энергии и массы с двухступенчатым реактором, окончательные результаты показывают, что средняя концентрация метана для двухфазного процесса составляла 68% с растворимыми микробными продуктами (SMP) 351 LCH 4 / кг VS . Для одноступенчатой стадии концентрация метана составила 55% с 404 LCH 4 / кг VS. В конце концов, автор отмечает, что двухэтапный процесс анаэробного сбраживания может увеличить восстановление энергии из биомассы по сравнению с одноступенчатым процессом. Micolucci et al.(2018) также провели эксперимент, чтобы определить, как анаэробное сбраживание органического сырья с химической потребностью в кислороде (ХПК) составляет почти 1 г / л пищевых отходов или органической фракции твердых бытовых отходов (OFMSW). расходуется как в одностадийных, так и в двухстадийных процессах. Сравнивая оба процесса анаэробного сбраживания, было обнаружено, что двухэтапный процесс имеет эффективность удаления, которая на 17% выше, чем у одностадийного процесса. Кроме того, благодаря применению обезвоживания дигестатом после процесса двухступенчатая система показала на 33% меньше удаляемого ила.SGP на второй стадии был выше и составлял около 0,88 м 3 биогаза / кг VS по сравнению с однофазным реактором, который составлял 0,75 м 3 биогаза / кг VS. Общая эффективность двухступенчатой системы удаления была на 16% выше по сравнению с однофазным анаэробным процессом разложения. Это указывает на устойчивость и высокий выход биогаза при использовании двухэтапного, а не однофазного процесса конфигурации, который существенно повлияет на процесс метаногенеза. Ферментация играет роль предварительной обработки пищевых отходов, поскольку она увеличивает эффективность преобразования летучей фракции в производство биогаза (Micolucci et al.
расходуется как в одностадийных, так и в двухстадийных процессах. Сравнивая оба процесса анаэробного сбраживания, было обнаружено, что двухэтапный процесс имеет эффективность удаления, которая на 17% выше, чем у одностадийного процесса. Кроме того, благодаря применению обезвоживания дигестатом после процесса двухступенчатая система показала на 33% меньше удаляемого ила.SGP на второй стадии был выше и составлял около 0,88 м 3 биогаза / кг VS по сравнению с однофазным реактором, который составлял 0,75 м 3 биогаза / кг VS. Общая эффективность двухступенчатой системы удаления была на 16% выше по сравнению с однофазным анаэробным процессом разложения. Это указывает на устойчивость и высокий выход биогаза при использовании двухэтапного, а не однофазного процесса конфигурации, который существенно повлияет на процесс метаногенеза. Ферментация играет роль предварительной обработки пищевых отходов, поскольку она увеличивает эффективность преобразования летучей фракции в производство биогаза (Micolucci et al. 2018).
2018).
Сравнение различных процессов биологического производства водорода
Основными препятствиями на пути реализации крупномасштабной темной ферментации для производства водорода являются: 1) низкий выход водорода и 2) высокие производственные затраты из-за высокой стоимости исходного сырья. Эту проблему можно решить, выбрав дешевое сырье, такое как биомасса, включая сельскохозяйственные остатки и органические отходы, образующиеся в результате промышленных и муниципальных работ (Tapia-Venegas et al., 2015). Согласно Kapdan and Kargi (2006), Chong et al.(2009), а также Zilouie and Taherdanak (2015), это даст темной ферментации конкурентное экономическое преимущество по сравнению с другими методами, используемыми в настоящее время для производства водорода, такими как электролиз воды и газификация биомассы. Сравнение различных типов методов производства биоводорода показано в Таблице 4.
ТАБЛИЦА 4 . Сравнение различных типов биологических методов получения водорода.
Темная ферментация превосходит другие процессы биологического производства водорода, упомянутые в этом исследовании, поскольку для ее работы не требуется свет.В результате его можно применять даже в местах, где отсутствует доступ к интенсивному источнику света и отсутствуют высокие затраты, связанные с галогенными лампами. Скорость производства водорода увеличивается, когда интенсивность света увеличивается и достигает точки насыщения, в зависимости от сырья и микроорганизмов. Недостаток инфракрасного света с длинами волн 750–950 нм снизит производство водорода на 39%. Согласно Argun и Kargi (2010), как источник, так и интенсивность света влияют на выход и скорость образования газообразного водорода при фотоферментации.Лю и др. (2009) провели исследование для оценки влияния интенсивности света и цикла свет / темнота на производство биогидрогена с помощью комбинации clostridium butyricum и R. faecalis RLD-53. На протяжении всего процесса комбинирования максимальный выход составлял 5,374 моль-H 2 / моль-глюкоза.
Аргун и Карги (2010) также провели исследование того же цикла (темная ферментация / фотоферментация) для производства биогидрогена R. sphaeroides -RV. Галогенные лампы оказались наиболее подходящими источниками света с интенсивностью света 5 клюкс.Производство водорода было минимальным, когда доступность света была ниже 5 клюкс, в то время как при интенсивности света выше 5 клюкс производство не происходило. Таким образом, оптимальное производство водорода достигается при уровне 5 клюкс. Было заявлено, что общий выход водорода для цикла темнота / свет составляет 4,55 моль H 2 / моль глюкозы. И темновая ферментация, и фотоферментация могут использовать широкий спектр органических субстратов в качестве исходного сырья для работы. Другие методы био-водорода, такие как прямой и непрямой био-фотолиз, требуют воды для производства водорода и кислорода.Скорость производства водорода для темной ферментации выше по сравнению с технологиями, указанными в таблице 4. Продукты, полученные в результате темной ферментации в соответствии с химическими реакциями в уравнениях. 2, 3 — водород, диоксид углерода и летучие жирные кислоты, которые можно использовать в качестве субстрата для анаэробного сбраживания с целью производства биометана. Смесь водорода, полученного в результате темного брожения, вместе с метаном, образующимся в процессе анаэробного сбраживания, может производить биогитан, смесь водорода и метана (Bolzonella et al., 2018). Согласно таблице 4, цитируемой Tenca (2011), Valdez-Vazquez и Poggi-Varaldo (2009), Hawkes et al. (2007) и Akroum-Amrouche et al. (2013), можно сделать вывод, что среди методов производства биогидрогена темная ферментация является наиболее эффективной биологической технологией в сочетании с упомянутыми методами производства водорода, необходимого для синтеза аммиака.
Продукты, полученные в результате темной ферментации в соответствии с химическими реакциями в уравнениях. 2, 3 — водород, диоксид углерода и летучие жирные кислоты, которые можно использовать в качестве субстрата для анаэробного сбраживания с целью производства биометана. Смесь водорода, полученного в результате темного брожения, вместе с метаном, образующимся в процессе анаэробного сбраживания, может производить биогитан, смесь водорода и метана (Bolzonella et al., 2018). Согласно таблице 4, цитируемой Tenca (2011), Valdez-Vazquez и Poggi-Varaldo (2009), Hawkes et al. (2007) и Akroum-Amrouche et al. (2013), можно сделать вывод, что среди методов производства биогидрогена темная ферментация является наиболее эффективной биологической технологией в сочетании с упомянутыми методами производства водорода, необходимого для синтеза аммиака.
Обзор устойчивых технологий производства аммиака
В связи с важной ролью аммиака в качестве удобрения в сельскохозяйственной отрасли и его многообещающими перспективами в качестве энергоносителя, во многих исследованиях в последнее время были предприняты попытки найти наиболее экологически безвредный, энергоэффективный, и экономически выгодный производственный процесс для синтеза аммиака. Существует ряд устойчивых технологий производства аммиака, таких как электрохимическое производство аммиака, синтез нетепловой плазмы (NTP) для производства аммиака и катализатор, функционализированный нитрогеназой и пептидами, для электрохимического производства аммиака. Эти технологии будут оцениваться в документах «Электрохимическое производство аммиака», «Нетепловой плазменный синтез (NTP) для производства аммиака» и «Катализатор с функционализированными пептидами нитрогеназами» для электрохимического производства аммиака соответственно.
Существует ряд устойчивых технологий производства аммиака, таких как электрохимическое производство аммиака, синтез нетепловой плазмы (NTP) для производства аммиака и катализатор, функционализированный нитрогеназой и пептидами, для электрохимического производства аммиака. Эти технологии будут оцениваться в документах «Электрохимическое производство аммиака», «Нетепловой плазменный синтез (NTP) для производства аммиака» и «Катализатор с функционализированными пептидами нитрогеназами» для электрохимического производства аммиака соответственно.
Электрохимическое производство аммиака
Электрохимические технологии производства аммиака делятся на три категории в зависимости от диапазона рабочих температур электрохимической ячейки: низкие температуры, ниже 100 ° C, промежуточные температуры в диапазоне 100–400 ° C и высокие температуры в диапазоне 400–750 ° C (Amar et al., 2011). Согласно Soloveichk (2017), преимущества электрохимической технологии по сравнению с термохимической (Haber-Bosch) заключаются в четырех основных областях:
(1) Более высокий КПД, что позволяет экономить энергию.
(2) Более высокая селективность, означающая, что требуется меньшая очистка.
(3) Более низкие температуры и давления, что приводит к сокращению капитальных затрат (CAPEX) за счет снижения баланса завода.
(4) Модульность, которая делает эти установки пригодными для использования в малых и средних масштабах.
Электрохимический синтез аммиака при низких температурах (
<100 ° C) Для температур ниже 100 ° C, ячейка с раствором гидроксида калия (КОН) в качестве электролита и нафион в качестве разделительной мембраны, платина (Pt) анод и катод из рутения (Ru) / C используются для синтеза аммиака (Kordali et al., 2000). Максимальная производительность для этого заявлена как ок. 2 × 10 -11 моль с −1 см −2 , работающий при температуре 90 ° C, в результате пара и азота с фарадеевской эффективностью (FE) 0,2–1%, что составляет определяется как доля протонов, которые превращаются в аммиак при миграции в электролите. Электролиты, которые используются для низкотемпературного электрохимического синтеза аммиака вместо полимерной электролитической мембраны, представляют собой мембраны из сульфированного полисульфона (SPSF), мембраны Nafion или NH 4 + вместо мембран Nafion (Lan et al., 2013). Xu et al. (2009) исследовали максимальную скорость производства аммиака 1,13 × 10 -8 моль с −1 см −2 , работающую при низкой температуре 80 ° C с приложенным напряжением 2 В с помощью мембраны Nafion. (в качестве электролита), SDC, легированный никелем (Ni-SDC), NiO — Ce 0 . 8 См 0 . 2 O 2- δ анод и SmFe 0 . 7 Cu 0 . 3-x Ni x O 3 (x = 0–0.3) (SFCN) катод. В качестве реагентов в процессе, работающем при атмосферном давлении, использовали водород и азот. Достигнут высокий фарадеевский КПД, превышающий 90% (90,4%).
Электролиты, которые используются для низкотемпературного электрохимического синтеза аммиака вместо полимерной электролитической мембраны, представляют собой мембраны из сульфированного полисульфона (SPSF), мембраны Nafion или NH 4 + вместо мембран Nafion (Lan et al., 2013). Xu et al. (2009) исследовали максимальную скорость производства аммиака 1,13 × 10 -8 моль с −1 см −2 , работающую при низкой температуре 80 ° C с приложенным напряжением 2 В с помощью мембраны Nafion. (в качестве электролита), SDC, легированный никелем (Ni-SDC), NiO — Ce 0 . 8 См 0 . 2 O 2- δ анод и SmFe 0 . 7 Cu 0 . 3-x Ni x O 3 (x = 0–0.3) (SFCN) катод. В качестве реагентов в процессе, работающем при атмосферном давлении, использовали водород и азот. Достигнут высокий фарадеевский КПД, превышающий 90% (90,4%).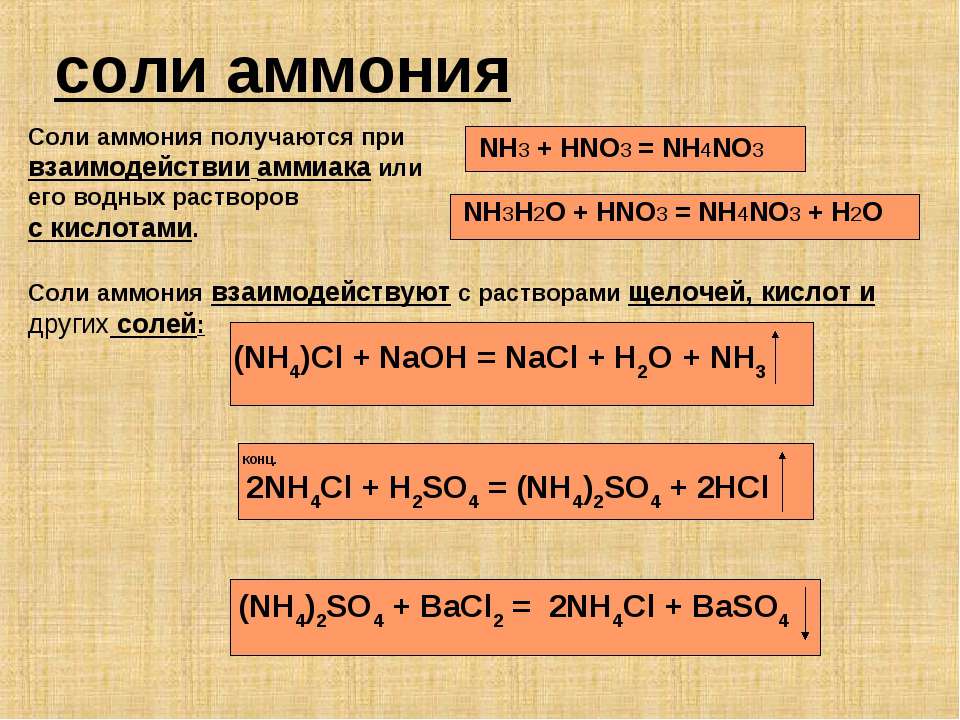 Этот показатель выше, чем сообщалось в других исследованиях при испытании низкотемпературных процессов синтеза аммиака. Как утверждают Lan et al. (2013), аммиак является слабым основанием, которое может реагировать с кислыми мембранами, такими как нафион, что приводит к снижению протонной проводимости. В результате было заявлено, что использование мембраны Nafion преобразуется из формы H + в форму NH 4 + в результате воздействия на ячейку потока, состоящего из раствора аммиака, с фарадеевской эффективностью ниже 1%.Lan et al. (2013) провели эксперимент по производству аммиака из воздуха и воды при температуре окружающей среды. Низкая фарадеевская эффективность этого эксперимента обусловлена типом используемого катализатора (Pt), который не является наиболее подходящим выбором для восстановления азота. Лапина и др. (2013) заявляет, что воздух можно использовать вместо чистого азота, хотя некоторые авторы утверждают, что кислород отравляет катализатор, используемый в процессе синтеза аммиака (Marrony, 2015).
Этот показатель выше, чем сообщалось в других исследованиях при испытании низкотемпературных процессов синтеза аммиака. Как утверждают Lan et al. (2013), аммиак является слабым основанием, которое может реагировать с кислыми мембранами, такими как нафион, что приводит к снижению протонной проводимости. В результате было заявлено, что использование мембраны Nafion преобразуется из формы H + в форму NH 4 + в результате воздействия на ячейку потока, состоящего из раствора аммиака, с фарадеевской эффективностью ниже 1%.Lan et al. (2013) провели эксперимент по производству аммиака из воздуха и воды при температуре окружающей среды. Низкая фарадеевская эффективность этого эксперимента обусловлена типом используемого катализатора (Pt), который не является наиболее подходящим выбором для восстановления азота. Лапина и др. (2013) заявляет, что воздух можно использовать вместо чистого азота, хотя некоторые авторы утверждают, что кислород отравляет катализатор, используемый в процессе синтеза аммиака (Marrony, 2015). Лапина и др. (2013) указывает, что влияние использования чистого азота или воздуха (в качестве источника азота) на фарадеевскую эффективность не сообщалось ни в одном исследовании.Лапина и др. (2013) также утверждают, что при низких температурах производство аммиака из азота и водорода происходит самопроизвольно, и, как следствие, минимальное необходимое напряжение является отрицательным, что означает, что нет необходимости подавать напряжение. Хотя на самом деле требуется приложение напряжения для преодоления перенапряжения электрода и омических потерь в электролите, в то время как через элемент проходит ограниченный ток. Если вместо водорода используется вода, для запуска реакции необходимо приложенное напряжение (Лапина и др., 2013).
Лапина и др. (2013) указывает, что влияние использования чистого азота или воздуха (в качестве источника азота) на фарадеевскую эффективность не сообщалось ни в одном исследовании.Лапина и др. (2013) также утверждают, что при низких температурах производство аммиака из азота и водорода происходит самопроизвольно, и, как следствие, минимальное необходимое напряжение является отрицательным, что означает, что нет необходимости подавать напряжение. Хотя на самом деле требуется приложение напряжения для преодоления перенапряжения электрода и омических потерь в электролите, в то время как через элемент проходит ограниченный ток. Если вместо водорода используется вода, для запуска реакции необходимо приложенное напряжение (Лапина и др., 2013).
Электрохимический синтез аммиака при высоких температурах (> 400 ° C)
Для высоких температур в диапазоне 400–750 ° C твердотельный протонный проводник или проводник оксидных ионов используется в качестве электролита для электрохимического синтеза аммиака. . Было проведено несколько исследований по использованию как протонных ионных проводников, так и оксидных ионных проводников, таких как Marnellos et al. (2000) и Skodra и Stoukides (2009). Skodra и Stoukides производили аммиак с помощью пара и азота при температурах в диапазоне 450–700 ° C, используя рутений в качестве катализатора, нанесенного на серебро (Ag) или палладий (Pd) в качестве катода.В их исследовании SrCe 0 . 95 Ур 0 . 05 O 3 − δ в качестве протонного проводника или ZrY 0 . 92 Y 0 . В качестве электролитов использовались 08 O 2-δ в качестве оксидно-ионного проводника. Для обоих производительность составляет соответственно: 10 –12 и 10 –11 моль с –1 см –2 с фарадеевской эффективностью 0,01%. Фарадеевская эффективность, заявленная Marnellos и Stoukides (1998) и Marnellos et al.(2000) составила 90%, что было достигнуто за счет использования водорода и азота в ячейке с SrCe 0 .
. Было проведено несколько исследований по использованию как протонных ионных проводников, так и оксидных ионных проводников, таких как Marnellos et al. (2000) и Skodra и Stoukides (2009). Skodra и Stoukides производили аммиак с помощью пара и азота при температурах в диапазоне 450–700 ° C, используя рутений в качестве катализатора, нанесенного на серебро (Ag) или палладий (Pd) в качестве катода.В их исследовании SrCe 0 . 95 Ур 0 . 05 O 3 − δ в качестве протонного проводника или ZrY 0 . 92 Y 0 . В качестве электролитов использовались 08 O 2-δ в качестве оксидно-ионного проводника. Для обоих производительность составляет соответственно: 10 –12 и 10 –11 моль с –1 см –2 с фарадеевской эффективностью 0,01%. Фарадеевская эффективность, заявленная Marnellos и Stoukides (1998) и Marnellos et al.(2000) составила 90%, что было достигнуто за счет использования водорода и азота в ячейке с SrCe 0 . 95 Ур 0 . 05 O 3-δ электролит и палладиевые электроды (Лапина и др., 2013). Во всех упомянутых исследованиях ионные токи, то есть скорости миграции ионов в электролите, были в одном масштабе. Скорость производства аммиака была примерно на три порядка ниже в эксперименте, проведенном Skodra и Stoukides (2009).Одним из основных недостатков высокотемпературного синтеза аммиака является то, что он может термически разлагаться после производства. Лю и др. (2006) сообщили о скоростях производства аммиака в диапазоне 7,2–8,2 × 10 –9 моль с –1 см –2 при работе в диапазоне температур 400–800 ° C с помощью Ce 0 . 8 М 0 . 2 O 2-δ (M = La, Y, Gd, Sm) в качестве электролита и Ag-Pd в качестве электродов. Эти авторы утверждали, что был достигнут 100% фарадеевский КПД.Есть и другие исследования, такие как Wang et al. (2011) с использованием того же типа электрода (Ag-Pd), легированного барием, работающего в диапазоне температур 400–600 ° C со скоростью производства аммиака, как сообщается, в диапазоне 1–5 × 10 –9 моль с −1 см −2 и с фарадеевской эффективностью 40–50%.
95 Ур 0 . 05 O 3-δ электролит и палладиевые электроды (Лапина и др., 2013). Во всех упомянутых исследованиях ионные токи, то есть скорости миграции ионов в электролите, были в одном масштабе. Скорость производства аммиака была примерно на три порядка ниже в эксперименте, проведенном Skodra и Stoukides (2009).Одним из основных недостатков высокотемпературного синтеза аммиака является то, что он может термически разлагаться после производства. Лю и др. (2006) сообщили о скоростях производства аммиака в диапазоне 7,2–8,2 × 10 –9 моль с –1 см –2 при работе в диапазоне температур 400–800 ° C с помощью Ce 0 . 8 М 0 . 2 O 2-δ (M = La, Y, Gd, Sm) в качестве электролита и Ag-Pd в качестве электродов. Эти авторы утверждали, что был достигнут 100% фарадеевский КПД.Есть и другие исследования, такие как Wang et al. (2011) с использованием того же типа электрода (Ag-Pd), легированного барием, работающего в диапазоне температур 400–600 ° C со скоростью производства аммиака, как сообщается, в диапазоне 1–5 × 10 –9 моль с −1 см −2 и с фарадеевской эффективностью 40–50%. Amar et al. (2011) также использовали карбонатно-оксидные композитные электролиты, работающие в диапазоне температур 400–450 ° C, при этом максимальная производительность аммиака, как сообщается, составляет 5.39 × 10 −9 моль с −1 см −2 , работа при температуре 450 o C с La 0 . 6 Sr 0 . 4 Fe 0 . 8 Cu 0 . 2 O 3 − δ — Ce 0 . 8 См 0 . 2 O 2 − δ композитный катод, NiO-Ce 0 . 8 Sm 0,2 O 2 − δ анод и композит Ce 0,8 Sm 0.2 O 2 − δ Li 2 CO 3 — Na 2 CO 3 -K 2 CO 3 в качестве электролита.
Amar et al. (2011) также использовали карбонатно-оксидные композитные электролиты, работающие в диапазоне температур 400–450 ° C, при этом максимальная производительность аммиака, как сообщается, составляет 5.39 × 10 −9 моль с −1 см −2 , работа при температуре 450 o C с La 0 . 6 Sr 0 . 4 Fe 0 . 8 Cu 0 . 2 O 3 − δ — Ce 0 . 8 См 0 . 2 O 2 − δ композитный катод, NiO-Ce 0 . 8 Sm 0,2 O 2 − δ анод и композит Ce 0,8 Sm 0.2 O 2 − δ Li 2 CO 3 — Na 2 CO 3 -K 2 CO 3 в качестве электролита.
Различные типы полиэлектролитов, используемых для электрохимического синтеза аммиака
Существует четыре основных классификации электролитов, используемых для электрохимического синтеза аммиака, а именно: 1) жидкий электролит, работающий при температуре, близкой к комнатной; 2) расплавы солей, работающие при промежуточных температурах 180–500 o C; 3) композитные мембраны, состоящие из обычного твердого электролита, смешанного с легкоплавкой солью, работающие в диапазоне температур 300-700 o C; 4) твердотельные электролиты с широким диапазоном рабочих температур от приблизительно температуры окружающей среды до 700-800 ° ° C, что зависит от типа используемой электролитической мембраны (Hughes et al. , 2015; Байсер и Дайсер, 2018). Эти маршруты производства электролитического аммиака представлены на Рисунке 4 с кратким описанием.
, 2015; Байсер и Дайсер, 2018). Эти маршруты производства электролитического аммиака представлены на Рисунке 4 с кратким описанием.
РИСУНОК 4 . Различные способы электролиза для производства аммиака.
Каталитический процесс синтеза аммиака связан с несколькими проблемами, такими как низкая конверсия, сильное загрязнение окружающей среды и высокое потребление энергии. Эти проблемы решаются путем использования технологий электролитического синтеза аммиака (Amar et al., 2011).Существует ряд проблем, связанных с электролитическим синтезом аммиака, таких как низкая производительность (обычно в диапазоне 10 –13 –10 –8 моль с –1 см –2 ), за исключением мембран из полимерных электролитов. которые имеют скорость производства 10 –8 моль с –1 см –2 и проблемы нестабильности кислой электролитической мембраны.
Текущие исследования показывают, что электролитическое восстановление азота с использованием гетерогенных катализаторов оказалось экологически безопасным и экологически безопасным способом производства аммиака. В этом процессе аммиак синтезируется из воды и азота с использованием возобновляемых источников энергии, таких как солнце / ветер, в условиях окружающей среды. Наиболее важными элементами для производства аммиака с помощью системы электрохимической реакции восстановления азота (NRR), работающей от возобновляемых источников энергии, являются электрокатализаторы. Электрокатализаторы должны быть разработаны для оптимизации массопереноса, физической адсорбции, хемосорбции и переноса электронов и протонов для достижения высокой селективности и каталитических характеристик.Хотя производство аммиака с помощью NRR является многообещающей устойчивой технологией, многие электрокатализаторы для этой системы имеют низкую фарадеевскую эффективность и выход аммиака по сравнению с традиционным процессом Габера-Боша (Guo et al., 2019).
В этом процессе аммиак синтезируется из воды и азота с использованием возобновляемых источников энергии, таких как солнце / ветер, в условиях окружающей среды. Наиболее важными элементами для производства аммиака с помощью системы электрохимической реакции восстановления азота (NRR), работающей от возобновляемых источников энергии, являются электрокатализаторы. Электрокатализаторы должны быть разработаны для оптимизации массопереноса, физической адсорбции, хемосорбции и переноса электронов и протонов для достижения высокой селективности и каталитических характеристик.Хотя производство аммиака с помощью NRR является многообещающей устойчивой технологией, многие электрокатализаторы для этой системы имеют низкую фарадеевскую эффективность и выход аммиака по сравнению с традиционным процессом Габера-Боша (Guo et al., 2019).
Нетепловой плазменный синтез для производства аммиака
Неустойчивость цен на ископаемое топливо, которое является основным сырьем для процесса Габера-Боша, потребность в больших объемах ископаемого топлива для обеспечения процесса и связанные с этим высокие эксплуатационные расходы с высоким рабочим давлением (150–300 бар) и температурой (400–500 o C) делают эту технологию энергоемкой (Peng et al. , 2018). Согласно Peng et al. (2018), все указанные факторы делают текущий процесс производства аммиака непригодным для реализации в небольших и децентрализованных масштабах. Они провели исследования плазменного синтеза аммиака с использованием NTP, который работает при низких температурах (примерно 50 ° C) и давлении примерно 1 атм. Эта технология способна решить некоторые проблемы, связанные с процессом Габера-Боша, такие как высокие капитальные затраты, использование ископаемого топлива и т. Д.Две наиболее важные проблемы этой технологии, как заявили Peng et al. (2018): 1) фиксация газообразного азота и 2) обратные реакции. Кроме того, заявлено, что необходимо улучшить показатели конверсии и эффективности, поскольку эта технология все еще находится на стадии исследований и разработок (доступна в небольших масштабах). Однако преимущества этой системы согласно Peng et al. (2018) заключаются в том, что процесс NMP не требует использования ископаемого топлива, имеет низкие капитальные затраты и занимает мало места.
, 2018). Согласно Peng et al. (2018), все указанные факторы делают текущий процесс производства аммиака непригодным для реализации в небольших и децентрализованных масштабах. Они провели исследования плазменного синтеза аммиака с использованием NTP, который работает при низких температурах (примерно 50 ° C) и давлении примерно 1 атм. Эта технология способна решить некоторые проблемы, связанные с процессом Габера-Боша, такие как высокие капитальные затраты, использование ископаемого топлива и т. Д.Две наиболее важные проблемы этой технологии, как заявили Peng et al. (2018): 1) фиксация газообразного азота и 2) обратные реакции. Кроме того, заявлено, что необходимо улучшить показатели конверсии и эффективности, поскольку эта технология все еще находится на стадии исследований и разработок (доступна в небольших масштабах). Однако преимущества этой системы согласно Peng et al. (2018) заключаются в том, что процесс NMP не требует использования ископаемого топлива, имеет низкие капитальные затраты и занимает мало места. Этот процесс более совместим с распределенным производством аммиака на местных фермах, и с помощью этого метода аммиак можно производить постоянно при атмосферном давлении. Исследовательская корпорация Университета Западной Вирджинии (WVURC) также разрабатывает технологию, известную как WVU. Эта технология превращает возобновляемую электроэнергию, воду и воздух в аммиак посредством возбуждения плазмы (WVU, 2016). В этом процессе цель состоит в том, чтобы снизить рабочие давления и температуры, которые приведут к производству аммиака, в пять раз превышающему степень конверсии процесса Габера-Боша.Согласно WVU (2016), этот метод отличается как от процессов электрохимической конверсии, таких как твердотельный синтез аммиака (SSAS), так и от каталитических процессов, таких как процесс Габера-Боша. В этой форме физической активации микроволновый плазменный процесс может активировать как азот, так и водород, а также производить ионы и свободные радикалы, которые реагируют на поверхности катализатора с образованием аммиака.
Этот процесс более совместим с распределенным производством аммиака на местных фермах, и с помощью этого метода аммиак можно производить постоянно при атмосферном давлении. Исследовательская корпорация Университета Западной Вирджинии (WVURC) также разрабатывает технологию, известную как WVU. Эта технология превращает возобновляемую электроэнергию, воду и воздух в аммиак посредством возбуждения плазмы (WVU, 2016). В этом процессе цель состоит в том, чтобы снизить рабочие давления и температуры, которые приведут к производству аммиака, в пять раз превышающему степень конверсии процесса Габера-Боша.Согласно WVU (2016), этот метод отличается как от процессов электрохимической конверсии, таких как твердотельный синтез аммиака (SSAS), так и от каталитических процессов, таких как процесс Габера-Боша. В этой форме физической активации микроволновый плазменный процесс может активировать как азот, так и водород, а также производить ионы и свободные радикалы, которые реагируют на поверхности катализатора с образованием аммиака. Одно из преимуществ этого процесса состоит в том, что при соответствующих условиях микроволновое нагревание способно селективно нагреть катализатор до требуемой температуры без необходимости проведения реакций и без нагрева окружающей среды.Такое расположение катализатора с высокой температурой в прохладной окружающей среде приводит к более низким общим температурам реакции и повышает энергоэффективность. Кроме того, как указано в WVU (2016), упрощенная конструкция этого процесса связана с его низким рабочим давлением. Низкое рабочее давление этого процесса позволяет ему лучше подходить к возобновляемым источникам энергии, поскольку, как сообщается, систему можно легко включать и выключать.
Одно из преимуществ этого процесса состоит в том, что при соответствующих условиях микроволновое нагревание способно селективно нагреть катализатор до требуемой температуры без необходимости проведения реакций и без нагрева окружающей среды.Такое расположение катализатора с высокой температурой в прохладной окружающей среде приводит к более низким общим температурам реакции и повышает энергоэффективность. Кроме того, как указано в WVU (2016), упрощенная конструкция этого процесса связана с его низким рабочим давлением. Низкое рабочее давление этого процесса позволяет ему лучше подходить к возобновляемым источникам энергии, поскольку, как сообщается, систему можно легко включать и выключать.
Пептидно-функциональный катализатор на основе нитрогеназы для электрохимического производства аммиака
Аммиак в природе производится с помощью ферментов нитрогеназ с эффективностью примерно 75%.Поскольку эффективность производства аммиака в природе очень высока, электрохимики попытались использовать эти ферменты для промышленных применений синтеза аммиака, например, в исследовании, проведенном Loney et al. (2017). Согласно этому исследованию, электрохимический синтез аммиака является многообещающей технологией, но его низкие рабочие температура и условия давления показали эффективность менее 1%, что потребовало бы катализатора для повышения эффективности производства аммиака. Кроме того, катализаторы, функционализированные пептидами, были разработаны и испытаны в системе на основе анионообменной мембраны (AEM).Материал, используемый в этом катализаторе, показывает многообещающие результаты по сравнению с традиционными подходами к катализаторам. Шимански и Геллетт (2017) также заявляют, что электрохимические процессы являются модульными и могут сочетаться с возобновляемыми источниками энергии, такими как солнце и ветер, а также могут работать при относительно более низких температурах и давлениях по сравнению с более крупномасштабным традиционным производством аммиака. процессы. Для протекания этой реакции требуется катализатор, селективный по отношению к производству аммиака.Чтобы решить эту проблему, Шимански и Геллетт (2017) провели технико-экономическое обоснование с целью повышения селективности аммиака путем адаптации морфологии наночастиц катализатора и использования пептидов, полученных из нитрогеназы (естественного фермента, расщепляющего азот), для направления желаемой реакции.
(2017). Согласно этому исследованию, электрохимический синтез аммиака является многообещающей технологией, но его низкие рабочие температура и условия давления показали эффективность менее 1%, что потребовало бы катализатора для повышения эффективности производства аммиака. Кроме того, катализаторы, функционализированные пептидами, были разработаны и испытаны в системе на основе анионообменной мембраны (AEM).Материал, используемый в этом катализаторе, показывает многообещающие результаты по сравнению с традиционными подходами к катализаторам. Шимански и Геллетт (2017) также заявляют, что электрохимические процессы являются модульными и могут сочетаться с возобновляемыми источниками энергии, такими как солнце и ветер, а также могут работать при относительно более низких температурах и давлениях по сравнению с более крупномасштабным традиционным производством аммиака. процессы. Для протекания этой реакции требуется катализатор, селективный по отношению к производству аммиака.Чтобы решить эту проблему, Шимански и Геллетт (2017) провели технико-экономическое обоснование с целью повышения селективности аммиака путем адаптации морфологии наночастиц катализатора и использования пептидов, полученных из нитрогеназы (естественного фермента, расщепляющего азот), для направления желаемой реакции. . Гринли и др. (2017) рассмотрели вопросы селективности для электрохимического восстановления азота, разработав катализаторы с наночастицами, такие как катализаторы на основе неблагородных металлов, состоящие из железа и никеля, которые являются биметаллическими материалами и, как теоретически прогнозируется, приведут к созданию оптимальных поверхностей для восстановления азота.Гринли и др. (2017) также сообщили, что они могут контролировать локальное поверхностное окружение катализатора с помощью специально структурированного ряда короткоцепочечных пептидов, которые были вдохновлены структурой фермента нитрогеназы.
. Гринли и др. (2017) рассмотрели вопросы селективности для электрохимического восстановления азота, разработав катализаторы с наночастицами, такие как катализаторы на основе неблагородных металлов, состоящие из железа и никеля, которые являются биметаллическими материалами и, как теоретически прогнозируется, приведут к созданию оптимальных поверхностей для восстановления азота.Гринли и др. (2017) также сообщили, что они могут контролировать локальное поверхностное окружение катализатора с помощью специально структурированного ряда короткоцепочечных пептидов, которые были вдохновлены структурой фермента нитрогеназы.
Воздействие различных процессов производства аммиака на окружающую среду
Оценка жизненного цикла (LCA) — это основной метод, используемый для поддержки принятия решений для устойчивого развития производства. Был проведен ряд исследований по сравнительной оценке жизнеспособности устойчивых путей производства аммиака.Эти исследования включают Bicer et al. (2016) о сравнительной оценке жизненного цикла различных методов производства аммиака и Frattini et al. (2016) о системном подходе к энергетической оценке различных возобновляемых источников энергии, интегрированных в заводы по производству аммиака. Тот же подход (создание LCA) был использован Tallaksen и Reese (2013) и Arora et al. (2018), оба выбрали функциональную единицу из 1 кг аммиака для его производства с использованием ископаемого топлива и возобновляемых источников. Таллаксен и Риз (2013) сравнили оба подхода с точки зрения использования энергии и выбросов углерода.Однако Arora et al. (2018) определили выбросы углерода и затраты, связанные с производством аммиака. Граница системы, проведенная Таллаксеном и Ризом в их исследовании производства аммиака с помощью ветра, включала ветроэнергетику, водный электролизер, сжатие водорода, разделение / сжатие азота, производство аммиака и хранение аммиака (Matzen et al., 2015). Однако граница системы, выбранная Arora et al. поподробнее в сравнении. Arora et al. оценили выбросы в результате добычи угля, сбора биомассы, транспортировки, производства электроэнергии и коммунальных услуг в своем исследовании, а также провели оценку жизненного цикла производства аммиака.
(2016) о системном подходе к энергетической оценке различных возобновляемых источников энергии, интегрированных в заводы по производству аммиака. Тот же подход (создание LCA) был использован Tallaksen и Reese (2013) и Arora et al. (2018), оба выбрали функциональную единицу из 1 кг аммиака для его производства с использованием ископаемого топлива и возобновляемых источников. Таллаксен и Риз (2013) сравнили оба подхода с точки зрения использования энергии и выбросов углерода.Однако Arora et al. (2018) определили выбросы углерода и затраты, связанные с производством аммиака. Граница системы, проведенная Таллаксеном и Ризом в их исследовании производства аммиака с помощью ветра, включала ветроэнергетику, водный электролизер, сжатие водорода, разделение / сжатие азота, производство аммиака и хранение аммиака (Matzen et al., 2015). Однако граница системы, выбранная Arora et al. поподробнее в сравнении. Arora et al. оценили выбросы в результате добычи угля, сбора биомассы, транспортировки, производства электроэнергии и коммунальных услуг в своем исследовании, а также провели оценку жизненного цикла производства аммиака. Сделан вывод о том, что потенциал глобального потепления (ПГП) газификации угля с 4,22 кг CO 2 экв. / кг NH 3 является самым высоким по сравнению с газификацией биомассы с 1,2 кг CO 2 экв. природный газ находится между ними с ПГП 2,81 кг CO 2 экв. / кг NH 3 . Однако в этом исследовании газификация угля для производства аммиака была оценена ниже, чем другие обсуждаемые процессы, из-за более низкого энергопотребления, стоимости сырья и отсутствия значительного количества энергии, связанной со сжатием потока диоксида углерода.Махлуф и др. (2015) также провели LCA и представили результаты производства 1 тонны аммиака с помощью SMR природного газа в Алжире. Результаты показали, что GWP является высоким, что связано с объемом выбросов парниковых газов 1,44 т CO 2eq / т NH 3 . Хотя этот показатель (t CO 2eq / т NH 3 ) ниже по сравнению с результатами, сообщенными Arora et al. (2018) для производства аммиака из природного газа, который составляет 2,81 т CO 2 экв.
Сделан вывод о том, что потенциал глобального потепления (ПГП) газификации угля с 4,22 кг CO 2 экв. / кг NH 3 является самым высоким по сравнению с газификацией биомассы с 1,2 кг CO 2 экв. природный газ находится между ними с ПГП 2,81 кг CO 2 экв. / кг NH 3 . Однако в этом исследовании газификация угля для производства аммиака была оценена ниже, чем другие обсуждаемые процессы, из-за более низкого энергопотребления, стоимости сырья и отсутствия значительного количества энергии, связанной со сжатием потока диоксида углерода.Махлуф и др. (2015) также провели LCA и представили результаты производства 1 тонны аммиака с помощью SMR природного газа в Алжире. Результаты показали, что GWP является высоким, что связано с объемом выбросов парниковых газов 1,44 т CO 2eq / т NH 3 . Хотя этот показатель (t CO 2eq / т NH 3 ) ниже по сравнению с результатами, сообщенными Arora et al. (2018) для производства аммиака из природного газа, который составляет 2,81 т CO 2 экв. / т NH 3 ) выбросов парниковых газов.Граница системы для ОЖЦ различается в двух исследованиях. Согласно Makhlouf et al., Граница системы состоит из стадии обогащения и процесса SMR для синтеза аммиака. Кроме того, Махлуф заявил, что при расчете баланса парниковых газов учитывалось только количество природного газа, используемого в качестве топлива, а количество технологического газа не принималось во внимание. Результаты исследования показывают, что потребность в энергии для производства аммиака с помощью SMR природного газа в Алжире была на 25,16% выше, чем в других регионах мира.Сообщается, что эта цифра составляет 51,9 × 10 3 МДж / т аммиака, в то время как глобальные потребности в энергии для производства аммиака, как сообщается, составляют 41,5 × 10 3 МДж / т (IEA, 2007). Арора и др. провели анализ жизненного цикла, чтобы сравнить GWP биомассы с процессами производства аммиака в трех различных конфигурациях: SMR, автотермический риформинг (ATR) и риформинг диоксида углерода.
/ т NH 3 ) выбросов парниковых газов.Граница системы для ОЖЦ различается в двух исследованиях. Согласно Makhlouf et al., Граница системы состоит из стадии обогащения и процесса SMR для синтеза аммиака. Кроме того, Махлуф заявил, что при расчете баланса парниковых газов учитывалось только количество природного газа, используемого в качестве топлива, а количество технологического газа не принималось во внимание. Результаты исследования показывают, что потребность в энергии для производства аммиака с помощью SMR природного газа в Алжире была на 25,16% выше, чем в других регионах мира.Сообщается, что эта цифра составляет 51,9 × 10 3 МДж / т аммиака, в то время как глобальные потребности в энергии для производства аммиака, как сообщается, составляют 41,5 × 10 3 МДж / т (IEA, 2007). Арора и др. провели анализ жизненного цикла, чтобы сравнить GWP биомассы с процессами производства аммиака в трех различных конфигурациях: SMR, автотермический риформинг (ATR) и риформинг диоксида углерода. Все три конфигурации были смоделированы и сравнены для использования трех различных типов сырья биомассы: соломы, жмыха и древесины, чтобы понять влияние их состава на цепочку поставок, экономику и факторы окружающей среды при производстве аммиака.В их исследовании подчеркивается, что ПГП будет снижен, если биомасса будет использоваться в качестве сырья для синтеза аммиака. Среди трех типов биомассы, используемых для синтеза аммиака в исследовании, жмых имеет самый низкий ПГП, за ним следуют древесные и соломенные гранулы. Однако Arora et al. (2017) пришли к выводу, что ПГП соломы, используемой в качестве биомассы для производства аммиака, аналогичен ПГП природного газа для синтеза аммиака при отсутствии когенерации электроэнергии. Среди трех различных типов биомассы древесина имеет самый высокий уровень производства аммиака.Arora et al. (2017) провели многоцелевую оптимизацию (MOO), показав, что одним из путей снижения ПГП биомассы до процесса аммиака может быть использование части синтез-газа, полученного в результате газификации биомассы, который также может быть использован для производства электроэнергии.
Все три конфигурации были смоделированы и сравнены для использования трех различных типов сырья биомассы: соломы, жмыха и древесины, чтобы понять влияние их состава на цепочку поставок, экономику и факторы окружающей среды при производстве аммиака.В их исследовании подчеркивается, что ПГП будет снижен, если биомасса будет использоваться в качестве сырья для синтеза аммиака. Среди трех типов биомассы, используемых для синтеза аммиака в исследовании, жмых имеет самый низкий ПГП, за ним следуют древесные и соломенные гранулы. Однако Arora et al. (2017) пришли к выводу, что ПГП соломы, используемой в качестве биомассы для производства аммиака, аналогичен ПГП природного газа для синтеза аммиака при отсутствии когенерации электроэнергии. Среди трех различных типов биомассы древесина имеет самый высокий уровень производства аммиака.Arora et al. (2017) провели многоцелевую оптимизацию (MOO), показав, что одним из путей снижения ПГП биомассы до процесса аммиака может быть использование части синтез-газа, полученного в результате газификации биомассы, который также может быть использован для производства электроэнергии. Благодаря этому решению выбросы парниковых газов при использовании электроэнергии будут снижены. Однако эта стратегия снизит количество производимого аммиака, что приведет к увеличению цены на выпускаемый продукт.Arora et al. сравнили компромисс между производством аммиака и выработкой электроэнергии для трех различных типов сырья, и были получены разные результаты. Все переменные, такие как конкретный тип биомассы, экономика и экологический профиль, коррелируют с конкретным местом. Как сообщается для производства определенного количества аммиака с использованием того же производственного процесса, степень истощения воды при использовании жмыха выше по сравнению с использованием древесины в качестве сырья. Например, при использовании процесса SMR для производства аммиака количество истощения воды посредством жмыха считается равным 2.95 × 10 –2 м 3 , в то время как древесина составляла 3,3 × 10 –3 м 3 .
Благодаря этому решению выбросы парниковых газов при использовании электроэнергии будут снижены. Однако эта стратегия снизит количество производимого аммиака, что приведет к увеличению цены на выпускаемый продукт.Arora et al. сравнили компромисс между производством аммиака и выработкой электроэнергии для трех различных типов сырья, и были получены разные результаты. Все переменные, такие как конкретный тип биомассы, экономика и экологический профиль, коррелируют с конкретным местом. Как сообщается для производства определенного количества аммиака с использованием того же производственного процесса, степень истощения воды при использовании жмыха выше по сравнению с использованием древесины в качестве сырья. Например, при использовании процесса SMR для производства аммиака количество истощения воды посредством жмыха считается равным 2.95 × 10 –2 м 3 , в то время как древесина составляла 3,3 × 10 –3 м 3 .
Таллаксен и Риз (2013) пришли к выводу, что для производства водорода путем электролиза воды с помощью ветра требуется примерно 60 ГДж электроэнергии на тонну NH 3 . Эта общая энергия значительно выше по сравнению с традиционным производством аммиака на основе ископаемого топлива, которое составляет 36,6 ГДж энергии для производства 1 тонны аммиака. Согласно Таллаксену и Ризу (2013) для этого процесса требуется меньше ископаемой энергии, поскольку система работает с использованием энергии ветра, что приводит к более низким выбросам парниковых газов по сравнению с работой системы от сети, которая, как сообщается, составляет 58.7 ГДж / тонна. Принимая во внимание, что Frattini et al. (2016) пришли к выводу, что производство аммиака из возобновляемых источников энергии повышает надежность поставок. Оба исследования согласны с тем, что производство аммиака из возобновляемых источников энергии приводит к снижению выбросов углекислого газа.
Эта общая энергия значительно выше по сравнению с традиционным производством аммиака на основе ископаемого топлива, которое составляет 36,6 ГДж энергии для производства 1 тонны аммиака. Согласно Таллаксену и Ризу (2013) для этого процесса требуется меньше ископаемой энергии, поскольку система работает с использованием энергии ветра, что приводит к более низким выбросам парниковых газов по сравнению с работой системы от сети, которая, как сообщается, составляет 58.7 ГДж / тонна. Принимая во внимание, что Frattini et al. (2016) пришли к выводу, что производство аммиака из возобновляемых источников энергии повышает надежность поставок. Оба исследования согласны с тем, что производство аммиака из возобновляемых источников энергии приводит к снижению выбросов углекислого газа.
Bicer et al. (2016) провели это исследование четырех различных методов производства аммиака по процессу Габера-Боша с использованием в качестве исходного материала электролитического водорода. Они пришли к выводу: 1) производство аммиака из водного электролизера, работающего на биомассе и бытовых отходах, представляет собой надежную альтернативу распределенным предприятиям по производству аммиака и может увеличить производство удобрений; 2) производство аммиака на основе городских отходов можно рассматривать как один из наиболее экологически безопасных методов среди предлагаемых процессов, поскольку он имеет самые низкие значения абиотического истощения, глобального потепления и токсичности для человека 3) возобновляемые источники с их повышенной эффективностью могут снизить общее воздействие на окружающую среду и заменить существующие централизованные предприятия по производству аммиака, работающие на ископаемом топливе. Frattini et al. (2016), с другой стороны, сравнили эффективность потоков энергии и выбросов парниковых газов для процесса производства аммиака Haber-Bosch с помощью различных способов производства водорода. В рамках этого исследования они оценили три сценария производства возобновляемого водорода: 1) газификация биомассы, 2) электролиз воды и 3) риформинг биогаза. Они сравнили эти технологии с обычным SMR природного газа. Они пришли к выводу, что аммиак может производиться эффективным способом с использованием возобновляемых источников энергии, что приводит к альтернативному методу распределенного, эффективного и устойчивого процесса производства аммиака.Это приводит к снижению выбросов углекислого газа и затрат, а также к увеличению объемов производства. Более того, этот процесс позволяет хранить возобновляемую энергию в виде сезонного вектора энергии, который имеет высокую плотность энергии с низкими выбросами.
Frattini et al. (2016), с другой стороны, сравнили эффективность потоков энергии и выбросов парниковых газов для процесса производства аммиака Haber-Bosch с помощью различных способов производства водорода. В рамках этого исследования они оценили три сценария производства возобновляемого водорода: 1) газификация биомассы, 2) электролиз воды и 3) риформинг биогаза. Они сравнили эти технологии с обычным SMR природного газа. Они пришли к выводу, что аммиак может производиться эффективным способом с использованием возобновляемых источников энергии, что приводит к альтернативному методу распределенного, эффективного и устойчивого процесса производства аммиака.Это приводит к снижению выбросов углекислого газа и затрат, а также к увеличению объемов производства. Более того, этот процесс позволяет хранить возобновляемую энергию в виде сезонного вектора энергии, который имеет высокую плотность энергии с низкими выбросами.
Frattini et al. (2016) четко обосновали преимущества электролитического производства водорода по сравнению с газификацией биомассы / реформированием биогаза в отношении потока энергии каждой системы. Что касается потоков энергии, они пришли к выводу, что все предложенные процессы, включая традиционные методы SMR, имеют одинаковое потребление первичной энергии в диапазоне 14–15 кВтч / кг NH 3 .Новые конфигурации не влияют на количество первичной энергии, используемой для синтеза аммиака. Это демонстрирует, что использование возобновляемых источников энергии не ограничивает эффективность процесса. Они четко обосновали преимущества электролитического производства водорода по сравнению с газификацией биомассы или реформированием биогаза. Оба исследования направлены на количественную оценку затрат и преимуществ интеграции процесса Хабера-Боша с возобновляемым водородным сырьем в результате газификации биомассы, электролиза воды, работающей на солнечной, ветровой, гидроэнергетике, ядерной энергии и биомассе.Таким образом, оба проекта исследовали углеродоемкость производства аммиака. Однако Bicer et al. (2016) расширяет область своих исследований до полного LCA, включая GWP, человеческую токсичность и абиотическое истощение, в то время как исследование, проведенное Frattini et al.
Что касается потоков энергии, они пришли к выводу, что все предложенные процессы, включая традиционные методы SMR, имеют одинаковое потребление первичной энергии в диапазоне 14–15 кВтч / кг NH 3 .Новые конфигурации не влияют на количество первичной энергии, используемой для синтеза аммиака. Это демонстрирует, что использование возобновляемых источников энергии не ограничивает эффективность процесса. Они четко обосновали преимущества электролитического производства водорода по сравнению с газификацией биомассы или реформированием биогаза. Оба исследования направлены на количественную оценку затрат и преимуществ интеграции процесса Хабера-Боша с возобновляемым водородным сырьем в результате газификации биомассы, электролиза воды, работающей на солнечной, ветровой, гидроэнергетике, ядерной энергии и биомассе.Таким образом, оба проекта исследовали углеродоемкость производства аммиака. Однако Bicer et al. (2016) расширяет область своих исследований до полного LCA, включая GWP, человеческую токсичность и абиотическое истощение, в то время как исследование, проведенное Frattini et al. (2016) сделали упор в первую очередь на энергоэффективности. С другой стороны, исследование LCA, проведенное Таллаксеном и Ризом (2013), было больше сосредоточено на экологических проблемах, чем на истощении запасов сырья. Другое исследование, проведенное Bicer and Dincer (2018), подчеркивает преимущества использования аммиака в транспорте (легковые автомобили) и на электростанциях, оценивая различные воздействия на окружающую среду, включая: GWP, подкисление, абиотическое истощение и разрушение озонового слоя.В этом исследовании аммиак производится с помощью электролиза воды в электрохимическом реакторе с использованием расплавленного солевого электролита, работающего от энергии ветра. Согласно Bicer and Dincer (2018) выбросы парниковых газов для автомобилей, использующих вышеупомянутый аммиак, примерно на 37% ниже по сравнению с автомобилями с бензиновым двигателем. Это также относится к производству около 0,27 кВт-ч электроэнергии на электростанциях, работающих на аммиаке, по сравнению с электростанциями, работающими на природном газе, что приводит к уменьшению примерно на 64% кг CO 2eq .
(2016) сделали упор в первую очередь на энергоэффективности. С другой стороны, исследование LCA, проведенное Таллаксеном и Ризом (2013), было больше сосредоточено на экологических проблемах, чем на истощении запасов сырья. Другое исследование, проведенное Bicer and Dincer (2018), подчеркивает преимущества использования аммиака в транспорте (легковые автомобили) и на электростанциях, оценивая различные воздействия на окружающую среду, включая: GWP, подкисление, абиотическое истощение и разрушение озонового слоя.В этом исследовании аммиак производится с помощью электролиза воды в электрохимическом реакторе с использованием расплавленного солевого электролита, работающего от энергии ветра. Согласно Bicer and Dincer (2018) выбросы парниковых газов для автомобилей, использующих вышеупомянутый аммиак, примерно на 37% ниже по сравнению с автомобилями с бензиновым двигателем. Это также относится к производству около 0,27 кВт-ч электроэнергии на электростанциях, работающих на аммиаке, по сравнению с электростанциями, работающими на природном газе, что приводит к уменьшению примерно на 64% кг CO 2eq . И Frattini et al. (2016) и Bicer and Dincer (2018) заключают, что производство электролитического водорода для синтеза аммиака выгодно с экологической точки зрения из-за потенциального отсутствия выбросов парниковых газов. Байсер и Динсер (2018) также приводят четкие аргументы в пользу замены традиционных видов топлива на безуглеродный аммиак, тем самым значительно сокращая выбросы парниковых газов, связанные с транспортным сектором и производством электроэнергии.
И Frattini et al. (2016) и Bicer and Dincer (2018) заключают, что производство электролитического водорода для синтеза аммиака выгодно с экологической точки зрения из-за потенциального отсутствия выбросов парниковых газов. Байсер и Динсер (2018) также приводят четкие аргументы в пользу замены традиционных видов топлива на безуглеродный аммиак, тем самым значительно сокращая выбросы парниковых газов, связанные с транспортным сектором и производством электроэнергии.
Решение проблем, связанных с современными возобновляемыми технологиями производства аммиака
В данном разделе недостаточно исследований по экологическим и экономическим последствиям использования воды при производстве аммиака.
Water Intensity
Было проведено множество исследований по устойчивому производству аммиака и в основном сосредоточено на водных электролизерах, работающих на возобновляемых технологиях, таких как солнечная и ветровая. Эти исследования включают исследование, проведенное Соловейчком (2017), и серию различных процессов, собранную Ван и др. (2018), Service (2018) и Hughes et al. (2015). При оценке потребления воды при производстве аммиака в этих обзорах существует серьезный пробел в исследованиях экологических и экономических аспектов устойчивости.Для работы эти процессы требуют постоянного водоснабжения с учетом последствий все более серьезного мирового водного кризиса. Важнейшими исходными материалами для электролиза являются электричество и деионизированная вода. Как правило, для работы водного электролизера требуется предварительно обработанная вода высокой чистоты (Mehmeti et al., 2018). Причем для производства 1 тонны водорода требуется 9 тонн воды. Основные последствия потребления воды в различных процессах производства водорода и воздействия, связанные с водой на окружающую среду, являются важными факторами, которые были оценены в исследовании, проведенном Mehmeti et al.(2018) с помощью LCA. Исследования, проведенные Alcamo et al. (2007), Distefano и Kelly (2017), Ercin and Hoekstra (2014) и Hoekstra et al. (2011) показали, что в следующие несколько десятилетий произойдет значительный рост нехватки воды, что приведет к проблемам для продовольственной безопасности, экологической устойчивости и экономики.
(2018), Service (2018) и Hughes et al. (2015). При оценке потребления воды при производстве аммиака в этих обзорах существует серьезный пробел в исследованиях экологических и экономических аспектов устойчивости.Для работы эти процессы требуют постоянного водоснабжения с учетом последствий все более серьезного мирового водного кризиса. Важнейшими исходными материалами для электролиза являются электричество и деионизированная вода. Как правило, для работы водного электролизера требуется предварительно обработанная вода высокой чистоты (Mehmeti et al., 2018). Причем для производства 1 тонны водорода требуется 9 тонн воды. Основные последствия потребления воды в различных процессах производства водорода и воздействия, связанные с водой на окружающую среду, являются важными факторами, которые были оценены в исследовании, проведенном Mehmeti et al.(2018) с помощью LCA. Исследования, проведенные Alcamo et al. (2007), Distefano и Kelly (2017), Ercin and Hoekstra (2014) и Hoekstra et al. (2011) показали, что в следующие несколько десятилетий произойдет значительный рост нехватки воды, что приведет к проблемам для продовольственной безопасности, экологической устойчивости и экономики.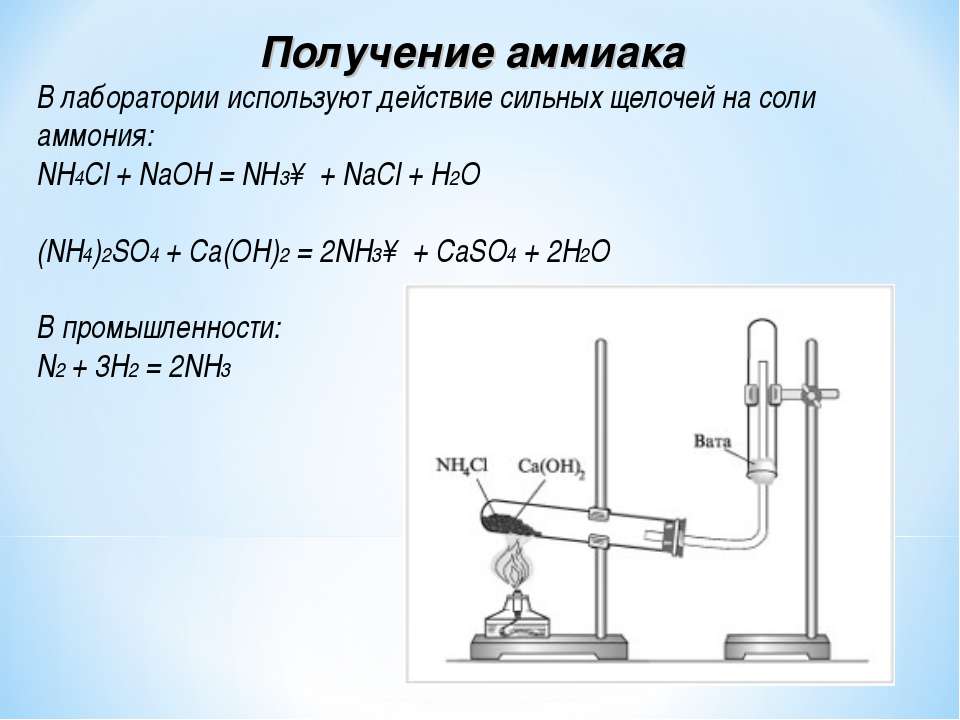 Однако следует отметить, что нехватка воды зависит от наличия на местах. По данным Mehmeti et al. (2018), SMR и электролиз воды наносят наибольший ущерб окружающей среде, поскольку в этих процессах для работы используется вода высокого качества (с низкой концентрацией растворенных твердых веществ / деионизированная вода).Морган (2013) также провел технико-экономическое обоснование установки по производству аммиака, работающей от морского ветра. В исследовании сообщается, что для производства 300 тонн аммиака требуется 476 тонн дистиллированной воды. Отношение количества очищенной воды к тонне аммиака (без учета воды, необходимой для градирни) составляет примерно 1,6. Этот показатель также сообщается Уиллом и Лукасом (2018) при оценке завода по производству аммиака с использованием электролиза воды, работающего на возобновляемых источниках энергии (солнечной, ветровой и гидроэнергетике).Для установки по производству аммиака производительностью 50 т / сутки требуется мощность 20 МВт, а для установки по производству аммиака мощностью 300 т / сутки требуется 120 МВт.
Однако следует отметить, что нехватка воды зависит от наличия на местах. По данным Mehmeti et al. (2018), SMR и электролиз воды наносят наибольший ущерб окружающей среде, поскольку в этих процессах для работы используется вода высокого качества (с низкой концентрацией растворенных твердых веществ / деионизированная вода).Морган (2013) также провел технико-экономическое обоснование установки по производству аммиака, работающей от морского ветра. В исследовании сообщается, что для производства 300 тонн аммиака требуется 476 тонн дистиллированной воды. Отношение количества очищенной воды к тонне аммиака (без учета воды, необходимой для градирни) составляет примерно 1,6. Этот показатель также сообщается Уиллом и Лукасом (2018) при оценке завода по производству аммиака с использованием электролиза воды, работающего на возобновляемых источниках энергии (солнечной, ветровой и гидроэнергетике).Для установки по производству аммиака производительностью 50 т / сутки требуется мощность 20 МВт, а для установки по производству аммиака мощностью 300 т / сутки требуется 120 МВт. Основываясь на исследовании Уилла и Лукаса, потери воды из градирен составляют примерно 1–1,5% от общего количества поступающей воды. Это показывает, что для производства примерно 1 тонны аммиака требуется 2,45 тонны воды с учетом количества потерь воды в градирнях. Хотя Уилл и Лукас (2018) сообщают, что часть входящей воды теряется через градирни, при использовании метода оценки воздействия AWARE в LCA вода, используемая для градирен, считается потерей 100%.Согласно исследованию, проведенному Morgan (2013), система опреснения воды включена в его процесс для производства очищенной воды, необходимой для синтеза аммиака. Использование систем опреснения является энергоемким и наносит ущерб биоразнообразию океана и морской жизни (Peterson, 2017). В 2016 году в мире было произведено 146 миллионов тонн аммиака. Исходя из этих данных, для производства того же количества аммиака путем электролиза воды требуется 233,6 миллиона тонн воды.В то время как водный электролизер в сочетании с возобновляемыми технологиями, как обсуждалось выше, требует больших объемов воды для своей работы, обычный процесс производства аммиака, который представляет собой SMR в сочетании с процессами Габера-Боша, также является относительно водоемким, требуя примерно 0,656 кг воды для производства 1.
Основываясь на исследовании Уилла и Лукаса, потери воды из градирен составляют примерно 1–1,5% от общего количества поступающей воды. Это показывает, что для производства примерно 1 тонны аммиака требуется 2,45 тонны воды с учетом количества потерь воды в градирнях. Хотя Уилл и Лукас (2018) сообщают, что часть входящей воды теряется через градирни, при использовании метода оценки воздействия AWARE в LCA вода, используемая для градирен, считается потерей 100%.Согласно исследованию, проведенному Morgan (2013), система опреснения воды включена в его процесс для производства очищенной воды, необходимой для синтеза аммиака. Использование систем опреснения является энергоемким и наносит ущерб биоразнообразию океана и морской жизни (Peterson, 2017). В 2016 году в мире было произведено 146 миллионов тонн аммиака. Исходя из этих данных, для производства того же количества аммиака путем электролиза воды требуется 233,6 миллиона тонн воды.В то время как водный электролизер в сочетании с возобновляемыми технологиями, как обсуждалось выше, требует больших объемов воды для своей работы, обычный процесс производства аммиака, который представляет собой SMR в сочетании с процессами Габера-Боша, также является относительно водоемким, требуя примерно 0,656 кг воды для производства 1. т аммиака. Однако этот показатель ниже, чем у вышеупомянутых способов производства аммиака. Таблица 5 показывает, что SMR в сочетании с процессом Haber-Bosch является наиболее углеродоемкой технологией с 1.8 кг CO 2 / т NH 3 по сравнению с другой технологией. Электролиз воды является наиболее водоемким (около 1,588 кг H 2 O / т NH 3 ) и энергоемким (около 12 000 кВтч / т NH 3 ) среди рассматриваемых процессов.
т аммиака. Однако этот показатель ниже, чем у вышеупомянутых способов производства аммиака. Таблица 5 показывает, что SMR в сочетании с процессом Haber-Bosch является наиболее углеродоемкой технологией с 1.8 кг CO 2 / т NH 3 по сравнению с другой технологией. Электролиз воды является наиболее водоемким (около 1,588 кг H 2 O / т NH 3 ) и энергоемким (около 12 000 кВтч / т NH 3 ) среди рассматриваемых процессов.
ТАБЛИЦА 5 . Основное потребление и выбросы парниковых газов для возобновляемых и традиционных технологий производства аммиака для производства 1 тонны аммиака.
Заключение
Аммиак может играть роль топлива для хранения энергии, а также его основное применение в качестве основного ингредиента для удобрений, транспортного топлива и многих других применений.Однако необходимы устойчивые маршруты его производства. Поскольку водород является основным сырьем для синтеза аммиака, был проведен обзор различных устойчивых процессов производства водорода и аммиака. Кроме того, была проведена оценка различных исследований экологических показателей производства аммиака с помощью LCA.
Кроме того, была проведена оценка различных исследований экологических показателей производства аммиака с помощью LCA.
Обзор технологий производства аммиака показывает, что существующие процессы являются либо многоступенчатыми, энерго- или углеродоемкими, либо требуют значительных водных ресурсов для работы.Определение более экологически чистых путей (с низким содержанием углерода, низким содержанием воды и низким энергопотреблением) для производства аммиака важно для обеспечения продовольственной безопасности и его применения в хранении энергии. После обзора нескольких исследований кажется, что не уделяется должного внимания процессам, направленным на сокращение количества воды, необходимой для устойчивого производства аммиака. Однако существует ряд исследований, в которых оценивается влияние использования воды в различных процессах производства аммиака (SMR и электролиз воды), уделяя особое внимание продовольственной безопасности, экологической устойчивости и экономике посредством проведения LCA. В этом исследовании сравниваются две зрелые технологии, SMR и электролиз воды, обе в сочетании с Haber-Bosch и использующие возобновляемые источники энергии. Первые потребляют меньше воды при более высоких выбросах парниковых газов, а вторые выделяют меньше парниковых газов при более высоком водопотреблении. Конечно, у каждой технологии производства водорода есть свои плюсы и минусы, выбор которых требует различных критериев, которые будут специфичными для конкретного проекта и контекста. Эти критерии включают воздействие на окружающую среду, эффективность, рентабельность, ресурсы и их использование, коммерческую доступность и жизнеспособность, а также варианты интеграции системы (например,g., темное брожение в сочетании с анаэробным сбраживанием), которые необходимо учитывать. Необходимы дополнительные исследования в нескольких ключевых областях исследований производства аммиака путем утилизации отходов, воздействия на окружающую среду использования воды для производства аммиака и мест, где необходимо разместить завод по производству аммиака, как с точки зрения наличия сырья, так и с точки зрения устойчивости (доступность к возобновляемым источникам энергии, таким как солнечная фотоэлектрическая и ветровая энергия, расстояние от центра сбора отходов до производственного предприятия и т.
В этом исследовании сравниваются две зрелые технологии, SMR и электролиз воды, обе в сочетании с Haber-Bosch и использующие возобновляемые источники энергии. Первые потребляют меньше воды при более высоких выбросах парниковых газов, а вторые выделяют меньше парниковых газов при более высоком водопотреблении. Конечно, у каждой технологии производства водорода есть свои плюсы и минусы, выбор которых требует различных критериев, которые будут специфичными для конкретного проекта и контекста. Эти критерии включают воздействие на окружающую среду, эффективность, рентабельность, ресурсы и их использование, коммерческую доступность и жизнеспособность, а также варианты интеграции системы (например,g., темное брожение в сочетании с анаэробным сбраживанием), которые необходимо учитывать. Необходимы дополнительные исследования в нескольких ключевых областях исследований производства аммиака путем утилизации отходов, воздействия на окружающую среду использования воды для производства аммиака и мест, где необходимо разместить завод по производству аммиака, как с точки зрения наличия сырья, так и с точки зрения устойчивости (доступность к возобновляемым источникам энергии, таким как солнечная фотоэлектрическая и ветровая энергия, расстояние от центра сбора отходов до производственного предприятия и т. д.). Чтобы четко решить проблему, связанную с уменьшением количества воды в процессах производства аммиака, необходим метаанализ различных технологий и стадий производства аммиака. Эти факторы необходимо учитывать в будущих исследованиях.
д.). Чтобы четко решить проблему, связанную с уменьшением количества воды в процессах производства аммиака, необходим метаанализ различных технологий и стадий производства аммиака. Эти факторы необходимо учитывать в будущих исследованиях.
Вклад авторов
SG является ведущим автором, и MV рецензировал и редактировал рукопись IW рецензировал и редактировал рукопись PS был научным руководителем PhD, рецензировал и редактировал рукопись.
Финансирование
Мы хотим поблагодарить UKRI-BBSRC за финансирование PS по гранту BB / M011917 / 1, Производство возобновляемых удобрений для повышения эффективности сельского хозяйства и предотвращения вреда для окружающей среды.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Глоссарий
AEM Анионообменная мембрана
ATR Автотермическое риформинг
CAPEX Капитальные затраты
COD Химическая потребность в кислороде
EPA Агентство по охране окружающей среды
FAO Food and Сельскохозяйственная организация
GHG Green House Gas
GWP Потенциал глобального потепления
HHV Высокая теплотворная способность
HTE Высокотемпературный электролиз
LCA Оценка жизненного цикла
LHV Низкая теплотворная способность
MOO Оптимизация для нескольких целей
NGASE Паровой электролизер с использованием природного газа
NTP Нетепловая плазма
OFMSW Органическая фракция твердых бытовых отходов
OLR Скорость органической нагрузки
9 0027 PEC Фотоэлектрохимические ячейкиSGP Производство удельного газа
SHP Удельное производство водорода
SMP Растворимый микробный продукт
SMR Паровой риформинг метана
SOFEC Твердооксидный топливный электролизер
SOFC Твердооксидный топливный элемент
SSAS Твердотельный синтез аммиака
VFA Летучая жирная кислота
MEC Ячейка для микробного электролиза
MFC Микробный топливный элемент
NRR Восстановление азота
ООН Организация Объединенных Наций
WVU Университет Западной Вирджинии
WVURC Исследовательская корпорация Университета Западной Вирджинии
CO 2eq Эквивалент углекислого газа
FE (%) Faradic Efficienc y (%)
люкс Освещенность
VS Летучие твердые вещества
Ссылки
Acar, C. , и Динсер, I. (2018). «3.1. Производство водорода »в Комплексные энергетические системы . Редактор И. Динсер (Oshawa: Elsevier), 3–39.
, и Динсер, I. (2018). «3.1. Производство водорода »в Комплексные энергетические системы . Редактор И. Динсер (Oshawa: Elsevier), 3–39.
Google Scholar
Акрум-Амруш, Д., Абди, Н., Луничи, Х. и Мамери, Н. (2013). «Производство биоводорода с помощью процессов темноты и фото-ферментации», Международная конференция по возобновляемым и устойчивым источникам энергии (IRSEC), 2013 г., Уарзазат, Марокко, 7–9 марта 2013 г. (IEEE), 499–503.
Google Scholar
Alcamo, J., Flörke, M., и Меркер, М. (2007). Будущие долгосрочные изменения мировых водных ресурсов, вызванные социально-экономическими и климатическими изменениями. Hydrological Sci. J. 52 (2), 247–275. doi: 10.1623 / hysj.52.2.247
CrossRef Полный текст | Google Scholar
Али, М., Чжоу, Ф., Чен, К., Коцур, К., Сяо, К., Буржуа, Л. и др. (2016). Наноструктурированный фотоэлектрохимический солнечный элемент для восстановления азота с использованием черного кремния, усиленного плазмонами. Nat. Commun. 7 (11335), 1–5. DOI: 10.1038 / ncomms11335
Nat. Commun. 7 (11335), 1–5. DOI: 10.1038 / ncomms11335
CrossRef Полный текст | Google Scholar
Amar, I. A., Lan, R., Petit, C. T. G., and Tao, S. (2011). Твердотельный электрохимический синтез аммиака: обзор. J. Solid State Electrochem. 15 (9), 1845–1860. doi: 10.1007 / s10008-011-1376-x
CrossRef Полный текст | Google Scholar
Argun, H., and Kargi, F. (2010). Производство фотоферментативного газообразного водорода из сточных вод темного брожения измельченного раствора пшеницы: влияние источника света и интенсивности света. Внутр. J. Hydrogen Energ. 35 (4), 1595–1603. doi: 10.1016 / j.ijhydene.2009.12.040
CrossRef Полный текст | Google Scholar
Арора, П., Ходли, А. Ф., Махаджани, С. М., и Ганеш, А. (2016). Мелкомасштабное производство аммиака из биомассы: техно-экологическая перспектива. Ind. Eng. Chem. Res. 55, 6422–6434. doi: 10.1016 / j.jclepro.2017.01.148
CrossRef Полный текст | Google Scholar
Арора, П. , Ходли, А. Ф. А., Махаджани, С. М., и Ганеш, А.(2017). Многоцелевая оптимизация производства аммиака на основе биомассы — потенциал и перспективы в разных странах. J. Clean. Prod. 148, 363–374. doi: 10.1016 / j.jclepro.2017.01.148
, Ходли, А. Ф. А., Махаджани, С. М., и Ганеш, А.(2017). Многоцелевая оптимизация производства аммиака на основе биомассы — потенциал и перспективы в разных странах. J. Clean. Prod. 148, 363–374. doi: 10.1016 / j.jclepro.2017.01.148
CrossRef Полный текст | Google Scholar
Арора, П., Шарма, И., Ходли, А., Махаджани, С., и Ганеш, А. (2018). Удаленные, мелкие, «более зеленые» маршруты производства аммиака. J. Clean. Prod. 199, 177–192. doi: 10.1016 / j.jclepro.2018.06.130
CrossRef Полный текст | Google Scholar
Арслан, К., Саттар, А., Чангиинг, Дж., Насир, А., Мари, И. А., и Бахт, М. З. (2015). Влияние интервала регулирования pH на производство биоводорода из органической фракции твердых бытовых отходов путем мезофильного термофильного анаэробного совместного переваривания . Хиндави: BioMed Research International, 1–9.
CrossRef Полный текст
Байсер, Й., и Динсер, И. (2018). Оценка жизненного цикла использования аммиака в городском транспорте и производстве электроэнергии. J. Clean. Prod. 170, 1594–1601.doi: 10.1016 / j.jclepro.2017.09.243
J. Clean. Prod. 170, 1594–1601.doi: 10.1016 / j.jclepro.2017.09.243
CrossRef Полный текст | Google Scholar
Bicer, Y., Dincer, I., Zamfirescu, C., Vezina, G., and Raso, F. (2016). Сравнительная оценка жизненного цикла различных методов производства аммиака. J. Clean. Prod. 135, 1379–1395. doi: 10.1016 / j.jclepro.2016.07.023
CrossRef Полный текст | Google Scholar
Bicer, Y. (2017). Исследование новых вариантов производства аммиака с использованием фотоэлектрохимического водорода. Кандидатская диссертация. Ошава: Технологический институт Университета Онтарио, факультет инженерии и прикладных наук.
Google Scholar
Bolzonella, D., Battista, F., Cavinato, C., Gottardo, M., Micolucci, F., Lyberatos, G., et al. (2018). Последние разработки в производстве биогитана из бытовых пищевых отходов: обзор. Биоресурсы. Technol. 257, 311–319. doi: 10.1016 / j.biortech.2018.02.092
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Chong, M. -L., Sabaratnam, V., Shirai, Y., and Hassan, M.A. (2009). Производство биоводорода из биомассы и промышленных отходов методом темного брожения. Внутр. J. Hydrogen Energ. 34, 3277–3287. doi: 10.1016 / j.ijhydene.2009.02.010
-L., Sabaratnam, V., Shirai, Y., and Hassan, M.A. (2009). Производство биоводорода из биомассы и промышленных отходов методом темного брожения. Внутр. J. Hydrogen Energ. 34, 3277–3287. doi: 10.1016 / j.ijhydene.2009.02.010
CrossRef Полный текст | Google Scholar
Chu, C.F., Li, Y.Y., Xu, K.Q., Ebie, Y., Inamori, Y., and Kong, H.N. (2008). Двухступенчатый процесс получения водорода и метана из пищевых отходов с изменением температуры и pH. Внутр. J. Hydrog. Энергия. 33, 4739–4746.
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ciranna, A. (2014). Производство биоводорода в экстремальных условиях: всестороннее исследование ферментативного метаболизма полиэстремофильных бактерий диссертация .Тампере: Технологический университет Тампере, 220.
Cong, L., Yu, Z., Liu, F., and Huang, W. (2019). Электрохимический синтез аммиака из N2 и h3O с использованием типичного катализатора на основе углерода неблагородного металла в условиях окружающей среды. Catal. Sci. Technol. 9, 1208–1214. doi: 10.1039 / c8cy02316f
Catal. Sci. Technol. 9, 1208–1214. doi: 10.1039 / c8cy02316f
CrossRef Полный текст | Google Scholar
De Gioannis, G., Muntoni, A., Polettini, A., and Pomi, R. (2013). Обзор производства темного ферментативного водорода из биоразлагаемых фракций городских отходов. Waste Manag. 33, 1345–1361. doi: 10.1016 / j.wasman.2013.02.019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Динсер, И., и Байсер, Ю. (2018). «3.2 Производство аммиака» в Комплексные энергетические системы . Редактор И. Динсер (Oshawa: Elsevier), 42–82.
Google Scholar
Дистефано, Т., и Келли, С. (2017). Мы на глубине? Нехватка воды и ее пределы для экономического роста. Ecol. Экон. 142, 130–147. DOI: 10.1016 / j.ecolecon.2017.06.019
CrossRef Полный текст | Google Scholar
Элговайни, А. (2015). Анализ жизненного цикла потребления воды для производства водорода. Арлингтон: Ежегодный обзор достоинств и отчет коллегиальной оценки, 8–12.
Google Scholar
Frattini, D., Cinti, G., Bidini, G., Desideri, U., Cioffi, R., and Jannelli, E. (2016). Системный подход в энергетической оценке интеграции различных возобновляемых источников энергии на предприятиях по производству аммиака. Обновить.Energ. 99, 472–482. doi: 10.1016 / j.renene.2016.07.040
CrossRef Полный текст | Google Scholar
Garagounis, I., Kyriakou, V., Skodra, A., Vasileiou, E., and Stoukides, M. (2014). Электрохимический синтез аммиака в ячейках с твердым электролитом. Фронт. Energ. Res. 2, 1–10. doi: 10.3389 / fenrg.2014.00001
CrossRef Полный текст | Google Scholar
Ghimire, A., Frunzo, L., Pirozzi, F., Trably, E., Escudie, R., Lens, P. N. L., et al. (2015). Обзор производства темного ферментативного биоводорода из органической биомассы: параметры процесса и использование побочных продуктов. Заявл. Energ. 144, 73–95. doi: 10.1016 / j.apenergy.2015.01.045
CrossRef Полный текст | Google Scholar
Гидди, С. , Бадвал, С. П. С. и Кулкарни, А. (2013). Обзор технологий и материалов электрохимического производства аммиака. Внутр. J. Hydrogen Energ. 38 (34), 14576–14594. doi: 10.1016 / j.ijhydene.2013.09.054
, Бадвал, С. П. С. и Кулкарни, А. (2013). Обзор технологий и материалов электрохимического производства аммиака. Внутр. J. Hydrogen Energ. 38 (34), 14576–14594. doi: 10.1016 / j.ijhydene.2013.09.054
CrossRef Полный текст | Google Scholar
Greenlee, L., Foster, S., Acharya, P., Suttmiller, D., Loney, C., Renner, J., et al.(2017). «Тематическая конференция: Nh4 Energy» на ежегодном собрании AIChE, Миннеаполис, 29 октября — 3 ноября 2017 г.
Google Scholar
Guerra, CF, Reyes-Bozo, L., Vyhmeister, E., Caparros, MJ, Salazar , JL, и Клементе-Джуль, C. (2020). Технико-экономический анализ завода по производству зеленого аммиака в Чили и его последующая транспортировка в Японию. Обновить. Energ. 157, 404–414. doi: 10.1016 / j.renene.2020.05.041
CrossRef Полный текст | Google Scholar
Guo, X., Ду, Х., Ку, Ф., и Ли, Дж. (2019). Недавний прогресс в электрокаталитическом восстановлении азота. J. Mater. Chem. А. 7, 3531–3543. doi: 10.1039 / c8ta11201k
CrossRef Полный текст | Google Scholar
Hawkes, F., Hussy, I., Kyazze, G., Dinsdale, R., and Hawkes, D. (2007). Непрерывное темное ферментативное производство водорода мезофильной микрофлорой: принципы и прогресс. Внутр. J. Hydrogen Energ. 32, 172–184. doi: 10.1016 / j.ijhydene.2006.08.014
CrossRef Полный текст | Google Scholar
Hoekstra, A.Ю., Чапагейн, А. К., Алдая, М. М., Меконнен, М. М. (2011). Руководство по оценке водного следа, устанавливающее мировой стандарт . Лондон, Великобритания: Earthscan.
Hughes, T., Wilkinson, I., Tsang, E., McPherson, I., Sudmeier, T., Fellowes, J., et al. (2015). Зеленый аммиак. Кардифф: СИМЕНС. Доступно по адресу: http://businessdocbox.com/73271609-Green_Solutions/Green-ammonia-september-2015.html (по состоянию на 20 июня 2020 г.).
Google Scholar
Капдан, И. К., и Карги, Ф.(2006). Производство био-водорода из отходов. Enzyme Microb. Technol. 38, 569–582. doi: 10.1016 / j.enzmictec.2005.09.015
CrossRef Полный текст | Google Scholar
Kataoka, N., Ayame, S., Miya, A., Ueno, Y., Oshita, N., Tsukahara, K., et al. (2005). «Исследования процесса водородно-метановой ферментации для обработки мусора и макулатуры», ADSW 2005 Conference Proceedings. (Копенгаген, Дания: Технологический инжиниринг), 2.
CrossRef Полный текст | Google Scholar
Кордали, В., Kyriacou, G., и Lambrou, C. (2000). Электрохимический синтез аммиака при атмосферном давлении и низкой температуре в ячейке с твердым полимерным электролитом. Chem. Commun. 17, 1673–1674. doi: 10.1039 / b004885m
CrossRef Полный текст | Google Scholar
Котари Р., Кумар В., Патак В. В., Ахмад С., Аойи О. и Тьяги В. В. (2017). Критический обзор факторов, влияющих на производство ферментативного водорода. Фронт. Biosci. 22, 1195–1220. doi: 10.2741 / 4542
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Lan, R., Ирвин, Дж. Т., и Тао, С. (2013). Синтез аммиака непосредственно из воздуха и воды при температуре и давлении окружающей среды. Scientific Rep. 3 (1145), 1–7. doi: 10.1038 / srep01145
CrossRef Полный текст | Google Scholar
Lapina, A., Holtappels, P., and Mogensen, M. B. (2013). Электролиты и электроды для электрохимического синтеза аммиака. Кандидатская диссертация. Kongens Lyngby: Департамент преобразования и хранения энергии, Технический университет Дании.
Google Scholar
Ли, З.-K., Li, S.-L., Kuo, P.-C., Chen, I.-C, Tien, Y.-M., Huang, Y.-J., et al. (2010). Исследование термофильного биоэнергетического процесса водородного брожения с овощными кухонными отходами. Внутр. J. Hydrog. Энергия. 35 (24), 13458–13466.
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Liu, B.-F., Ren, N.-Q., Xing, D.-F., Ding, J., Zheng, G.-X., Guo, W.-Q., et. al. (2009). Производство водорода иммобилизованным R. faecalis RLD-53 с использованием растворимых метаболитов из бактерий E.harbinense B49. Биоресурсы. Technol. 100, 2719–2723. doi: 10.1016 / j.biortech.2008.12.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю Д., Ангелидаки И., Цзэн Р. Дж. И Мин Б. (2008). Производство био-водорода путем темного брожения из органических отходов и остатков. Кандидатская диссертация. Kongens Lyngby: Департамент преобразования и хранения энергии, Технический университет Дании.
Google Scholar
Лю, Р., Се, Ю., Ван, Дж., Ли, З., и Ван Б. (2006). Синтез аммиака при атмосферном давлении с Ce0.8M0.2O2 − δ (M = La, Y, Gd, Sm) и их протонная проводимость при промежуточной температуре. Ионика твердого тела 177, 73–76. doi: 10.1016 / j.ssi.2005.07.018
CrossRef Полный текст | Google Scholar
Loney, C., Graybill, A., Xu, C., Renner, J., Acharya, P., Suttmiller, D., et al. (2017). «Nh4 Energy + Изучение пептидно-связанных катализаторов для электрохимического производства аммиака», на ежегодном собрании AIChE, тематической конференции, Миннеаполис, 29 октября — 3 ноября 2017 г.
Google Scholar
Луо, Ю., Ши, Ю., Ли, В., Ни, М., и Цай, Н. (2014). Моделирование элементарных реакций и экспериментальная характеристика паровых электролизеров на твердом оксидном топливе. Внутр. J. Hydrogen Energ. 39, 10359–10373. doi: 10.1016 / j.ijhydene.2014.05.018
CrossRef Полный текст | Google Scholar
Makhlouf, A., Serradj, T., and Cheniti, H. (2015). Оценка воздействия жизненного цикла производства аммиака в Алжире: сравнение с предыдущими исследованиями. Environ. Оценка воздействия. Ред. 50, 35–41. doi: 10.1016 / j.eiar.2014.08.003
CrossRef Полный текст | Google Scholar
Марнеллос, Г., Жисекас, С., и Стоукидес, М. (2000). Синтез аммиака при атмосферном давлении с использованием твердотельных протонных проводников. J. Catal. 193, 80–87. doi: 10.1006 / jcat.2000.2877
CrossRef Полный текст | Google Scholar
Маррони, М. (2015). Протонопроводящая керамика: от основ к прикладным исследованиям .Сингапур: Pan Stanford Publishing Pte. Ltd.
CrossRef Полный текст
Мартинес-Фриас, Дж., Фам, А. К. и Асевес, М. (2003). Паровой электролизер на природном газе для высокоэффективного производства водорода. Внутр. J. Hydrogen Energ. 28, 483–490. doi: 10.1016 / s0360-3199 (02) 00135-0
CrossRef Полный текст | Google Scholar
Мацен, М. Дж., Альхаджи, М. Х., и Демирель, Ю. (2015). Техникоэкономика и устойчивость производства метанола и аммиака из возобновляемых источников с использованием водорода на основе энергии ветра. Adv. Chem. Англ. 5 (3), 1–12. doi: 10.4172 / 2090-4568.1000128
CrossRef Полный текст | Google Scholar
Мехмети, А., Димакис, А. А., Арампацис, Г., Макфейл, С. Дж., И Ульгиати, С. (2018). Оценка жизненного цикла и водный след методов производства водорода: от традиционных к новейшим технологиям. Окружающая среда 5, 1–19. doi: 10.3390 / environment5020024
CrossRef Полный текст | Google Scholar
Майкл, М., Альхаджи, М., и Демирель, Ю.(2015). Техникоэкономика и устойчивость производства возобновляемого метанола и аммиака с использованием водорода на основе ветроэнергетики. Adv. Chem. Англ. 5 (3), 1–12. doi: 10.4172 / 2090-4568.1000128
CrossRef Полный текст | Google Scholar
Micolucci, F., Gottardo, M., Pavan, P., Cavinato, C., and Bolzonella, D. (2018). Сравнение экспериментального масштаба одно- и двухэтапного термофильного анаэробного сбраживания пищевых отходов. J. Clean. Prod. 171, 1376–1385. DOI: 10.1016 / j.jclepro.2017.10.080
CrossRef Полный текст | Google Scholar
Morgan, E. R., Manwell, J. F., and McGowan, J. G. (2017). Устойчивое производство аммиака на оффшорных ветряных электростанциях США: технико-экономический обзор. ACS Sustain. Chem. Англ. 5, 9554–9567. doi: 10.1021 / acssuschemeng.7b02070
CrossRef Полный текст | Google Scholar
Морган, Э. Р. (2013). Технико-экономическое обоснование аммиачных заводов с использованием морского ветра. Кандидатская диссертация. Амхерст: Массачусетский университет в Амхерсте.
Google Scholar
Parkinson, B., Tabatabaei, M., Upham, D. C., Ballinger, B., Greig, C., Smart, S., et al. (2018). Производство водорода с использованием метана: технико-экономические аспекты обезуглероживания топлива и химикатов. Внутр. J. Hydrogen Energ. 43, 2540–2555. doi: 10.1016 / j.ijhydene.2017.12.081
CrossRef Полный текст | Google Scholar
Peng, P., Chen, P., Schiappacasse, C., Zhou, N., Anderson, E., Chen, D., et al. (2018). Обзор нетепловых плазменных технологий синтеза аммиака. J. Clean. Prod. 177, 597–609. doi: 10.1016 / j.jclepro.2017.12.229
CrossRef Полный текст | Google Scholar
Pengyu, D., Lianhua, L., Feng, Z., Xiaoying, K., Yongming, S., and Yi, Z. (2017). Сравнение методов предварительной обработки сухого и влажного помола для улучшения анаэробного переваривания гибрида Pennisetum. R. Soc. Chem. (Rsc) 7, 12610–12619. doi: 10.1039 / C6RA27822A
CrossRef Полный текст | Google Scholar
Pfromm, P.H.(2017). На пути к устойчивому сельскому хозяйству: аммиак без ископаемых. J. Renew. Поддерживать. Energ. 9, 1–20. doi: 10.1063 / 1.4985090
CrossRef Полный текст | Google Scholar
Pham, A. Q., Wallman, H., and Glass, R. S. (2000). Электролизер с паром на природном газе . Патент США 6051125.
CrossRef Полный текст
Редди, К. (2016). Оценка потенциала производства биогидрогена из жома сахарного тростника с использованием активного ила в процессе темной ферментации.Магистерская диссертация. Дурбан: Технологический университет Дурбана (DUT).
Google Scholar
Сен, У., Шакдвипи, М., и Банерджи, Р. (2008). Состояние производства биоводорода. J. Scientific Ind. Res. 67 (11), 980–993.
Google Scholar
Сингх А., Севда С., Абу Риш И., Ванброекховен К., Ратор Д. и Пант Д. (2015). Производство биоводорода из лигноцеллюлозной биомассы: технология и устойчивость. Энергии 8, 13062–13080. DOI: 10.3390 / en81112357
CrossRef Полный текст | Google Scholar
Skodra, A., and Stoukides, M. (2009). Электрокаталитический синтез аммиака из пара и азота при атмосферном давлении. Ионика твердого тела 180 (23-25), 1332–1336. doi: 10.1016 / j.ssi.2009.08.001
CrossRef Полный текст | Google Scholar
Соловейчик, Г. (2017a). «Nh4 Energy Будущее производства аммиака: усовершенствование процесса Хабер-Бош или электрохимический синтез?» В Тематической конференции: ежегодное собрание AIChE, Миннеаполис, 29 октября — 3 ноября 2017 г.
Google Scholar
Szymanski, S., and Gellett, W. (2017). «Катализатор с пептидами, функционализированный нитрогеназой, для эффективного производства аммиака без выбросов», на 14-й ежегодной конференции по топливу Nh4, ежегодное собрание AIChe. Тематическая конференция: Nh4 Energy, Миннеаполис, 1 ноября 2017 г. (Nh4 Fuel Association).
Google Scholar
Таллаксен, Дж. И Риз, М. (2013). «Производство аммиака с использованием энергии ветра: ранний расчет выбросов углерода в течение жизненного цикла и потребления ископаемой энергии», в 10-й ежегодной конференции по топливу Nh4 Ежегодная конференция по топливу Nh4.Сакраменто, 23 сентября 2013 г. (Топливная ассоциация Nh4).
Google Scholar
Тапиа-Венегас, Э., Рамирес-Моралес, Дж. Э., Сильва-Илланес, Ф., Толедо-Аларкон, Дж., Пайе, Ф., Эскуди, Р. и др. (2015). Производство биоводорода путем темного брожения: расширение масштабов и интеграция технологий для создания устойчивой системы. Rev. Environ. Sci. Biotechnol. 14, 761–785. doi: 10.1007 / s11157-015-9383-5
CrossRef Полный текст | Google Scholar
Valdez-Vazquez, I., and Poggi-Varaldo, H.М. (2009). Производство водорода ферментативными консорциумами. Обновить. Поддерживать. Energ. Ред. 13, 1000–1013. doi: 10.1016 / j.rser.2008.03.003
CrossRef Полный текст | Google Scholar
Ван, Л., Ся, М., Ван, Х., Хуанг, К., Цянь, К., и Маравелиас, К. Т. (2018). Экологизация аммиака в сторону солнечного завода по переработке аммиака. Джоуль 2 (6), 1–20. doi: 10.1016 / j.joule.2018.04.017
CrossRef Полный текст | Google Scholar
Ван, Х., Инь, Дж., Сюй, Дж., Ван, Х., и Ма, Г. (2011). Химическая стабильность, ионная проводимость BaCe0.9 − xZrxSm0.10O3 − α и его применение для синтеза аммиака при атмосферном давлении. Подбородок. J. Chem. 29, 1114–1118. doi: 10.1002 / cjoc.2011
CrossRef Полный текст | Google Scholar
Уилл М. и Лукас Л. (2018). Представляем возобновляемый аммиак от Thyssenkrupp . Роттердам, Нидерланды: NH 3 Event, 17–18.
Уилсон, И.А.Г., и Стайринг, П. (2017). Почему синтетическое топливо необходимо в энергетических системах будущего. Фронт. Energ. Res. 5, 1–10.doi: 10.3389 / fenrg.2017.00019
CrossRef Полный текст | Google Scholar
Xu, G., Liu, R., and Wang, J. (2009). Электрохимический синтез аммиака с использованием ячейки с мембраной Nafion и катодом SmFe0,7Cu0,3 − x Ni x O3 (x = 0−0,3) при атмосферном давлении и более низкой температуре. Sci. China Ser. B-Chem. 52, 1171–1175. doi: 10.1007 / s11426-009-0135-7
CrossRef Полный текст | Google Scholar
Yoo, C.Y., Joo, J.H., Jang, S.Y., Yu, J.H., Jeong, H.N., Hyeong, C.H. и др. (2013). Электрохимический синтез аммиака из воды и азота с использованием твердотельных ионных проводников . Sacramento: Ammonia Energy Association .
Zilouie, H., and Taherdanak, M. (2015). «Биоводород из лигноцеллюлозных отходов» в Технологии биотоплива и биопереработки .Редактор К. Карими (Швейцария: Springer), 253–288.
Google Scholar
Синтез аммиака: процесс и реакция — стенограмма видео и урока
Процесс Габера
Процесс Габера — это промышленный процесс, в котором для синтеза аммиака используются газообразный азот и газообразный водород. Уравнение, которое представляет процесс Габера, имеет следующий вид:
Получение водорода
Итак, как в процессе получить водород?
1.Электролиз воды
Как вы помните, при прохождении электрического тока через воду с использованием инертных электродов на катоде образуется водород, а на аноде — кислород.
2х3 О + Электроэнергия -> 2х3 + О2.
Следует отметить, что этот метод получения водорода для процесса Габера использовался для производства аммиака в 20 веке.
2. Реакция метана и пара
Со временем химики нашли сравнительно более дешевый и эффективный способ получения водорода.Метод включает использование источника метана, такого как природный газ, который реагирует с высокотемпературным паром при температуре от 700 ° C до 1000 ° C и под давлением 3-25 бар. Наряду с водородом образуется окись углерода и относительно небольшое количество углекислого газа.
Ch5 + h3 O + тепло -> CO + 3h3 (+ небольшое количество CO2)
Затем монооксид углерода и водяной пар вступают в реакцию с использованием никеля в качестве катализатора с образованием диоксида углерода и большего количества водорода.
CO + h3 O -> CO2 + h3
Наконец, диоксид углерода и другие примеси удаляются из газового потока с помощью метода, известного как адсорбция при переменном давлении.Это оставляет по существу чистый водород.
Получение азота
Хорошо, а как в процессе получить азот?
1. Фракционная перегонка жидкого воздуха
Азот можно получить путем фракционной перегонки воздуха вокруг нас. Воздух сжимается до 200 ° C. Следующие газы, углекислый газ и вода удаляются фильтрацией. Кислород и азот переходят в жидкое состояние при -183 ° C и -196 ° C соответственно. Эта сжиженная смесь, состоящая из кислорода и азота, затем разделяется фракционной перегонкой.Поскольку жидкий азот кипит при более низкой температуре, чем кислород, он поднимется вверх по фракционирующей колонне, в то время как жидкий кислород остается внизу. Однако этот метод получения азота слишком дорог.
2. Взаимодействие метана и воздуха
Напомним, что воздух состоит примерно на 78% из азота, а почти все остальное — кислород. Если мы сжигаем метан в воздухе, кислород вступает в реакцию с метаном с образованием углекислого газа и воды. Вы можете понять, что присутствующий в воздухе азот остается непрореагировавшим.Если удалить углекислый газ и воду, мы получим азот.
Теперь, когда получены азот и водород, их можно подвергнуть реакции с образованием аммиака. Затем эти газы сжимаются и доставляются в реактор, где одна молекула газообразного азота взаимодействует с тремя молекулами газообразного водорода над мелкодисперсным железом в качестве катализатора с образованием двух молекул аммиака.Катализатор — это вещество, которое ускоряет химическую реакцию, но не расходуется на нее.
Процесс Габера — это обратимая экзотермическая равновесная реакция. Любая экзотермическая реакция выделяет энергию в окружающую среду. При производстве каждой молекулы аммиака в процессе Габера выделяется 46 кДж тепловой энергии.
Необходимые условия
В процессе Хабера используется принцип Ле Шателье для максимального увеличения содержания аммиака при сохранении производственных и производственных затрат. Принцип Ле Шателье гласит, что если нарушается реакция при равновесии, положение равновесия смещается таким образом, чтобы противодействовать возмущению.
Давление
Принцип Ле Шателье гласит, что увеличение давления благоприятствует стороне с меньшим количеством молей. Поэтому имеет смысл проводить реакцию при очень высоком давлении, но мы также должны помнить, что строительство и эксплуатация установки, способной выдерживать такое высокое давление, обходятся дорого.Поэтому используется компромиссное давление около 150-200 атмосфер.
Температура
Теперь давайте рассмотрим оптимальную температуру, необходимую для процесса, чтобы максимизировать выход аммиака. Поскольку прямая реакция является экзотермической (помните, что на каждый моль произведенного аммиака выделяется 46 кДж тепла), было бы разумно проводить реакцию при низкой температуре. Однако компромиссная температура около 450-500 ° C гарантирует, что реакция протекает с достаточным выходом.Эта температура не является ни слишком низкой, ни слишком высокой. Если используется более низкая температура, скорость реакции будет низкой и потребуется много времени, чтобы реакция достигла равновесия.
Выход аммиака по процессу Габера при указанных условиях давления и температуры составляет около 15-20%. Любые неиспользованные азот и водород возвращаются обратно в реактор.
Краткое содержание урока
Аммиак получают в промышленных масштабах по процессу Хабера , химическому методу, в котором для синтеза аммиака используются газообразный азот и газообразный водород.Одна молекула газообразного азота реагирует с тремя молекулами газообразного водорода над мелкодисперсным железом в качестве катализатора с образованием двух молекул аммиака.
Газообразный азот можно получить из воздуха путем фракционной перегонки жидкого воздуха. В качестве альтернативы, если кислород, содержащийся в воздухе, вступает в реакцию с природным газом, можно выделить непрореагировавший азот. С другой стороны, водород можно получить либо путем электролиза воды, либо путем реакции природного газа с водяным паром.
И водород, и азот реагируют при температуре 450-500 ° C и давлении 150-200 атмосфер с образованием примерно 15-20% аммиака.
Синтез аммиака — обзор
11.1.2 Принципы синтеза аммиака: процесс Габера или Габера – Боша
Реакция синтеза аммиака представлена уравнением. 11.6, который устанавливает стехиометрию 2 моль (объемов) аммиака, полученного на каждые 4 моль (объема) реагирующих газов.
11,6N2 (г) + 3h3 (г) ⇌2Nh4 (г) ΔH = -92,0 кДж (-22,0 ккал)
Принцип Ле Шателье гласит, что когда изменение помещается в систему, находящуюся в равновесии, это смещается так чтобы уменьшить влияние изменения (количества, давления, температуры и т. д.). Таблица 11.2 показывает, что, согласно принципу Ле Шателье, увеличение давления в этой системе увеличивает равновесную концентрацию аммиака.
Таблица 11.2. Равновесные процентные концентрации аммиака при различных температурах и давлениях a
| Температура, ° C | Абсолютное давление (атм) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 10 | 50 | 300 600 | 1000 | |||||||
| 200 | 15.3 | 50,7 | 74,4 | 81,5 | 89,9 | 95,4 | 98,3 | ||||
| 300 | 2,2 | 14,7 | 39,4 | 9015 9015 9015 9015 902 9015 902 9015 9015 902 9015 9015 902 | 0,4 | 3,9 | 15,3 | 25,1 | 47,0 | 65,2 | 79,8 |
| 500 | — | 1,2 | 5,6 | 10.6 | 26,4 | 42,2 | 57,5 | ||||
| 600 | — | 0,5 | 2,3 | 4,5 | 13,8 | 23,1 | 31,4 | 23,1 | 31,4 | 2,2 | 7,3 | 11,5 | 12,9 |
Реакция синтеза аммиака также протекает быстрее при более высоких температурах — условия равновесия достигаются быстрее.В то же время реакция является экзотермической до степени 46 кДж моль -1 (около 54 кДж моль -1 при нормальных температурах превращения), так что при повышении температуры синтеза равновесие аммиака смещается в сторону слева, опять же в соответствии с принципом Ле Шателье (таблица 11.2). Таким образом, хотя повышение температуры синтеза действительно дает более высокую скорость реакции, позволяя получить больший объем продукции в реакторе того же размера; это также смещает равновесие синтеза (Ур.11.6) слева, что дает меньшую потенциальную конверсию азота в аммиак. К счастью, значительное увеличение давления в системе существенно улучшает равновесное преобразование в аммиак, что делает все упражнение практичным. По этим причинам условия, используемые в большинстве процессов синтеза аммиака, имеют тенденцию группироваться около 100–300 атм и 400–500 ° C в попытке максимизировать конверсию и степень конверсии при одновременном снижении затрат на сжатие. Процессы синтеза аммиака Claude и Casale с самым высоким давлением работают во Франции при 900 атм и в Италии при 750 атм соответственно.Это одни из самых сложных промышленных процессов. Процесс Клода основан на использовании просверленных никель-хромовых слитков с малым внутренним диаметром (10 см) для сдерживания огромного давления и, в свою очередь, обеспечивает конверсию в аммиак 40% или выше. Более обычные конвертеры имеют высоту от 7 до 10 м, внешний диаметр 3 м и используют стенки из легированной стали толщиной 20 см для сдерживания давления, чтобы обеспечить конверсию аммиака 10–20%.
Успешная конверсия аммиака потребовала открытия катализатора, который будет способствовать достаточно быстрой реакции при 100–300 атм и 400–500 ° C, чтобы использовать умеренно благоприятное равновесие, полученное в этих условиях.Без этого для получения достаточно высоких скоростей потребовались бы более высокие температуры, а менее благоприятное равновесие при более высоких температурах потребовало бы также более высоких давлений, чтобы получить экономичное превращение в аммиак. Первоначальные эксперименты по синтезу проводились с осмиевым катализатором. Позже Габер обнаружил, что восстановленный магнитный оксид железа (Fe 3 O 4 ) был намного более эффективным, и что его активность может быть дополнительно усилена за счет присутствия в качестве промоторов оксида алюминия (Al 2 O 3 ; 3% ) и оксида калия (K 2 O; 1%), вероятно, из-за введения дефектов решетки железа.Железо с различными патентованными вариациями до сих пор составляет основу всех каталитических систем на основе аммиака.
Еще одним показателем эффективности преобразования аммиака является «объемная скорость», которую можно использовать. Объемная скорость относится к объему реагентов, подаваемых в реактор в час, деленному на объем реактора. Для жидких реакционных потоков эта взаимосвязь очевидна. Для газов, однако, объемная скорость определяется как объем газов с поправкой на 0 ° C и 760 мм рт. Ст. (1 атм), проходящий через объем реактора (или катализатора) в час.Это составляет меру времени контакта газа с катализатором для гетерогенной реакции (уравнение 11.7).
11,7 пространственная скорость = объемная скорость подачи объем реактора пространственная скорость = м3 газа (ов) час − 1 м3 объем катализатора
Для катализатора на основе магнитного оксида железа с двойным промотированием, работающего с мольным соотношением азот: водород 1: 3 при давлении 100 атм и 450 ° C, и объемная скорость 5000 (час -1 ), можно было ожидать приблизительно 13-15% аммиака [10]. Гораздо более низкие конверсии получают из однократно промотированного или непромотированного железа.
Объемная скорость 5000 ч −1 (с поправкой на 0 ° C, 760 мм) соответствует скорости газообмена в пространстве катализатора 132,4 м 3 газа / кубический метр пространства катализатора / час при работе условий (450 ° C, 100 атм; уравнение 11.8), или фактическое время контакта газа с катализатором около 27 секунд. Увеличение объемной скорости одновременно уменьшает время контакта газа с катализатором и процент превращения азота и водорода в аммиак.
Соотношение пространственной скорости:
11.8 пространственная скорость 1 время контакта
Таким образом, объемная скорость 5000 часов −1 эквивалентна времени контакта 1 / (5000 часов −1 ), или 2 × 10 −4 часов, или 0,72 (2 × 10 -4 ч × 3600 с / ч) с время контакта, если газы находились при 0 ° C (273 K) и давлении 1 атм.
Тогда при постоянной объемной скорости
время контакта давление.
Таким образом, изменение давления только на 100 атмосфер увеличивает время контакта до 100 × 0,72 сек, или 72 сек.
время контакта также 1абсолютная температура
Таким образом, одновременное повышение температуры приводит к уменьшению фактического времени контакта до
72 сек × 1 (723K / 273K) = 22.19сек. 27,2сек. Контакт
Время, в условиях работы преобразователя.
Изменения газа в час при рабочих условиях конвертера, следовательно, будут:
(3600 сек / час) / (27,19 сек / изменение) = 132,4 изменения в час.
Удвоение объемной скорости конвертера может снизить процент превращения аммиака примерно до 10%, что может показаться изменением в неправильном направлении. Однако, если преобразовано 10% от удвоенного первоначального объема реагирующих газов, проходящих через конвертер, это все равно означает, что объем извлеченного аммиака примерно на треть больше или 1000 м3 3 / час NH 3 (10% 10 000 м 3 ), а не 750 м 3 / час NH 3 (15% от 5000 м 3 ), полученное при объемной скорости 5000 часов −1 .Следовательно, высокие объемные скорости 10 000–20 000 ч -1 или более являются обычными для коммерческих конвертеров аммиака.
По этой комбинации причин большинство крупных аммиачных заводов должны рециркулировать большую часть выходящих из конвертера газов в виде непрореагировавших азота и водорода. Таким образом, значительная часть проектирования современной установки синтеза аммиака связана с сохранением давления и тепла, чтобы этот рецикл проводился как можно более экономично.
Аммиак
Производство аммиака имеет решающее значение для мирового сельского хозяйства, так как из него производятся все удобрения, содержащие азот.
Использование аммиака
Производство удобрений, безусловно, является наиболее важным применением аммиака. К ним относятся мочевина, соли аммония (фосфаты аммония, нитрат аммония, нитрат аммония кальция) и растворы аммиака.
Рис. 1 Использование аммиака.
Увеличивающееся количество аммиака, хотя и небольшое по сравнению с другими применениями, используется в качестве концентрированного раствора для борьбы с выбросами оксидов азота из электростанций.
Годовое производство аммиака
Аммиак занимает второе место после серной кислоты как химическое вещество с наибольшим тоннажем. Его все чаще производят в странах с дешевыми источниками природного газа и угля (на Китай и Россию приходится или 40%). Крупнейшие заводы производят около 3000 тонн в день, и есть планы построить заводы, производящие 4000-5000 тонн в день, что означает, что общим мировым производством можно будет управлять с помощью 100 таких единиц. Текущее производство:
| Весь мир | 146 млн тонн |
| Китай | 48 млн тонн |
| Россия | 12 млн тонн |
| Индия | 11 млн тонн |
| U.С. | 9 млн тонн |
| Индонезия | 5 миллионов тонн |
| Тринидад и Тобаго | 5 миллионов тонн |
| Украина | 4 миллиона тонн |
Данные из:
Геологическая служба США, Сводные данные по минеральным товарам, 2016 г.
Увеличение тоннажа производимого аммиака идет в ногу с увеличением загрязнения мира и повышением уровня жизни в нем.Ожидается, что к 2018 году спрос на аммиак увеличится почти до 200 млн тонн 1 .
1. Международная ассоциация удобрений, 2014 г.
Производство аммиака
Производство аммиака из азота и водорода происходит в два основных этапа:
а) производство водорода
б) синтез аммиака (процесс Габера)
Производство водорода включает несколько различных процессов. На рисунке 2 показана их последовательность и расположение на заводе по производству аммиака (шаги 1–5).Также показан конвертер, используемый для получения аммиака из водорода (этап 6). Что происходит на каждом из этих шагов, описано ниже.
Рисунок 2 Завод по производству аммиака в Западной Австралии: 1 Установки десульфуризации |
(a) Производство водорода
Водород производится из разнообразного сырья, в основном из природного газа, угля или нафты. Способы получения водорода из этого сырья рассматриваются отдельно.
Водород из природного газа (метан)
Это включает в себя два этапа:
i) производство синтез-газа (смесь окиси углерода и водорода (паровой риформинг))
ii) удаление окиси углерода и получение смеси водорода и азота (реакция сдвига)
(i) Производство синтез-газа
Каким бы способом ни был получен метан, он будет содержать некоторые органические соединения серы и сероводород, оба из которых необходимо удалить.В противном случае они отравят катализатор, необходимый для производства синтез-газа. В установке обессеривания органические соединения серы часто сначала превращаются в сероводород до реакции с оксидом цинка. Сырье смешивают с водородом и пропускают через катализатор из смешанных оксидов кобальта и молибдена на инертном носителе (специально обработанный оксид алюминия) при температуре около 700 К.
Затем газы пропускают через оксид цинка при температуре около 700 K и удаляют сероводород:
Первичный риформинг с водяным паром превращает метан и водяной пар в синтез-газ, смесь монооксида углерода и водорода:
Высокие температуры и низкие давления способствуют образованию продуктов (принцип Ле Шателье).На практике реагенты пропускаются через никелевый катализатор, тонко разделенный на поверхности подложки из оксида кальция / оксида алюминия, содержащейся в вертикальных трубках из никелевого сплава. Трубки, до 350 параллельно включенных, нагреваются в печи выше 1000 К и под давлением 90–110–90–1–30 атм. Это пример трубчатого реактора.
Вторичный риформинг с водяным паром реагирует на кислород из воздуха с некоторым количеством присутствующего водорода, и полученная смесь пропускается через никелевый катализатор.Пар и тепло, образующиеся при сгорании, преобразовывают большую часть остаточного метана. Среди ключевых реакций:
Выходящий газ из этой чистой экзотермической стадии имеет температуру ~ 1200 К и охлаждается в теплообменниках. Пар, образующийся из воды, используемой для охлаждения газов, используется для работы турбин и, следовательно, компрессоров, а также для предварительного нагрева реагентов.
В некоторых последних разработках используется отходящее тепло от установки вторичного риформинга непосредственно для обеспечения теплом установки первичного риформинга.
На этой стадии газ содержит водород, азот, монооксид углерода и диоксид углерода и около 0,25% метана. Поскольку воздух содержит 1% аргона, он также накапливается в синтез-газе.
(ii) Реакция сдвига
В ходе этого процесса окись углерода преобразуется в двуокись углерода, при этом образуется больше водорода.
Проходит в два этапа. В первой реакции высокотемпературного сдвига газ смешивается с паром и пропускается над катализатором на основе оксида железа / хрома (III) при температуре ~ 700 К в реакторе с неподвижным слоем.Это снижает концентрацию окиси углерода с 11%:
На второй стадии, реакция низкотемпературного сдвига , смесь газов проходит над медно-цинковым катализатором при примерно 500 К. Концентрация монооксида углерода дополнительно снижается до 0,2%.
Реакция проводится в два этапа по нескольким причинам. Реакция экзотермическая. Однако при высокой температуре выходная концентрация окиси углерода все еще довольно высока из-за контроля равновесия.Медный катализатор, используемый на низкотемпературной стадии, очень чувствителен к высоким температурам и не может эффективно работать на высокотемпературной стадии. Таким образом, основная часть реакции проводится при высокой температуре для рекуперации большей части тепла. Затем газ удаляют при низкой температуре, где равновесие гораздо более благоприятно, на очень активном, но нестабильном медном катализаторе.
Газовая смесь теперь содержит около 18% диоксида углерода, который удаляют путем промывки газа раствором основания с использованием одного из нескольких доступных методов.Предпочтение отдается органическому основанию (в поглотителе углекислого газа ), раствору этаноламина, часто 2,2 ‘- (метилимино) бис-этанола (N-метилдиэтаноламин).
Диоксид углерода выделяется при нагревании раствора в стриппере диоксида углерода (). Большая часть его сжижается и продается, например, для газированных напитков, в качестве охлаждающей жидкости для атомных электростанций и для стимулирования роста растений в теплицах.
Последние следы оксидов углерода удаляются пропусканием газов через никелевый катализатор при 600 К:
Этот процесс известен как метанирование.Получается газ типичного состава: 74% водорода, 25% азота, 1% метана вместе с некоторым количеством аргона.
Водород из нафты
Если в качестве сырья используется нафта, необходима дополнительная стадия риформинга. Нафта нагревается с образованием пара, смешивается с паром и проходит по трубам, нагревается до 750 К и набивается катализатором, никелем, нанесенным на смесь оксидов алюминия и магния. Основным продуктом является метан вместе с оксидами углерода, который затем обрабатывается паровой конверсией, как если бы это был природный газ, с последующей реакцией сдвига.
Водород из угля
Если используется уголь, его сначала тонко измельчают и нагревают в атмосфере кислорода и пара. Часть угля очень быстро сгорает в кислороде (менее 0,1 с), вызывая повышение температуры в печи, а остальная часть угля вступает в реакцию с паром:
Выбрасываемый газ содержит около 55% окиси углерода, 30% водорода, 10% двуокиси углерода и небольшое количество метана и других углеводородов. Эту смесь обрабатывают реакцией сдвига.
Основные проблемы использования угля включают большие количества диоксида и триоксида серы, образующиеся при сжигании угля, а также значительное количество других примесей, таких как мышьяк и бром, которые очень вредны для атмосферы и все они являются сильными ядами для катализаторы в процессе. Также существует серьезная проблема с удалением золы.
Водород из биомассы
Синтез-газ можно производить из биомассы. Процесс изложен в разделе «Биоперерабатывающие заводы».
(b) Производство аммиака (процесс Габера)
В основе процесса лежит реакция между водородом и азотом в реакторе с неподвижным слоем. Газы в стехиометрических пропорциях нагреваются и пропускаются под давлением над катализатором (рис. 3).
Рис. 3 Схема, иллюстрирующая обычный реактор синтеза (конвертер).
Доля аммиака в равновесной смеси увеличивается с увеличением давления и падением температуры (принцип Ле Шателье).Количественные данные приведены в таблице 1. Для получения приемлемого выхода и благоприятной скорости используются высокие давления, умеренные температуры и катализатор.
| Давление / атм | Процентное содержание аммиака в состоянии равновесия в диапазоне температур | |||||
|---|---|---|---|---|---|---|
| 373 K | 473 K | 573 K | 673 K | 673 K | 673 K | К|
| 10 | – | 50.7 | 14,7 | 3,9 | 1,2 | 0,2 |
| 25 | 91,7 | 63,6 | 27,4 | 8,7 | 2,9 | – |
| 50 | 94,5 | 74,0 | 39,5 | 15,3 | 5,6 | 1,1 |
| 100 | 96.7 | 81,7 | 52,5 | 25,2 | 10,6 | 2,2 |
| 200 | 98,4 | 89,0 | 66,7 | 38,8 | 18,3 | – |
| 400 | 99,4 | 94,6 | 79,7 | 55,4 | 31,9 | – |
| 1000 | – | 98.3 | 92,6 | 79,8 | 57,5 | 12,9 |
Таблица 1 Объемное процентное содержание аммиака в равновесной смеси для реакции
между азотом и водородом при различных температурах и давлениях.
Используется широкий диапазон условий, в зависимости от конструкции реактора. Используемые температуры варьируются от 600 до 700 К, а давление от 100 до 200 атмосфер.Большая работа проводится для повышения эффективности катализатора, чтобы можно было использовать давление до 50 атмосфер.
Поскольку реакция является экзотермической, добавляются холодные реагенты (азот и водород) для снижения температуры реакторов (рис. 3).
Аммиак обычно хранится на месте (шаг 7) и перекачивается в другую часть завода, где он превращается в удобрение (мочевину или соль аммония). Однако иногда его транспортируют по морю (рис. 4) или по дороге для использования на другом заводе.
| Рис. 4 На заводе в Западной Австралии аммиак перекачивается по трубопроводу в ближайшую гавань (Рис. 2, этап 8) и транспортируется морским транспортом. В нем около 40 000 тонн сжиженного аммиака. С любезного разрешения Yara International ASA. |
Исходным катализатором, который использовал Хабер, был Fe 3 O 4 , который был восстановлен реагентом, водородом, до железа.Была проделана большая работа по улучшению катализатора, и было обнаружено, что небольшое количество гидроксида калия было эффективным в качестве промотора.
Недавние исследования были сосредоточены на поиске еще более эффективных катализаторов, которые позволили бы процессу протекать при более низких давлениях и температурах. Рутений на поверхности графита перспективен.
| Рисунок 5 Производство аммиака. |
Постскриптум
Процесс Габера настолько важен для нашей жизни, что за почти 90 лет он был удостоен трех Нобелевских премий по химии, присуждаемых немецким ученым, что является выдающимся рекордом.
Первый был передан в 1918 году Фрицу Габеру, химику, который разработал этот процесс в лаборатории. Второй — Карлу Бошу, блестящие инженерные навыки которого сделали этот процесс жизнеспособным в массовом масштабе, но который ждал своей награды до 1931 года.
В 2007 году Герхард Эртль был удостоен премии за свои работы по катализу газовых реакций на твердых телах. Среди широкого круга изученных им реакций он получил доказательства адсорбции молекул азота и молекул водорода на поверхности железа и того, что эти адсорбированные молекулы диссоциируют на атомы.Затем эти атомы поэтапно соединяются, образуя молекулу аммиака. Следует помнить, что условия, использованные в этих исследованиях (менее 10 -10 атм), сильно отличаются от условий, используемых в промышленности, около 150 атм.
Сводка
Весь процесс производства аммиака из метана представлен на Рисунке 5. Если уголь или нафта являются сырьем, необходимы дополнительные процессы. Нафта превращается в метан и оксиды углерода перед поступлением в установку первичного риформинга, а затем в реакцию конверсии.Уголь также превращается в водород и оксиды углерода, и эта смесь затем подвергается реакции сдвига.
Дата последнего изменения: 18 октября 2016 г.
Производство аммиака | Энциклопедия
Определение
Аммиак — вторая по величине химическая продукция в мире, используемая в качестве сельскохозяйственных удобрений, продуктов питания, промышленных материалов, хладагентов и добавок.В последнее время использование аммиака в качестве энергоносителя (вторичного источника энергии) привлекло много внимания из-за его высокой объемной плотности водорода, низкого давления хранения, высокой стабильности при длительном хранении, высокой температуры самовоспламенения, низкого давления конденсации, и более низкая плотность газа, чем у воздуха. В общем, производство аммиака включает в себя принятые в настоящее время термохимические (Габера – Боша), электрохимические и фотохимические циклические процессы.
1.Введение
В настоящее время во всем мире производится около 200 млн т аммиака в год [1] , что делает его вторым по величине производимым химическим веществом в мире после серной кислоты (H 2 SO 4 ). Подобно водороду, аммиак можно производить из различных источников первичной энергии, включая биомассу, уголь, природный газ, солнечную энергию, ветер, геотермальные, гидро- и ядерные источники. Аммиак можно производить с помощью различных технологий преобразования: термохимических, электрохимических, фотохимических и плазменных [2] .Однако, с учетом технологической осуществимости и общей энергоэффективности [3] [4] , в этой работе описаны три основные технологии преобразования (Габера – Боша, процессы электрохимического и термохимического цикла). Кроме того, описаны последние тенденции в разработке усовершенствованных систем для повышения общей энергоэффективности при производстве аммиака.
2. Производство обычного аммиака
В применяемом в настоящее время процессе производства аммиака в основном используется система, изобретенная Фрицем Хабером и Карлом Бошем около 100 лет назад [1] .Поэтому эта система хорошо известна как процесс Габера – Боша. Около 85% от общего объема производства аммиака во всем мире производится этим способом [5] . Синтез аммиака происходит по реакции (1).
3 H 2 + N 2 ⇋ 2 NH 3 ΔH ° 27 ° C = -46,35 кДж / моль (1)
Синтез аммиака — это экзотермическая реакция (отрицательное изменение энтальпии), происходящее самопроизвольно при низких температурах (отрицательное изменение энтропии).Хотя это предпочтительно при комнатной температуре, скорость реакции, при которой реакция происходит при комнатной температуре, слишком мала, чтобы ее можно было применять в промышленном масштабе. Для увеличения кинетики реакции для достижения заданной скорости превращения требуются высокое давление и температура. Для эффективного синтеза аммиака из его основных компонентов (водорода и азота) реакцию необходимо проводить при относительно высокой температуре и давлении 400–500 ° C и 10–30 МПа соответственно с помощью катализатора на основе железа.Это условие требуется из-за высокой энергии диссоциации (941 кДж / моль) азота с тройной связью. Однако, чтобы провести реакцию при такой высокой температуре и давлении, требуется около 30 МДж / кг-NH 3 энергии [6] .
Производство аммиака из природного газа осуществляется путем реакции метана (природного газа) с водяным паром и воздухом с последующим удалением воды и CO 2 . Продуктами этого процесса являются водород и азот, которые являются сырьем для основного синтеза аммиака.Во время процесса важно удаление серы и других примесей, поскольку они могут снизить и повредить характеристики катализатора во время синтеза. В процессе синтеза аммиака и азот, и водород сжимаются до относительно высокого давления для подачи в реактор синтеза, где катализатор погружается внутрь. Полученный аммиак вместе с непрореагировавшим водородом, аргоном и другими примесями затем охлаждается для конденсации аммиака, чтобы отделить аммиак от других газов.Непрореагировавшие водород и азот затем рециркулируют и смешивают с новым сырьем. Чтобы избежать скопления примесей, таких как аргон, небольшая часть газов удаляется из процесса. При синтезе аммиака выделяется небольшое количество тепла, которое выделяется из реактора; поэтому его можно регенерировать и использовать для других процессов, таких как производство пара и электроэнергии. Как правило, можно сохранить около 88% теплотворной способности водорода [7] .
Другой проблемой процесса Габера – Боша является его низкий коэффициент конверсии; следовательно, процесс должен быть переработан для достижения ожидаемой производительности.Однако при давлении 30 МПа степень конверсии реакции все еще низкая, не более 25% [8] . Эта рециркуляция потока вызывает некоторые проблемы, в том числе необходимость в дополнительной системе рециркуляции и реакторе большего размера, что приводит к высоким инвестиционным и эксплуатационным затратам.
Когда водород получают электролизом воды, азот можно подавать путем разделения воздуха. Разделение воздуха для производства азота может осуществляться с помощью мембранных, криогенных, абсорбционных и адсорбционных технологий [9] .Для больших масштабов криогенное разделение считается более экономичным, чем другие методы. Кроме того, криогенная сепарация воздуха может обеспечить высокую чистоту продуктов [10] .
Энергия, потребляемая при производстве аммиака, включая конверсию из первичных источников, обычно составляет от 28 до 37 ГДж / т [5] . Система производства аммиака из любого первичного источника, такого как природный газ, считается сложной, поскольку включает в себя множество комбинированных процессов. На рис. 1 показана принципиальная схема производства обычного аммиака из природного газа.Система состоит из различных процессов: паровой конверсии, реакции конверсии воды в газ, удаления CO 2 , очистки синтез-газа, а также синтеза и разделения аммиака. Следовательно, усилия по снижению общего энергопотребления требуют улучшения всего процесса. Из-за высокой энергоемкости производства аммиака при синтезе аммиака в год выделяется в общей сложности 289,8 Мт-CO 2 [11] , что составляет почти 0,93% мировых выбросов CO 2 [12] .
Рис. 2. Принципиальная схема производства аммиака из природного газа с использованием процесса Габера – Боша.
Ориентируясь на процесс Габера – Бош, были предприняты многие усилия по уменьшению его экстремальных условий. Они включают введение дополнительного компонента для подавления катализа и изменение геометрии и электронной природы реагирующих компонентов для оптимизации энергетики катализа [13] .Катализаторы на основе Ru могут в основном способствовать синтезу аммиака в мягких условиях (при температуре 300–450 ° C и давлении 4–15 МПа), что значительно ниже условий, требуемых для катализаторов на основе железа. Однако катализаторы на основе Ru дороги и страдают от отравления водородом [14] [15] . Оксиды и гидроксиды щелочноземельных металлов были определены как промоторы для улучшения каталитических характеристик катализаторов на основе Ru [16] . Некоторые электриды (кристаллы, в которых электроны служат анионами), такие как Ca 2 N: e — , которые могут осаждаться в наночастицах Ru, могут способствовать синтезу аммиака при 200 ° C [17] .Переходные металлы (TM) также могут улучшить характеристики синтеза, включая снижение давления и температуры. Это связано с существованием масштабных соотношений между энергией переходного состояния, необходимой для диссоциации азота, и энергией адсорбции всех промежуточных продуктов [18] [19] . Кроме того, Кавамура и Танигучи [20] испытали расплав натрия в качестве катализатора синтеза аммиака. Используя этот тип катализатора, синтез можно проводить при температурах реакции 500–590 ° C и атмосферном давлении.Однако требуются дальнейший анализ и эксперименты, чтобы довести этот метод до уровня применимости.
3. Электрохимическая обработка
Хотя электрохимическая обработка значительно недостаточно развита по сравнению с процессом Габера – Боша, ожидается, что она обеспечит более высокие энергетические характеристики. Энергия, потребляемая этим процессом, примерно на 20% ниже, чем в процессе Габера – Боша [21] . На рис. 2 представлена принципиальная схема электрохимического синтеза аммиака.Процесс считается простым; поэтому считается, что его применение потенциально снижает конфигурацию системы и сложность управления. Кроме того, инвестиционные затраты могут быть ниже по сравнению с применяемыми в настоящее время системами синтеза аммиака.
Рисунок 3. Принципиальная схема электрохимического синтеза аммиака.
Реакции как на катоде, так и на аноде в протонпроводящих ячейках показаны в реакциях (2) и (3) соответственно. Реакции на каждом катоде и аноде в основном обратимы.
N 2 + 6 H + + 6 e — ⇌ 2 NH 3 (2)
3 H 2 ⇌ 6 H + + 6 e — (3)
В настоящее время доступны четыре различных типа электролитов: (а) жидкие электролиты, (б) расплавленные соли, (в) композитные мембраны и (г) твердотельные электролиты. Жидкие электролиты могут работать при атмосферной температуре и давлении [22] . Есть несколько потенциальных жидких электролитов, в том числе LiClO 4 (0.2 M) в тетрагидрофуране [22] , LiClO 4 в ионной жидкости, LiClO 4 в H 2 SO 4 и в Li 2 SO 4 в H 2 SO 4 [23] . Производство аммиака составляет 3,68 × 10 -10 моль / см 2 · с, тогда как эффективность системы может достигать около 58%, что указывает на то, что около 58% тока, подаваемого в систему, преобразуется в аммиак. Однако исследования, связанные с этим вопросом, по-прежнему ограничиваются лабораторными экспериментами с небольшими размерами ячеек и ограниченным временем работы [2] .
Электролит типа расплава солей обычно работает в диапазоне температур 300–500 ° C [24] . Есть некоторые потенциальные химические вещества для использования в качестве электролитов, такие как LiCl, KCl и CsCl, с растворенным Li 3 N [25] . Сообщенная скорость производства аммиака составляет 3,3 × 10 -9 моль / см 2 · с, а эффективность составляет около 72%. Кроме того, система с композитными электролитами также включает твердые электролиты, которые сочетаются с легкоплавкой солью и имеют рабочую температуру 300–700 ° C.Электролиты содержат основную ионную проводящую фазу и дополнительную фазу, которая присоединена к основной фазе для улучшения электрических, механических и термических свойств [26] . Карбонат щелочного металла (такой как LiCO 3 ) и оксид (например, LiAlO 2 ) и CeO 2 , легированный Sm 2 O 3 , как представитель композитных электролитов, показали ожидаемые свойства, в том числе ионная кислородная, карбонатная и протонная проводимость [27] .Кроме того, Amar et al. [27] протестировали смешанные карбонаты Na, K и Li в дополнение к LiAlO 2 в качестве электролита. Они получили скорость производства аммиака 2,32 × 10 -10 моль / см 2 · с при температуре около 400 ° C. Система с твердыми электролитами обычно работает в очень широком диапазоне рабочих температур, от комнатной до примерно 800 ° C. В этот тип электролита могут входить разные материалы. К ним относятся перовскиты (такие как церат и цирконат) [28] , флюориты (такие как легированный диоксид циркония, церий и торий), пирохлоры (такие как цирконат лантана, легированный кальцием) и другие материалы (в том числе браунмиллерит, эулитит и монацит) [ 26] .К недостаткам этого типа электролитов относятся их структурная стабильность и высокая температура спекания (до 1700 ° C), необходимая для достижения высокой плотности. При использовании такого твердотельного электролита скорость производства аммиака 3,1 × 10 −9 моль / см 2 · с может быть достигнута при температуре 570 ° C с эффективностью около 75% [27 ] [29] .
4. Термохимический цикл производства аммиака
В качестве альтернативного процесса производства аммиака был разработан процесс, использующий термохимический цикл [30] .Система состоит из двух циркулирующих процессов: восстановления (активация азота) и парогидролиза (образование аммиака). Обе реакции резюмируются следующим образом:
Al 2 O 3 + 3C + N 2 → 2 AlN + 3 CO ΔH ° 25 ° C = 708,1 кДж / моль (4)
2AlN + 3 H 2 O → Al 2 O 3 + 2 NH 3 ΔH ° 25 ° C = −274,1 кДж / моль (5)
На рисунке 3 представлена принципиальная схема термохимического цикла производства аммиака.Первичные источники энергии предварительно обрабатываются и превращаются в углерод перед подачей в процесс термохимического цикла. В первом процессе восстановления (реакция (4)) AlN получают карботермическим восстановлением Al 2 O 3 и азота. Эта реакция эндотермическая и протекает при температуре около 1500 ° C. Кроме того, во второй реакции, которая представляет собой гидролиз паром (реакция (5)), AlN, полученный в первом процессе восстановления, реагирует с паром (H 2 O) с образованием Al 2 O 3 .Полученный в этой второй реакции Al 2 O 3 затем направляют в первый процесс восстановления. Детальная кинетика реакции подробно проанализирована в [31] .
Рисунок 4. Принципиальная схема термохимического цикла производства аммиака.
В отличие от процесса Габера – Боша, этот термохимический цикл можно проводить при атмосферном давлении и без катализатора. Процесс позволяет независимо контролировать реакцию активации азота (реакция (4)) и образования аммиака (реакция (5)).Кроме того, как можно было наблюдать из реакции (4), система может производить аммиак непосредственно из карбонизированного материала вместо чистого водорода. Следовательно, ожидается, что эта система сможет снизить потребление энергии при производстве аммиака. Однако самая большая проблема этой системы связана с ее очень высокой рабочей температурой, что приводит к ограниченным источникам тепла и материалам. Были предложены различные идеи для теплоснабжения, включая использование концентрированного солнечного тепла.
Хуангса и Азиз [32] разработали интегрированную систему, состоящую из производства азота, производства аммиака с использованием термохимического цикла и выработки электроэнергии. В их системе тепло, необходимое для восстановления, в основном покрывается теплом, выделяемым при сгорании топливных газов, образующихся при производстве аммиака. Система может достичь высокого общего теоретического КПД энергии около 69%. Кроме того, они также заявили, что температура окисления играет важную роль в работе системы.
1,4. Современные системы производства аммиака
В связи с растущим беспокойством, связанным с экономическим и экологическим воздействием, усилия по предложению и развитию усовершенствованной системы производства аммиака были предприняты интенсивно. К ним относятся как термохимические, так и электрохимические процессы.
Cinti et al. [33] предложили комбинированную систему, которая состоит из твердооксидного электролизера, производства азота с адсорбцией при переменном давлении и процесса Габера-Боша.Более того, та же группа [11] также разработала интегрированную систему, охватывающую паровой риформинг метана и процесс Габера – Боша. В основном они сосредоточились на системной интеграции и рекуперации тепла для повышения общей энергоэффективности. Кроме того, Азиз и др. [34] предложили интегрированную систему преобразования водорода в аммиак с относительно высокой общей энергоэффективностью. Их система включает криогенное разделение азота с одним реактором дистилляции, процесс Габера – Боша и производство электроэнергии.Вырабатываемое при синтезе аммиака тепло, а также продуванный газ (содержащий небольшое количество водорода и аммиака) рекуперируются и используются для выработки электроэнергии. Кроме того, они использовали как регенерацию эксергии, так и интеграцию процессов для достижения высокой энергоэффективности [35] .
Разработаны другие интегрированные системы для производства аммиака из различных видов первичных источников энергии. Нурдиавати и др. [36] предложили производство аммиака на основе водорослей путем интеграции сушки водорослей, газификации, химического цикла, синтеза аммиака (процесс Габера – Боша) и выработки электроэнергии.В их системе процесс отделения азота отсутствует из-за использования богатого азотом дымового газа из химического контура. Их система способна эффективно преобразовывать водоросли в аммиак с общей энергоэффективностью около 64%, включая эффективность производства аммиака 63%. Другая система была также разработана той же группой [37] , с основным отличием в гидротермальной газификации и производстве азота. Другая комбинированная система для преобразования сельскохозяйственных отходов от завода по производству пальмового масла также была предложена и оценена Ajiwibowo et al. [38] . В их системе сверхкритическая водная газификация смешанных пустых фруктовых гроздей и сточных вод с завода по производству пальмового масла сочетается с химическим циклическим замкнутым циклом синтез-газа и синтезом аммиака на основе Габера – Боша.
Эта запись адаптирована из 10.3390 / en13123062
.


 Вам нужно, чтобы газы достигли равновесия за очень короткое время, в течение которого они будут контактировать с катализатором в реакторе.
Вам нужно, чтобы газы достигли равновесия за очень короткое время, в течение которого они будут контактировать с катализатором в реакторе. Чем выше давление, тем лучше скорость газовой реакции.
Чем выше давление, тем лучше скорость газовой реакции. Его единственная функция — ускорить реакцию.
Его единственная функция — ускорить реакцию.