Как получают аммиак в промышленности и где используется, какой класс опасности. Читайте в блоге «ТАНТАЛ-Д»
Автор статьи Лебедев Юрий Агафонович
Дата публикации:
01.02.2022
Дата обновления:
18.01.2023
Заместитель директора
Работает в отрасли c 1999 г.
Вещество, распространенное в большей мере в форме резко пахнущего бесцветного газа, и представляющее собой нитрид водорода, широко известно как аммиак. Сферы его применения разнообразны. Химическое соединение используют для изготовления удобрений с азотом, соды, взрывчатых веществ, полимерных составов и иных промышленных продуктов. В жидкой форме вещество применяют как растворитель, в твердой оно представляет собой кубические кристаллы. В его составе один атом азота и три — водорода.
Синтетический аммиак незаменим в производстве азотных удобрений.
Вячеслав Жвирблис
Содержание статьи
- Производство
- Области применения аммиака
- в производстве
- в холодильных установках
- в медицине
- Какая формула у аммиака
- Свойства NH₃
- Воздействие аммиака на физиологию
- Некоторые факты об аммиаке
Длительное воздействие аммиачного газа представляет опасность для человека, потому что вызывает отек легких и угнетение нервной системы. Опасность повышает отсутствие запаха у вещества.
Опасность повышает отсутствие запаха у вещества.
Из этой статьи вы подробнее узнаете о том, где используют аммиак, как его получают в промышленности, как выглядит химическая формула, где используется в медицине, в производстве, к какому классу опасности относится аммиак.
Производство
Ежегодно в мире химические предприятия выпускают порядка 180 миллионов тонн аммиака. Как образуется аммиак? В результате непосредственного соединения водорода и азота, при протекании химической реакции с выделением тепла:
N2 + 3NH3 + 91,84 кДж
Наибольший выход аммиака 30% достигается при температуре 500°C и давлении в 350 атмосфер, притом для протекания реакции используют катализатор — пористое железо с оксидом калия. Из чего делают аммиак на производстве, на заводе? Его синтезируют из азота и водорода при высокой температуре. К молекуле двухатомного азота добавляют три двухатомные молекулы водорода.
К какому классу веществ относится аммиак
Согласно классификации ГОСТ 12. 1.007, данное вещество относится к малоопасным веществам и принадлежит к четвертому классу опасности.
1.007, данное вещество относится к малоопасным веществам и принадлежит к четвертому классу опасности.
Оно хорошо растворяется в воде. В жидкой форме оно почти не проводит ток и сильно преломляет свет. Его запах ощутим, если концентрация аммиачных паров достигает 37 мг/м³.
Области применения аммиака
В производствеИз аммиака изготавливают азотсодержащие удобрения, полимеры, соду. Его используют как противоморозный компонент строительной смеси, а также для придания аромата цветам без запаха или для изменения их окраски.
В холодильных установкахГде еще используется аммиак? В системах охлаждения. Он служит хладагентом. В том числе с его помощью охлаждают каналы энергоснабжения МКС.
В медицинеИспользуется для нанесения на поверхность кожи, ингаляций и приема внутрь, для приведения в сознание человека при обмороке. Аммиак применяют при укусах насекомых, невралгии, для повышения давления, для очищения поверхностей, в том числе рук хирурга.
Какая формула у аммиака
Формула вещества — NH3. Его молекула представляет собой пирамиду, где в основании атомы водорода, а наверху — атом азота.
Свойства NH₃
Аммиак — комплексообразователь. Его раствор, известный как нашатырь, обладает слабощелочной реакцией. При взаимодействии с кислотами, производит соли аммония. Вещество также слабая кислота. Взаимодействуя с металлами, оно образует соли.
Аммиачные растворы амидов — проводники тока. Нагреваясь, аммиак разлагается. Вещество горит в атмосфере кислорода, продукты горения — вода и азот. Хлор и йод под воздействием аммиака формируют взрывчатые вещества. При температуре 1000°C NH3 реагирует с углем, в результате образуется синильная кислота. Аммиак реагирует и с метаном, продукт реакции тот же.
Воздействие аммиака на физиологию
Для живого организма аммиак опасен своей токсичностью. Он действует удушающе, оказывает нейротропный эффект. При ингаляционном воздействии может провоцировать отек легких, угнетать нервную систему. У вещества местное и резорбтивное действие.
У вещества местное и резорбтивное действие.
Воздействие паров NH3 приводит к раздражению слизистой и кожи. Такое раздражение воспринимается рецепторами как резкий запах, проявляется слезотечением, потерей зрения вследствие химического ожога, кашлем, зудом. Если сжиженный аммиак касается кожи, ее обжигает, на ней могут появиться пузыри. Испаряясь, он поглощает тепло, а касаясь кожного покрова при испарении, вызывает обморожение.
На производстве допустима максимальная концентрация аммиака в воздушной массе 20 мг/м³. Предельная среднесуточная концентрация вещества в помещении — 0,04 мг/м³. Допустима разовая концентрация аммиака в воздухе — 0,2 мг/м³. Если нормы превышаются, то в воздухе ощущается запах аммиака.
Когда в воздухе содержится 280 мг/м³, то раздражается зев, 490 мг/м³ — глаза, от 7 г/м³ — кожный покров. Легкие отекают, если аммиак в концентрации 1,5 г/м³ воздействует на человека в течение часа. Если кратковременно воздействовать аммиаком с содержанием в воздухе от 3,5 г/м³, то неизбежны общетоксические поражения.
Хотите получить консультацию?
Позвоните нам по телефону!+7 (495) 532 17 17 Пн.-Пт. с 9:00 до 18:00, обед с 13:00 до 14.00, Сб. с 9.00 до 15:00
Некоторые факты об аммиаке
- Пары нашатырного спирта (раствора аммиака в воде) могут менять окраску цветов. Лепестки синих оттенков они делают зелеными, насыщенно-красные — чернят.
- Аммиак наполняет облака над Юпитером.
- Не пахнущие в естественной среде цветы после воздействия на них аммиаком источают приятный аромат. К таким цветам относятся астры.
- Нашатырь, взаимодействуя с йодом, образует йодистый азот в виде кристаллов, таким образом проводят химические опыты с наглядными результатами.
Источники:
- https://ru.wikipedia.org/wiki/Аммиак
- Общая и неорганическая химия. Н. С. Ахметов
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ
Как образуется аммиак?
При соединении водорода и азота.
Аммиак — это опасное вещество?
По классификации ГОСТ 12. 1.007 это вещество признается малоопасным.
1.007 это вещество признается малоопасным.
Где применяют аммиак?
Для производства удобрений, полимеров, соды, в холодильных установках, медицине и других сферах.
Как аммиак действует на человека?
Пары аммиака раздражают слизистую и кожу, возможен химический ожог. При длительном вдыхании провоцируют отек легких и удушье.
Если вам понравилась статья, поделитесь ей в социальных сетях
Производство аммиака в ЕГЭ по химии
Тема кодификатора ЕГЭ по химии: Общие научные принципы химического производства на примере промышленного получения аммиака, серной кислоты, метанола.
В этой статье мы рассмотрим принципы химического производства на примере получения аммиака в объеме, достаточном для решения заданий по этой теме в ЕГЭ по химии.
В промышленности аммиак получают по методу Габера – прямым взаимодействием азота и водорода в реакционной колонне:
N2 + 3Н2 ⇄ 2NH3
Реакция азота с водородом обратимая, экзотермическая, гомогенная (газофазная). Для увеличения выхода аммиака необходимо смещать равновесие в сторону продукта. Согласно принципу Ле-Шателье, для смещения равновесия вправо в данной реакции необходимо повышать давление и понижать температуру. Однако низкая температура уменьшит скорость реакции.
Для увеличения выхода аммиака необходимо смещать равновесие в сторону продукта. Согласно принципу Ле-Шателье, для смещения равновесия вправо в данной реакции необходимо повышать давление и понижать температуру. Однако низкая температура уменьшит скорость реакции.
Поэтому для повышения скорости реакции температура в процессе поддерживается все-таки высокой, 500-550оС и в присутствии катализатора.
А для смещения равновесия применяют очень высокие давления 15-30 МПа.
В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Рассмотрим процессы, протекающие на разных участках производства аммиака:
1 этап. Трубопровод. В трубопровод подается предварительно подготовленная азотно-водородная смесь (N2:Н2=1:3) в соотношении 1 к 3.
Трубопровод. В трубопровод подается предварительно подготовленная азотно-водородная смесь (N2:Н2=1:3) в соотношении 1 к 3.
2 этап. Турбокомпрессор. Турбокомпрессор используется для сжатия исходной смеси газов с целью повышения давления. Синтез аммиака проводится при очень высоком давлении (15-30 МПа, или 150-300 атм).
3 этап. Колонна синтеза. В колонне синтеза (контактном аппарате) производится синтез аммиака. Азотно-водородная смесь продавливается через полки с катализатором. Процесс синтеза протекает обратимо (т.е. частично) и является сильно экзотермическим, протекает с большим выделением тепла. Часть выделяющегося тепла расходуется на нагревание поступающей азотоводородной смеси с помощью теплообменников. Смесь, выходящая из колонны синтеза в холодильник, состоит из аммиака (20-30%) и не прорегировавших азота и водорода.
4 этап. Холодильник. В холодильнике реакционная смесь, которая выходит из колонны синтеза, охлаждается и направляется на дальнейшее разделение в сепаратор.
В холодильнике реакционная смесь, которая выходит из колонны синтеза, охлаждается и направляется на дальнейшее разделение в сепаратор.
5 этап. Сепаратор. После прохождения холодильника температура реакционной смеси значительно снижается, и аммиак переходит в жидкую фазу. В сепараторе происходит разделение реакционной смеси, жидкий аммиак отделяют от азота и водорода и отправляют на склад.
6 этап. Циркуляционный насос. Циркуляционный насос возвращает не прореагировавшую смесь азота и водорода в контактный аппарат. Благодаря циркуляции удаѐтся довести использование азотводородной смеси (конверсию) до 95%.
Понравилось это:
Нравится Загрузка…
Производство аммиака | Энциклопедия MDPI
Аммиак является вторым по величине химическим продуктом в мире, используемым в качестве сельскохозяйственного удобрения, производства продуктов питания, промышленных материалов, хладагентов и добавок.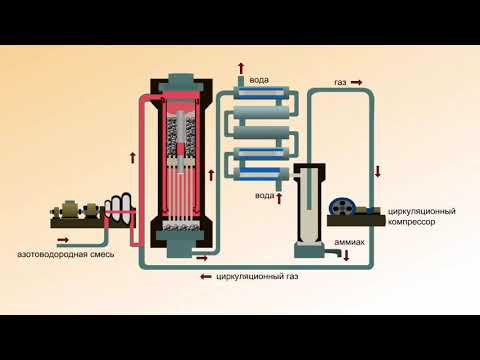 В последнее время использование аммиака в качестве энергоносителя (вторичного источника энергии) вызвало большой интерес благодаря его высокой объемной плотности водорода, низкому давлению при хранении, высокой стабильности при длительном хранении, высокой температуре самовоспламенения, низкому давлению конденсации, и плотность газа ниже, чем у воздуха. в целом производство аммиака включает принятые в настоящее время процессы термохимического (Габера-Боша), электрохимического и фотохимического циклов.
В последнее время использование аммиака в качестве энергоносителя (вторичного источника энергии) вызвало большой интерес благодаря его высокой объемной плотности водорода, низкому давлению при хранении, высокой стабильности при длительном хранении, высокой температуре самовоспламенения, низкому давлению конденсации, и плотность газа ниже, чем у воздуха. в целом производство аммиака включает принятые в настоящее время процессы термохимического (Габера-Боша), электрохимического и фотохимического циклов.
1. Введение
В настоящее время во всем мире производится около 200 млн тонн аммиака в год [1] , что делает его вторым наиболее часто производимым химическим веществом в мире после серной кислоты (H 2 SO 4 ). Подобно водороду, аммиак можно производить из различных первичных источников энергии, включая биомассу, уголь, природный газ, солнечные, ветровые, геотермальные, гидро- и ядерные источники. Аммиак может быть получен с помощью различных технологий конверсии: термохимической, электрохимической, фотохимической и плазменной [2] . Однако с учетом технологической осуществимости и суммарной энергоэффективности [3] [4] , в данной работе описаны три основные конверсионные технологии (процессы Габера-Боша, электрохимический и термохимический цикл). Кроме того, также описаны последние тенденции в разработке усовершенствованных систем для повышения общей энергоэффективности при производстве аммиака.
Однако с учетом технологической осуществимости и суммарной энергоэффективности [3] [4] , в данной работе описаны три основные конверсионные технологии (процессы Габера-Боша, электрохимический и термохимический цикл). Кроме того, также описаны последние тенденции в разработке усовершенствованных систем для повышения общей энергоэффективности при производстве аммиака.
2. Традиционное производство аммиака
Принятый в настоящее время процесс производства аммиака в основном использует систему, изобретенную Фрицем Габером и Карлом Бошем около 100 лет назад [1] . Поэтому эта система хорошо известна как процесс Габера-Боша. Около 85% всего производства аммиака в мире производится с помощью этого процесса [5] . Синтез аммиака происходит по реакции (1).
Синтез аммиака является экзотермической реакцией (отрицательное изменение энтальпии) и происходит самопроизвольно при низких температурах (отрицательное изменение энтропии). Хотя это предпочтительнее при комнатной температуре, скорость реакции, при которой реакция происходит при комнатной температуре, слишком мала, чтобы ее можно было использовать в промышленном масштабе. Чтобы увеличить кинетику реакции для достижения целевой скорости превращения, необходимы высокие давление и температура. Для эффективного синтеза аммиака из его основных компонентов (водорода и азота) реакцию необходимо проводить при относительно высоких температуре и давлении 400–500 °С и 10–30 МПа соответственно с участием катализатора на основе железа. Это условие востребовано из-за высокой энергии диссоциации (941 кДж/моль) азота с тройной связью. Однако, чтобы провести реакцию при такой высокой температуре и давлении, требуется около 30 МДж/кг-NH 3 энергии [6] .
Хотя это предпочтительнее при комнатной температуре, скорость реакции, при которой реакция происходит при комнатной температуре, слишком мала, чтобы ее можно было использовать в промышленном масштабе. Чтобы увеличить кинетику реакции для достижения целевой скорости превращения, необходимы высокие давление и температура. Для эффективного синтеза аммиака из его основных компонентов (водорода и азота) реакцию необходимо проводить при относительно высоких температуре и давлении 400–500 °С и 10–30 МПа соответственно с участием катализатора на основе железа. Это условие востребовано из-за высокой энергии диссоциации (941 кДж/моль) азота с тройной связью. Однако, чтобы провести реакцию при такой высокой температуре и давлении, требуется около 30 МДж/кг-NH 3 энергии [6] .
Производство аммиака из природного газа осуществляется путем взаимодействия метана (природного газа) с паром и воздухом с последующим удалением воды и СО 2 . Продуктами этого процесса являются водород и азот, являющиеся сырьем для основного синтеза аммиака. Во время процесса важно удаление серы и других примесей, поскольку они могут снизить и повредить работу катализатора во время синтеза. В процессе синтеза аммиака и азот, и водород сжимаются до относительно высокого давления для подачи в реактор синтеза, в который погружен катализатор. Полученный аммиак вместе с непрореагировавшим водородом, аргоном и другими примесями затем охлаждают для конденсации аммиака, чтобы отделить аммиак от других газов. Затем непрореагировавшие водород и азот возвращаются обратно и смешиваются с новым сырьем. Чтобы избежать накопления примесей, таких как аргон, небольшая часть газов удаляется из процесса. Синтез аммиака дает небольшое количество тепла, которое выделяется из реактора; поэтому его можно извлекать и использовать для других процессов, таких как производство пара и электроэнергии. В целом можно сохранить около 88% теплотворной способности водорода [7] .
Во время процесса важно удаление серы и других примесей, поскольку они могут снизить и повредить работу катализатора во время синтеза. В процессе синтеза аммиака и азот, и водород сжимаются до относительно высокого давления для подачи в реактор синтеза, в который погружен катализатор. Полученный аммиак вместе с непрореагировавшим водородом, аргоном и другими примесями затем охлаждают для конденсации аммиака, чтобы отделить аммиак от других газов. Затем непрореагировавшие водород и азот возвращаются обратно и смешиваются с новым сырьем. Чтобы избежать накопления примесей, таких как аргон, небольшая часть газов удаляется из процесса. Синтез аммиака дает небольшое количество тепла, которое выделяется из реактора; поэтому его можно извлекать и использовать для других процессов, таких как производство пара и электроэнергии. В целом можно сохранить около 88% теплотворной способности водорода [7] .
Еще одной проблемой процесса Габера-Боша является его низкая скорость преобразования; следовательно, процесс должен быть рециркулирован для достижения ожидаемой производительности.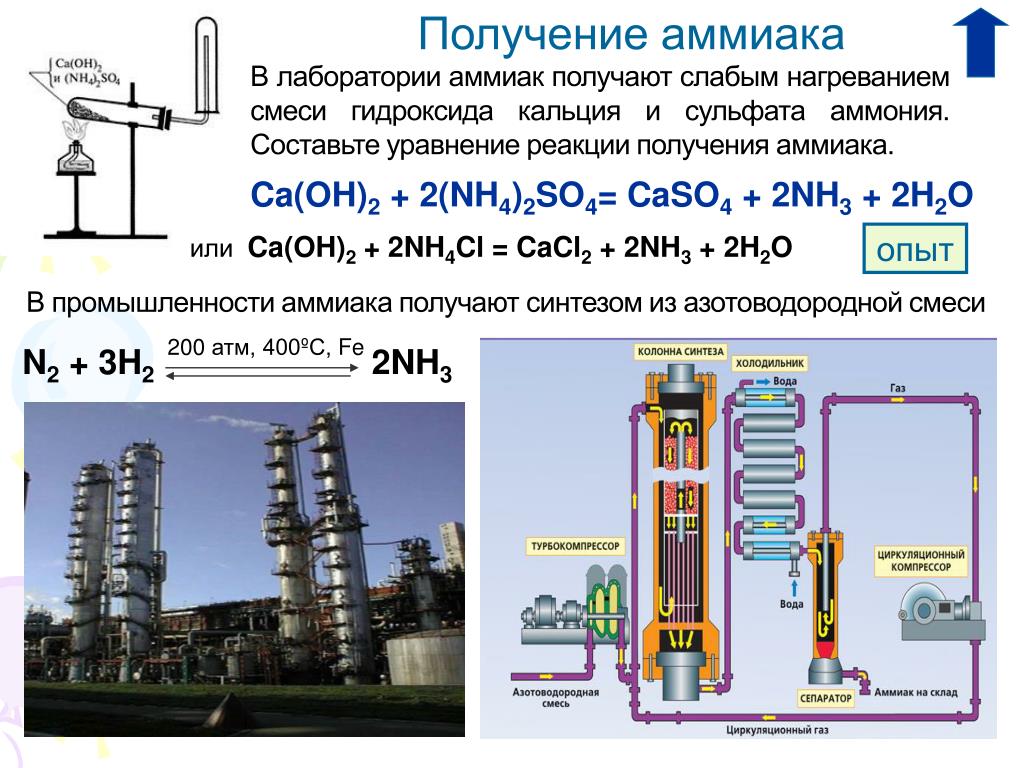 Однако при давлении 30 МПа конверсия из реакции еще низкая, не более 25% [8] . Эта рециркуляция потока вызывает некоторые проблемы, в том числе необходимость в дополнительной системе рециркуляции и реакторе большего размера, что приводит к высоким капиталовложениям и эксплуатационным затратам.
Однако при давлении 30 МПа конверсия из реакции еще низкая, не более 25% [8] . Эта рециркуляция потока вызывает некоторые проблемы, в том числе необходимость в дополнительной системе рециркуляции и реакторе большего размера, что приводит к высоким капиталовложениям и эксплуатационным затратам.
Когда водород производится электролизом воды, азот может быть получен путем разделения воздуха. Разделение воздуха для производства азота может осуществляться с помощью мембранных, криогенных, абсорбционных и адсорбционных технологий [9] . Для больших масштабов криогенное разделение считается более экономичным, чем другие методы. Кроме того, криогенное разделение воздуха может производить продукты высокой чистоты [10] .
Энергия, потребляемая при производстве аммиака, включая конверсию из первичных источников, обычно составляет от 28 до 37 ГДж/т [5] . Система производства аммиака из любого первичного источника, такого как природный газ, считается сложной, так как включает множество комбинированных процессов. На рис. 1 показана принципиальная схема традиционного производства аммиака из природного газа. Система состоит из различных процессов: парового риформинга, реакции конверсии вода-газ, удаления CO 2 , очистки синтез-газа, синтеза и разделения аммиака. Следовательно, усилия по снижению общего энергопотребления требуют улучшения всего задействованного процесса. Из-за высокой энергоемкости производства аммиака при синтезе аммиака выделяется 289,8 млн т CO 2 ежегодно [11] , что составляет почти 0,93% мировых выбросов CO 2 [12] .
На рис. 1 показана принципиальная схема традиционного производства аммиака из природного газа. Система состоит из различных процессов: парового риформинга, реакции конверсии вода-газ, удаления CO 2 , очистки синтез-газа, синтеза и разделения аммиака. Следовательно, усилия по снижению общего энергопотребления требуют улучшения всего задействованного процесса. Из-за высокой энергоемкости производства аммиака при синтезе аммиака выделяется 289,8 млн т CO 2 ежегодно [11] , что составляет почти 0,93% мировых выбросов CO 2 [12] .
Рис. 1. Принципиальная схема производства аммиака из природного газа с использованием процесса Габера-Боша.
Сосредоточив внимание на процессе Габера-Боша, было предпринято много усилий по уменьшению его экстремальных условий. Они включают введение дополнительного компонента для ингибирования катализа и изменение геометрии и электронной природы реагирующих компонентов для оптимизации энергетики катализа [13] .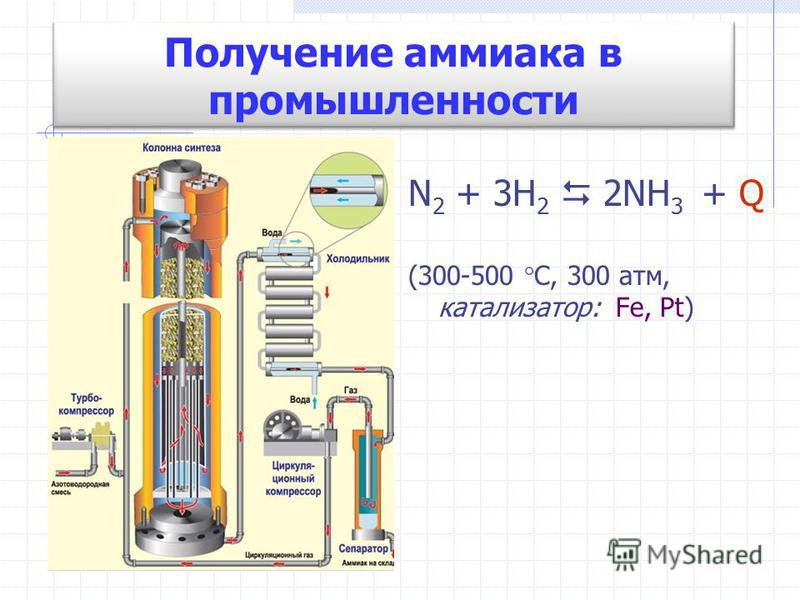 Катализаторы на основе Ru в принципе могут способствовать синтезу аммиака в мягких условиях (при температуре 300–450 °С и давлении 4–15 МПа), что значительно ниже условий, необходимых для катализаторов на основе железа. Однако катализаторы на основе Ru дороги и подвержены отравлению водородом [14] [15] . Оксиды и гидроксиды щелочноземельных металлов были идентифицированы как промоторы для улучшения каталитических характеристик катализаторов на основе Ru [16] . Некоторые электриды (кристаллы, в которых электроны служат анионами), такие как Ca 2 N:e − , которые могут быть нанесены на наночастицы Ru, могут способствовать синтезу аммиака при 200 ° C [17] . Переходные металлы (ТМ) также могут улучшить эффективность синтеза, включая снижение давления и температуры. Это связано с наличием скейлинговых соотношений между энергией переходного состояния, необходимой для диссоциации азота, и энергией адсорбции всех интермедиатов [18] [19] .
Катализаторы на основе Ru в принципе могут способствовать синтезу аммиака в мягких условиях (при температуре 300–450 °С и давлении 4–15 МПа), что значительно ниже условий, необходимых для катализаторов на основе железа. Однако катализаторы на основе Ru дороги и подвержены отравлению водородом [14] [15] . Оксиды и гидроксиды щелочноземельных металлов были идентифицированы как промоторы для улучшения каталитических характеристик катализаторов на основе Ru [16] . Некоторые электриды (кристаллы, в которых электроны служат анионами), такие как Ca 2 N:e − , которые могут быть нанесены на наночастицы Ru, могут способствовать синтезу аммиака при 200 ° C [17] . Переходные металлы (ТМ) также могут улучшить эффективность синтеза, включая снижение давления и температуры. Это связано с наличием скейлинговых соотношений между энергией переходного состояния, необходимой для диссоциации азота, и энергией адсорбции всех интермедиатов [18] [19] . Кроме того, Kawamura и Taniguchi [20] испытали расплав натрия в качестве катализатора синтеза аммиака. С использованием этого типа катализатора синтез можно проводить при температурах реакции 500–590 °С и атмосферном давлении. Однако необходимы дальнейшие анализы и эксперименты, чтобы довести этот метод до уровня применимости.
Кроме того, Kawamura и Taniguchi [20] испытали расплав натрия в качестве катализатора синтеза аммиака. С использованием этого типа катализатора синтез можно проводить при температурах реакции 500–590 °С и атмосферном давлении. Однако необходимы дальнейшие анализы и эксперименты, чтобы довести этот метод до уровня применимости.
3. Электрохимическая обработка
Несмотря на то, что электрохимическая обработка значительно менее развита по сравнению с процессом Габера-Боша, ожидается, что она обеспечит более высокие энергетические характеристики. Энергия, потребляемая этим процессом, примерно на 20% ниже, чем в процессе Габера-Боша [21] . На рис. 2 показана блок-схема электрохимического синтеза аммиака. Процесс считается простым; поэтому считается, что его применение потенциально снижает сложность конфигурации системы и управления. Кроме того, инвестиционные затраты могут быть ниже по сравнению с принятыми в настоящее время системами синтеза аммиака.
Рис. 2. Принципиальная схема электрохимического синтеза аммиака.
Реакции как на катоде, так и на аноде в ячейках с протонной проводимостью показаны в реакциях (2) и (3) соответственно. Реакции на каждом катоде и аноде в основном обратимы.
В настоящее время доступны четыре различных типа электролитов: (a) жидкие электролиты, (b) расплавленные соли, (c) композитные мембраны и (d) твердотельные электролиты. Жидкие электролиты могут работать при атмосферных температуре и давлении [22] . Есть несколько потенциальных жидких электролитов, включая LiClO 4 (0,2 М) в тетрагидрофуране [22] , LiClO 4 в ионной жидкости, LiClO 4 в H 2 SO 40 и 9 Li0.2 SO 4 в H 2 SO 4 [23] . Производство аммиака составляет 3,68 × 10 −10 моль/см 2 ·с, а эффективность системы может достигать примерно 58 %, что указывает на то, что около 58 % тока, подаваемого в систему, преобразуется в аммиак. Однако исследования, связанные с этим вопросом, по-прежнему ограничены лабораторными экспериментами, при малых размерах ячеек и ограниченном времени работы [2] .
Однако исследования, связанные с этим вопросом, по-прежнему ограничены лабораторными экспериментами, при малых размерах ячеек и ограниченном времени работы [2] .
Электролит на основе расплавленной соли обычно работает в диапазоне температур 300–500 °C [24] . Есть некоторые потенциальные химические вещества для использования в качестве электролитов, такие как LiCl, KCl и CsCl с растворенным Li 3 N [25] . Заявленная производительность по аммиаку составляет 3,3 × 10 -9 моль/см 2 ·с, а эффективность составляет около 72%. Кроме того, в систему с композиционными электролитами входят и твердые электролиты, которые сочетаются с легкоплавкой солью и имеют рабочую температуру 300–700 °С. Электролиты содержат основную ионопроводящую фазу и дополнительную фазу, присоединенную к основной фазе для улучшения электрических, механических и термических свойств [26] . Как представитель составных электролитов, карбонат щелочного металла (такой как LiCO 3 ) и оксид (такой как LiAlO 2 ) и CeO 2 , легированный Sm 2 O 3 , показали ожидаемые свойства, включая ион кислорода, карбонат-ион и протонная проводимость [27] .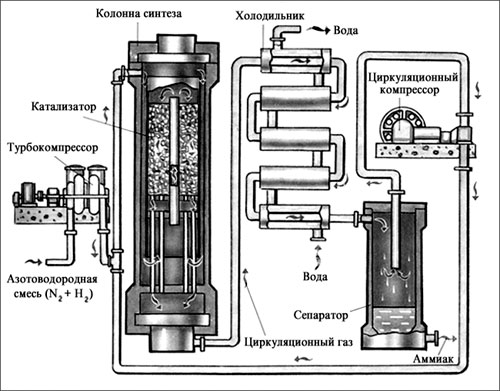 Кроме того, Амар и соавт. [27] испытали смешанные карбонаты Na, K и Li в дополнение к LiAlO 2 в качестве электролита. Они получили производительность по аммиаку 2,32 × 10 −10 моль/см 2 ·с при температуре около 400 °С. Система с твердыми электролитами обычно работает в очень широком диапазоне рабочих температур, от комнатной до примерно 800 °C. Существуют различные материалы, которые могут быть включены в этот тип электролита. К ним относятся перовскиты (такие как церат и цирконат) [28] , флюориты (такие как легированный цирконий, церий и торий), пирохлоры (такие как цирконат лантана, легированный кальцием) и другие материалы (включая браунмиллерит, эвлит и монацит) [26] . К недостаткам электролитов этого типа относятся их структурная стабильность и высокая температура спекания (до 1700 °C), необходимая для достижения высокой плотности. Применяя этот тип твердотельного электролита, скорость производства аммиака 3,1 × 10 −9 моль/см 2 ·с может быть достигнута при температуре 570 °C с эффективностью около 75% [27].
Кроме того, Амар и соавт. [27] испытали смешанные карбонаты Na, K и Li в дополнение к LiAlO 2 в качестве электролита. Они получили производительность по аммиаку 2,32 × 10 −10 моль/см 2 ·с при температуре около 400 °С. Система с твердыми электролитами обычно работает в очень широком диапазоне рабочих температур, от комнатной до примерно 800 °C. Существуют различные материалы, которые могут быть включены в этот тип электролита. К ним относятся перовскиты (такие как церат и цирконат) [28] , флюориты (такие как легированный цирконий, церий и торий), пирохлоры (такие как цирконат лантана, легированный кальцием) и другие материалы (включая браунмиллерит, эвлит и монацит) [26] . К недостаткам электролитов этого типа относятся их структурная стабильность и высокая температура спекания (до 1700 °C), необходимая для достижения высокой плотности. Применяя этот тип твердотельного электролита, скорость производства аммиака 3,1 × 10 −9 моль/см 2 ·с может быть достигнута при температуре 570 °C с эффективностью около 75% [27].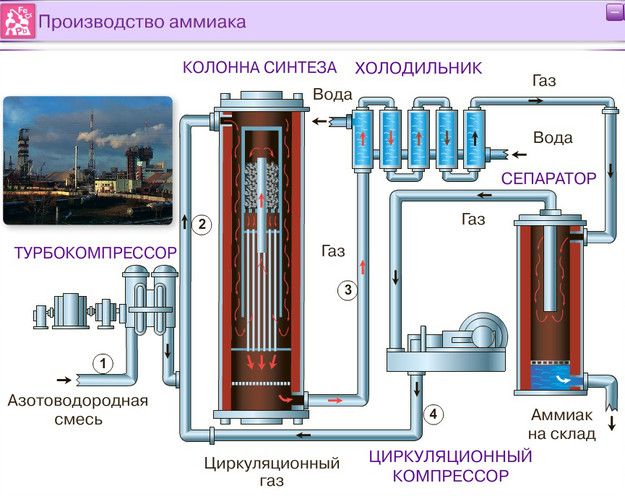 ] [29] .
] [29] .
4. Термохимический цикл производства аммиака
В качестве альтернативного способа производства аммиака был разработан процесс, использующий термохимический цикл [30] . Система состоит из двух циркуляционных процессов: восстановления (активация азота) и парогидролиза (образование аммиака). Обе реакции резюмируются следующим образом:
На рис. 3 представлена принципиальная схема термохимического цикла производства аммиака. Первичные источники энергии предварительно обрабатываются и преобразуются в углерод перед подачей в процесс термохимического цикла. В первом процессе восстановления (реакция (4)) AlN получают посредством карботермического восстановления Al 2 O 3 и азот. Эта реакция является эндотермической и протекает при температуре реакции около 1500°С. Кроме того, во второй реакции, которая представляет собой паровой гидролиз (реакция (5)), AlN, полученный в первом процессе восстановления, взаимодействует с водяным паром (H 2 O) с получением Al 2 O 3 . Полученный в этой второй реакции Al 2 O 3 затем направляют на первый процесс восстановления. Подробная кинетика реакции была подробно проанализирована в [31] .
Полученный в этой второй реакции Al 2 O 3 затем направляют на первый процесс восстановления. Подробная кинетика реакции была подробно проанализирована в [31] .
Рисунок 3. Принципиальная схема термохимического цикла производства аммиака.
В отличие от процесса Габера-Боша этот термохимический цикл может осуществляться при атмосферном давлении и без катализатора. Процесс позволяет независимо контролировать реакцию активации азота (реакция (4)) и образования аммиака (реакция (5)). Кроме того, как видно из реакции (4), система может производить аммиак непосредственно из карбонизированного материала вместо чистого водорода. Поэтому ожидается, что эта система сможет снизить потребление энергии при производстве аммиака. Однако эта система имеет самую большую проблему, связанную с очень высокой рабочей температурой, что приводит к ограниченным источникам тепла и материалам. Были предложены различные идеи теплоснабжения, в том числе использование концентрированного солнечного тепла.
Хуангса и Азиз [32] разработали интегрированную систему, состоящую из производства азота, производства аммиака с использованием термохимического цикла и производства электроэнергии. В их системе тепло, необходимое для восстановления, в основном покрывается теплом, выделяемым при сгорании топливных газов, образующихся при производстве аммиака. Система может достичь высокой общей теоретической энергоэффективности около 69%. Кроме того, они также заявили, что температура окисления играет важную роль в работе системы.
Усовершенствованные системы производства аммиака
В связи с растущим беспокойством, связанным с экономическим и экологическим воздействием, были предприняты интенсивные усилия по предложению и разработке усовершенствованной системы производства аммиака. К ним относятся как термохимические, так и электрохимические процессы.
Синти и др. [33] предложили комбинированную систему, состоящую из твердооксидного электролизера, производства азота с адсорбцией при переменном давлении и процесса Габера-Боша. Более того, та же группа [11] также разработала комплексную систему, охватывающую паровую конверсию метана и процесс Габера-Боша. В основном они были сосредоточены на системной интеграции и рекуперации тепла для повышения общей энергоэффективности. Кроме того, Азиз и соавт. [34] предложили интегрированную систему преобразования водорода в аммиак с относительно высокой общей энергоэффективностью. Их система включает криогенное разделение азота с одним реактором дистилляции, процесс Габера-Боша и производство электроэнергии. Выделяемое тепло при синтезе аммиака, а также продувочный газ (содержащий небольшое количество водорода и аммиака) утилизируются и используются для выработки электроэнергии. Кроме того, они использовали как рекуперацию эксергии, так и интеграцию процессов для достижения высокой энергоэффективности 9.0007 [35] .
Более того, та же группа [11] также разработала комплексную систему, охватывающую паровую конверсию метана и процесс Габера-Боша. В основном они были сосредоточены на системной интеграции и рекуперации тепла для повышения общей энергоэффективности. Кроме того, Азиз и соавт. [34] предложили интегрированную систему преобразования водорода в аммиак с относительно высокой общей энергоэффективностью. Их система включает криогенное разделение азота с одним реактором дистилляции, процесс Габера-Боша и производство электроэнергии. Выделяемое тепло при синтезе аммиака, а также продувочный газ (содержащий небольшое количество водорода и аммиака) утилизируются и используются для выработки электроэнергии. Кроме того, они использовали как рекуперацию эксергии, так и интеграцию процессов для достижения высокой энергоэффективности 9.0007 [35] .
Разработаны другие комплексные системы для производства аммиака из различных видов первичных источников энергии. Нурдиавати и др. [36] предложили производство аммиака на основе водорослей путем интеграции сушки водорослей, газификации, химического цикла, синтеза аммиака (процесс Габера-Боша) и производства электроэнергии. В их системе процесс отделения азота исключен из-за использования богатого азотом дымового газа из химического контура. Их система способна эффективно преобразовывать водоросли в аммиак с общей энергоэффективностью около 64%, включая эффективность производства аммиака 63%. Та же группа разработала другую систему [37] , с основным отличием в гидротермальной газификации и производстве азота. Другая комбинированная система переработки сельскохозяйственных отходов завода по производству пальмового масла также была предложена и оценена Ajiwibowo et al. [38] . В их системе сверхкритическая водная газификация смешанных пустых фруктовых связок и стоков завода по производству пальмового масла сочетается с химическим циклом синтез-газа и синтезом аммиака на основе Габера-Боша.
[36] предложили производство аммиака на основе водорослей путем интеграции сушки водорослей, газификации, химического цикла, синтеза аммиака (процесс Габера-Боша) и производства электроэнергии. В их системе процесс отделения азота исключен из-за использования богатого азотом дымового газа из химического контура. Их система способна эффективно преобразовывать водоросли в аммиак с общей энергоэффективностью около 64%, включая эффективность производства аммиака 63%. Та же группа разработала другую систему [37] , с основным отличием в гидротермальной газификации и производстве азота. Другая комбинированная система переработки сельскохозяйственных отходов завода по производству пальмового масла также была предложена и оценена Ajiwibowo et al. [38] . В их системе сверхкритическая водная газификация смешанных пустых фруктовых связок и стоков завода по производству пальмового масла сочетается с химическим циклом синтез-газа и синтезом аммиака на основе Габера-Боша.
Процесс Габера для производства аммиака
Соотношение азота и водорода
Смесь азота и водорода, поступающая в реактор, находится в соотношении 1 объем азота к 3 объемам водорода.
Закон Авогадро гласит, что равные объемы газов при одинаковых температуре и давлении содержат одинаковое количество молекул. Это означает, что газы поступают в реактор в соотношении 1 молекула азота на 3 молекулы водорода.
Это пропорция, требуемая уравнением.
В некоторых реакциях вы можете использовать избыток одного из реагентов. Вы поступили бы так, если бы особенно важно было израсходовать как можно больше другого реагента, например, если бы он был намного дороже. Это не применимо в данном случае.
Всегда есть обратная сторона использования чего-либо, кроме пропорций уравнения. Если у вас есть избыток одного реагента, через реактор будут проходить молекулы, которые не смогут реагировать, потому что им не с чем реагировать. При этом расходуется пространство реактора, особенно пространство на поверхности катализатора.
Температура
Вопросы равновесия
Вам необходимо сместить положение равновесия как можно дальше вправо, чтобы получить максимально возможное количество аммиака в равновесной смеси.
Прямая реакция (производство аммиака) экзотермическая.
Согласно принципу Ле Шателье, этому будет способствовать понижение температуры. Система отреагирует изменением положения равновесия, чтобы противодействовать этому, другими словами, производством большего количества тепла.
Чтобы получить как можно больше аммиака в равновесной смеси, нужна как можно более низкая температура. Однако 400 — 450°C — это не низкая температура!
Оценка ставок
Чем ниже температура, которую вы используете, тем медленнее становится реакция. Производитель старается производить как можно больше аммиака в день. Нет смысла пытаться получить равновесную смесь, содержащую очень высокую долю аммиака, если для достижения равновесия реакции требуется несколько лет.
Вам нужно, чтобы газы достигли равновесия за очень короткое время, пока они будут контактировать с катализатором в реакторе.
Компромисс
400 — 450°C является компромиссной температурой, обеспечивающей достаточно высокую долю аммиака в равновесной смеси (даже если она составляет всего 15%), но за очень короткое время.
Давление
Вопросы равновесия
Обратите внимание, что в левой части уравнения 4 молекулы, а в правой только 2.
В соответствии с принципом Ле Шателье, если вы увеличите давление, система отреагирует, благоприятствуя реакции, которая производит меньше молекул. Это приведет к тому, что давление снова упадет.
Чтобы получить как можно больше аммиака в равновесной смеси, нужно максимально высокое давление. 200 атмосфер — это высокое давление, но не невероятно высокое.
Оценка ставок
Повышение давления сближает молекулы. В данном конкретном случае это увеличит их шансы на попадание и прилипание к поверхности катализатора, где они могут реагировать. Чем выше давление, тем лучше с точки зрения скорости газовой реакции.
В данном конкретном случае это увеличит их шансы на попадание и прилипание к поверхности катализатора, где они могут реагировать. Чем выше давление, тем лучше с точки зрения скорости газовой реакции.
Экономические соображения
Очень высокое давление очень дорого производить по двум причинам.
Вы должны построить чрезвычайно прочные трубы и защитную оболочку, чтобы выдерживать очень высокое давление. Это увеличивает ваши капитальные затраты при строительстве завода.
Высокое давление требует больших затрат на производство и обслуживание. Это означает, что эксплуатационные расходы вашего завода очень высоки.
Компромисс
200 атмосфер – компромиссное давление, выбранное из экономических соображений. Если используемое давление слишком высокое, затраты на его создание превышают цену, которую вы можете получить за дополнительный произведенный аммиак.
Катализатор
Вопросы равновесия
Катализатор никак не влияет на положение равновесия.
