п.п. | Компания | Адрес | ИНН | Номер договора | Интернет сайт |
1 | АО ПФ СКБ Контур | 620144, Екатеринбург, ул. Народной Воли, 19А | 6663003127 | 1 | https://kontur.ru/ |
2 | АНО БЕЛИНФОНАЛОГ | 115093, г.Москва, Подольское шоссе, д.8, корп.5, офис 444 | 3123101188 | 2 | http://www.belinfonalog.ru/ |
3 | ОАО ИнфоТеКС Интернет Траст | 127287, г. | 7743020560 | 3 | http://iitrust.ru/ |
4 | ООО ЭЛБИС | 650000, г. Кемерово, пр. Советский, 27, оф. 424, 425 | 4205011410 | 5 | http://www.e-tax.ru/ |
5 | ООО Компания Тензор | 150000, г. Ярославль, Московский проспект, д. 12 | 7605016030 | 6 | http://tensor.ru/ |
6 | ООО КОРУС Консалтинг СНГ | 194100, Санкт-Петербург, Большой Сампсоновский проспект, дом 68, литер «Н» | 7801392271 | 7 | www. |
7 | ООО Такском | 119034, Москва, Барыковский пер., д. 4, стр. 2 | 7704211201 | 8 | http://taxcom.ru/ |
8 | ООО АРГОС | 196191,г. Санкт-Петербург, Ленинский пр., д.168 | 7810225534 | 9 | http://www.argos-nalog.ru/ |
9 | ООО Русь-Телеком | 214025, Смоленская область, г. Смоленск, ул. Вяземская, д. 42 | 6731071801 | 10 | http://www.rus-telecom.ru/ |
10 | АО Калуга Астрал | 248023 г.Калуга, пер.Теренинский, д. | 4029017981 | 12 | http://astralnalog.ru/ |
11 | ООО РПЦ Партнер | 410005 г.Саратов, ул. Большая Садовая, д. 239, к. 42 оф. 422 | 6454066437 | 13 | http://parc.ru/ |
12 | ООО НПП Ижинформпроект | 426057, г. Ижевск, ул. Бородина, 21, оф. 207 | 1831014533 | 14 | http://www.infotrust.ru/ |
13 | АО ГНИВЦ | 125373, г. Москва, Походный пр., 3, стр.1 | 7707083861 | 18 | http://www.gnivc.ru/ |
14 | УФМФ АО ЦентрИнформ | 191123, г. | 7841016636 | 19 | http://center-inform.ru |
15 | ЗАО Сервер-Центр | 690650, г. Владивосток э ул. Нерчинская 10, оф.315 | 2539038819 | 22 | http://www.serverc.ru/ |
16 | ЗАО ЦЭК | 603000, Н. Новгород,Ул. Новая, 15 | 5260013152 | 23 | http://www.nalog.cek.ru/ |
17 | ООО Электронный Экспресс | 119991, Москва, ул. Ленинские горы, дом 1.стр.77 | 7729633131 | 24 | Главная |
18 | АО ЦентрИнформ | 191123, г. | 7841016636 | 28 | http://center-inform.ru |
19 | ООО Линк-Сервис | 454006, г. Челябинск, ул. 3-го Интернеционала, д. 63 | 7438014673 | 29 | http://www.link-service.ru/ |
20 | ООО ИМЦ | 443010, г. Самара, ул. Некрасовская, 56 «Б» | 6317036857 | 30 | http://imctax.parus-s.ru/ |
21 | ЗАО ТаксНет | 420021, г.Казань, Ул. Каюма Насыри, д. 28, | 1655045406 | 32 | http://www.taxnet.ru/ |
22 | ООО УЦ ГИС | 198096,г. | 7805544260 | 33 | http://ca.gisca.ru/ |
23 | АО УДОСТОВЕРЯЮЩИЙ ЦЕНТР | 195112, г. Санкт-Петербург, Малоохтинский пр. д.68 | 7806122720 | 36 | http://nwudc.ru/ |
24 | ООО Гвард-Информ | 300041, г. Тула, пр.Ленина, д.46, офис 407 | 7107065081 | 41 | http://www.ginf.ru/ |
25 | ООО УЦ Аском | 355003, г.Ставрополь,ул.Ленина, д.293/ Л.Толстого,д.31 | 263504985 | 42 | http://www.ackom. |
26 | НФ АО ЦентрИнформ | 603098,г.Нижний Новгород Гагарина пр.,д.28, лит А | 7841016636 | 43 | http://www.r52.center-inform.ru/ |
27 | ООО ЭСОТЕЛ-Рустелком | 677008, г. Якутск, ул. Гоголя, д. 1 | 1435106300 | 44 | http://www.esotel.ru/ |
28 | ООО Технокад | 115114, г. Москва, Павелецкая наб, д.8 стр.6, офис 601-602 | 5009046312 | 46 | http://www.technokad.ru/ |
29 | ЗАО НТЦ СТЭК | 454080,Челябинск, ул. Энтузиастов, 12б | 7451019159 | 47 | http://www. |
30 | ООО Роста | 344010, г. Ростов-на-Дону, пр. Ворошиловский, д.52, оф.67 | 6163143849 | 48 | http://ooorosta.ru |
31 | ООО Центр Бухгалтерских Услуг | 353925, г.Новороссийск, пр. Дзержинского, д.211 | 2315096691 | 49 | http://cacbu.ru |
32 | ООО КДС | 302028, г. Орел, ул.Ленина, д.45 | 5754003919 | 51 | http://www.kds-trust.ru/ |
33 | ООО КРИПТЭКС | 445043, г.Самара, ул.Московское шоссе 3, оф.404 | 6315629971 | 53 | http://cryptex. |
34 | АНО ИО Деловой вестник | 308012, г.Белгород, ул.Костюкова, д.36а | 3123082552 | 54 | http://www.nalogtelecom.ru/ |
35 | АО Эридан | 600022, г. Владимир, ул. Ставровская, 8 | 3328419341 | 56 | http://nalog33.ru/ |
36 | ОГБУ Белгородский информационный фонд | 308000, г. Белгород, Соборная площадь, д. 4 | 3123077111 | 57 | http://beluc.ru |
37 | ООО Компьютерные технологии | 241011 Брянская область, г.Брянск, ул. | 3234042788 | 58 | http://www.ipct.ru/ |
38 | КрвФ АО ЦентрИнформ | 610000, г.Киров, ул.Ленина, д.85 | 7841016636 | 60 | http://www.r43.center-inform.ru/ |
39 | ООО ИЦ Выбор | 214000 г.Смоленск, ул.Коммунистическая, д.6 | 6730025009 | 61 | http://icvibor.ru/ |
40 | ООО ТЕЛ | 660135, г.Красноярск, ул.Взлетная, д.3 | 2465097373 | 63 | http://www.nalog.scn.ru/ |
41 | ООО МО ПНИЭИ-КрасКрипт | 660077, г. | 2466077563 | 64 | Немного о нашей Компании |
42 | ОАО Центр информатизации Республики Мордовия | 430030, Республика Мордовия, г. Саранск, ул. Власенко, д. 32 | 1326134964 | 65 | http://www.delmor.net/ |
43 | ООО УНЦИБ | 424000, Республика Марий Эл, г.Йошкар-Ола, ул.Машиностроителей, д.8Г, офис 313 | 1215136109 | 66 | http://uncib.ru/ |
44 | УлнФ АО ЦентрИнформ | 432027, г. Ульяновск, ул. Радищева, д.143, копус 3 | 7841016636 | 70 | http://www. |
45 | МУП АРЦИС | 440044, ул. Суворова, д. г. Пенза | 5835038469 | 72 | http://www.arcis.ru/ |
46 | ООО ИНЕТ | 650000, ул. Демьяна Бедного, д.6, оф. 45 | 4205016288 | 74 | http://www.kemnet.ru/ |
47 | ООО СЗТЛС | 197183, Санкт-Петербург, ул. Дибуновская, д.50, оф.212 | 7814325226 | 76 | http://www.sztls.ru/ |
48 | ЗАО Удостоверяющий центр | 109012, г. Москва, ул. Ильинка, д.4, пом.94 | 5260112900 | 81 | http://www. |
49 | ООО Салон 2116 — электронный почтамп | 305001, г. Курск, ул. Карла Либхнехта, д.5 | 4630004308 | 84 | www.docmail.ru |
50 | АО НУЦ | 111024, г. Москва, ул. Авиамотрная, д. 8а | 7722766598 | 88 | www.nucrf.ru |
51 | ООО Аргос СПб | 196191, г. Санкт-Петербург, пл., Конституции, д.7 лит. А, помещение 109-Н | 7810447985 | 89 | www.argos-nalog.ru |
52 | ООО Эврика | 432017, г. Ульяновск, ул. Спасская, д.5, оф. | 7326020252 | 91 | www.evrica73.ru |
53 | ООО УЦ СОЮЗ | 127006, г. Москва, ул. Садово-Триумфальная, д. 18, пом. I, ком. 1 | 7710963520 | 96 | www.ucsouz.ru |
54 | ООО Фалькон Плюс | 163002, г. Архангельск, ул. Вельская, д.1 | 2901063507 | 101 | www.falconplus.ru |
55 | ООО НПФ ИСБ | 634034, г. Томск, пр-т Ленина, д. 28 | 7017091200 | 106 | www.npf-isb.ru |
56 | ООО Такснет-сервис | 420021, Республика Татарстан, г. | 1655109956 | 108 | — |
57 | ООО ВОСТКОМ | 677005, г. Якутск, ул. Стадухина, д.63/1 | 1435302087 | 112 | www.vostcom.ru |
58 | ООО НТСсофт | 620062, г. Екатеренбург, ул. Чебышева, д.4 | 6670237020 | 113 | http://edoc.ntssoft.ru |
59 | ООО УЦ Белинфоналог | 308007, г. Белгород, проспект Б.Хмельницкого, 133В | 3123304163 | 114 | http://www.belinfonalog.ru/ |
60 | ООО МАГТЕЛ | 685024, г. | 4909103890 | 117 | — |
61 | ООО Бифит ЭДО | 105203, г. Москва, ул. Нижняя Первомайская д. 46 | 7719443460 | 119 | www.bifit.com |
62 | ООО Э-КОМ | 129110, г. Москва, ул. Гиляровского, д. 57, этаж 3, комната 4 | 9715218298 | 121 | https://exite.ru/ |
63 | ООО Финтендер-Крипто | 656056, Барнаул, Максима Горького, д.29 | 2225129102 | 122 | https://ft-crypto.ru |
64 | ООО «МОСТИНФО» | 620075, Свердловская обл. | 6659140843 | 122 | — |
65 | ООО МАСКОМ-Техлайн | 680038, г. Хабаровск, ул. Яшина, д.40 | 2722050371 | 123 | www.mascom-it.ru |
66 | ООО ПРОФИ Менеджер | 142432, Московская область, г.Черноголовка,ул.Лесная,д.9 | 5031082309 | 125 | https://profi-mo.ru/ |
67 | ООО ЕКЕЙ УЦ | 109012, г. Москва, ул.Ильинка, д.4, антр эт.3, пом.94 | 7710964348 | 126 | www.ekey.ru |
68 | АО ТЭК-Торг | 115191, РФ, Москва, Гамсоновский пер, д. | 7704824695 | 127 | https://www.tektorg.ru/ |
69 | ООО ПС СТ | 115280, г. Москва, Ул. Ленинская слобода, д.19 | 7841465198 | 128 | https://ofd.ru/ |
70 | ООО Сберключ | 119435, г. Москва, Ул. Б.Саввинский пер., д.12, стр.9 | 7707752230 | 129 | https://www.sberkey.ru |
71 | ООО Эвотор ОФД | 119021, г. Москва, ул.Тимура Фрунзе, 24 | 9715260691 | 130 | https://platformaofd.ru/ |
72 | ООО Оператор-ЦРПТ | 121609, г. | 7731376812 | 132 | https://crpt.ru |
73 | ООО ИРИС | 101000, г.Москва, Бобров пер., д.6, стр.3, пом.I | 7733261013 | 133 | https://iris-retail.ru |
74 | ООО Факторин | 119180, г.Москва, ул.Б.Полянка, д.2/10, стр.1 | 7704459971 | 134 | https://factorin.io |
75 | ООО Центр Информационных Технологий г. Уфа | 450005, г. Уфа, ул. Новоженова, д.88 | 277128392 | 135 | — |
76 | ООО ДИАС-К | 107113, Москва, Старослободская, 16/17, комн. | 7718950509 | 136 | — |
77 | ООО ДиСтэйт | 196006, Санкт-Петербург, ул. Новорощинская, 4, офис 926-2 | 7810732125 | 137 | — |
ФНС РОССИИ, ИНН 7707329152
Основание внесения оператора в реестр (номер приказа): 59
Адрес местонахождения оператора: 127381, Москва, ул. Неглинная, д. 23
Дата начала обработки персональных данных: 01.01.2001
Субъекты РФ, на территории которых происходит обработка персональных данных: Москва
Цель обработки персональных данных: реализации служебных и трудовых отношений, а также в связи с оказанием государственных услуг и осуществлением государственных функций
Описание мер, предусмотренных ст. 18.1 и 19 Закона: Применяемые в составе ИС налоговых органов средства обработки информации не ниже пятого класса защиты.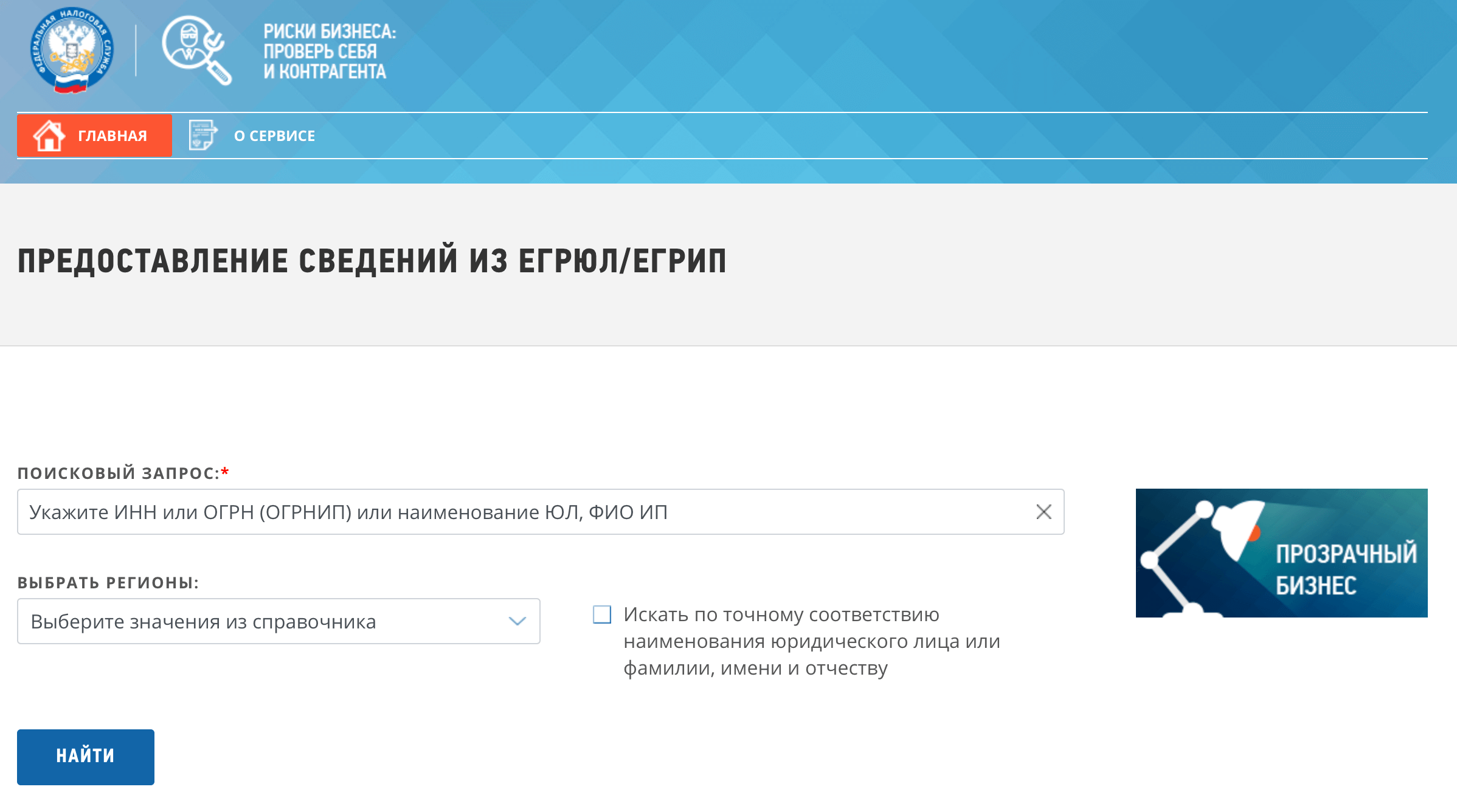 Программно-аппаратные средства межсетевого экранирования, применяемые для разграничения сегментов внутри ИС налоговых органов, не ниже четвертого класса защиты, а предназначенные для подключения к информационно-телекоммуникационным сетям международного информационного обмена (включая сеть Интернет) удовлетворяют требованиям ФСБ России. Исполнительный механизм в совокупности с механизмом поддержки Системы защиты информации на физическом подуровне обеспечивают создание защищенной физической оболочки для объектов информатизации налоговых органов. Исполнительный механизм Системы защиты информации в совокупности с механизмом поддержки на технологическом подуровне исполнительского уровня обеспечивают создание защищенной программной и аппаратной оболочки для ИС ФНС России (защищенной платформы ИС налоговых органов). На этом подуровне обеспечивается: защита ИР ФНС России, содержащих системное и прикладное программное обеспечение, необходимое для работы ИС налоговых органов, защита Инфраструктурных ИР ФНС России, содержащих сведения по администрированию ИС налоговых органов.
Программно-аппаратные средства межсетевого экранирования, применяемые для разграничения сегментов внутри ИС налоговых органов, не ниже четвертого класса защиты, а предназначенные для подключения к информационно-телекоммуникационным сетям международного информационного обмена (включая сеть Интернет) удовлетворяют требованиям ФСБ России. Исполнительный механизм в совокупности с механизмом поддержки Системы защиты информации на физическом подуровне обеспечивают создание защищенной физической оболочки для объектов информатизации налоговых органов. Исполнительный механизм Системы защиты информации в совокупности с механизмом поддержки на технологическом подуровне исполнительского уровня обеспечивают создание защищенной программной и аппаратной оболочки для ИС ФНС России (защищенной платформы ИС налоговых органов). На этом подуровне обеспечивается: защита ИР ФНС России, содержащих системное и прикладное программное обеспечение, необходимое для работы ИС налоговых органов, защита Инфраструктурных ИР ФНС России, содержащих сведения по администрированию ИС налоговых органов.
 На этом подуровне обеспечивается: защита и скрытие трафика в каждом из каналов его распространения, защита информации, передаваемой по каналам связи.
На этом подуровне обеспечивается: защита и скрытие трафика в каждом из каналов его распространения, защита информации, передаваемой по каналам связи.Категории персональных данных: фамилия, имя, отчество,год рождения,месяц рождения,дата рождения,место рождения,адрес,семейное положение,социальное положение,имущественное положение,образование,профессия,доходы,национальная принадлежность, сведения составляющие налоговую тайну, имеют специальный режим хранения и доступа, сведения о воинском учете военнообязанных лиц и лиц, подлежащих призыву на военную службу, сведения о полученном профессиональным и дополнительном образовании, профессиональной переподготовке, повышении квалификации, стажировке, присвоении ученой степени, ученого звания (наименование образовательного учреждения, специальность и квалификация по документу об образовании, наименование документа об образовании, его серия и номер), сведения о трудовой деятельности (трудовая книжка (номер, серия и дата выдачи трудовой книжки (вкладыша) и сведения, содержащиеся в трудовой книжке об общем трудовом и страховом стаже), сведения о состоянии здоровья и его соответствия выполняемой работе (заключение медицинского учреждения о наличии (отсутствии) заболевания, препятствующего поступлению на государственную гражданскую службу или ее прохождению), номер и серия страхового свидетельства обязательного пенсионного страхования, номер и серия полиса обязательного медицинского страхования, сведения о доходах, расходах, имуществе, обязательствах имущественного характера, а также о доходах, расходах, имуществе, обязательствах имущественного характера супругов и несовершеннолетних детей, сведения о государственных и ведомственных наградах, почетных и специальных званиях, поощрениях (в том числе и наименование или название награды, звания или поощрения, дата и вид правового акта о награждении или дата поощрения), результаты аттестации и квалификационного экзамена государственного гражданского служащего, сведения о временной нетрудоспособности, а также номер и серия листка нетрудоспособности (утвержден приказом Министерства и здравоохранения и социального развития Российской Федерации от 26 апреля 2011 г.
Категории субъектов, персональные данные которых обрабатываются: к сотрудникам ФНС России, налогоплательщиков, граждан, обращающихся в ФНС России с жалобами и заявлениями, кандидаты на замещение вакантных должностей гражданской службы РФ, бывшие государственные гражданские служащие, родственники государственных гражданских служащих, представители контрагентов, пользователи сайта.
Перечень действий с персональными данными: сбор, запись, систематизация, накопление, хранение, уточнение (обновление, изменение), извлечения персональных данных.
Обработка персональных данных: смешанная,с передачей по внутренней сети юридического лица,с передачей по сети Интернет
Правовое основание обработки персональных данных: Федеральным законом Российской Федерации от 27 июля 2006 г. № 152-ФЗ «О персональных данных», — Федеральный закон от 02.05.2006 № 59-ФЗ «О порядке рассмотрения обращений граждан Российской Федерации», — Федеральный закон от 27.07.2004 № 79-ФЗ «О государственной гражданской службе Российской Федерации», Указ Президента РФ от 01.02.2005№ 112 «О конкурсе на замещение вакантной должности государственной гражданской службы Российской Федерации»,- Постановлением Правительства Российской Федерации от 01.11.2012 № 1119 «Об утверждении Требований к защите персональных данных при их обработке в информационных системах персональных данных», — Рекомендациями ФСТЭК России от 15 февраля 2008 г. по обеспечению безопасности персональных данных при их обработке в информационных системах персональных данных, — Приказом ФСБ России от 10 июля 2014 г.
 № ММВ-7-4/6@, изм. Приказом Федеральной налоговой службы от 26 мая 2015 г. № ПА-7-6/213@), Перечень лицензий ФСБ России: — Лицензия на предоставление услуг в области шифрования информации, — Лицензия на осуществление распространения шифровальных (криптографических) средств, — Приказом ФНС России от 21.04.2015 №ММВ-7-4/165@ «О мерах, направленных на реализацию постановления Правительства РФ от 21.02.2012 № 211», — Лицензия на осуществление технического обслуживания шифровальных (криптографических) средств, согласие кандидата на вакантную должность, согласие государственного гражданского служащего.
№ ММВ-7-4/6@, изм. Приказом Федеральной налоговой службы от 26 мая 2015 г. № ПА-7-6/213@), Перечень лицензий ФСБ России: — Лицензия на предоставление услуг в области шифрования информации, — Лицензия на осуществление распространения шифровальных (криптографических) средств, — Приказом ФНС России от 21.04.2015 №ММВ-7-4/165@ «О мерах, направленных на реализацию постановления Правительства РФ от 21.02.2012 № 211», — Лицензия на осуществление технического обслуживания шифровальных (криптографических) средств, согласие кандидата на вакантную должность, согласие государственного гражданского служащего.Наличие трансграничной передачи: нет
Сведения о местонахождении базы данных: Россия
Налоговая инспекция 33
ИФНС 33
Начальник Инспекция ФНС России № 33:
Толстова Татьяна Алексеевна
Фактический адрес:
125373, г. Москва, Походный проезд, домовладение 3
Юридический адрес:
125373, г. Москва, Походный проезд, домовладение 3
Москва, Походный проезд, домовладение 3
Адрес для почтовых отправлений:
125373, г. Москва, Походный проезд, домовладение 3
Схема проезда до налоговой инспекции:
Cпособ проезда:
метро «Тушинская», авт. 266, 2, 210 до ост. «платформа «Трикотажная» и далее пешком назад 100 метров и по Походному проезду — 400 метров, авт. 88 ,777 до ост. «ул. Василия Петушкова» и далее -200 метров;
метро «Сходненская», авт. 199, 678 до ост. «Походный проезд» и далее пешком 200 метров
Телефоны:
Секретарь:
8 (495) 400-00-33;
Справочная:
8 (495) 400-28-54;
Информирование по исчислению и уплате транспортрного налога и налога на имущество физических лиц:
8 (495) 400-28-16;
8 (495) 400-28-29;
Информирование по налоговым вычетам (социальный, имущественный):
8 (495) 400-28-14;
8 (495) 400-28-78;
Факс:
8 (495) 400-28-21;
Отдел | Телефон |
|---|---|
Отдел работы с налогоплательщиками | |
Отдел регистрации и учета налогоплательщиков | |
Отдел заказа выписки | подробнее… |
Отдел урегулирования задолженности | 8 (495) 400-28-34; |
Отдел ввода и обработки данных | 8 (495) 400-28-32; |
Отдел камеральных проверок №1 по вопросам исчисления и уплаты налога по УСН и налога на имущество организаций | 8 (495) 400-28-04; |
Отдел камеральных проверок №2 по вопросам исчисления и уплаты налога на прибыль организаций | 8 (495) 400-28-27; |
Отдел камеральных проверок №3 по вопросам исчисления и уплаты налога на добавленную стоимость | 8 (495) 400-28-26; |
Отдел камеральных проверок №4 по вопросам налогообложение индивидуальных предпринимателей и физических лиц (3-НДФЛ) | 8 (495) 400-28-78; |
Отдел камеральных проверок №5 по вопросам исчисления и уплаты транспортного налога и налога на имущество физических лиц | 8 (495) 400-28-31; |
Реквизиты
ИНН 7733053334
КПП 773301001
Код налогового органа в ФНС 33: 7733
Получатель: Управление Федерального казначейства по г. Москве (ИФНС России №33 по г. Москве)
Москве (ИФНС России №33 по г. Москве)
Наименование банка: ГУ Банка России по ЦФО
Номер счета: 40101810045250010041
БИК банка: 044525000
Номер корреспондентского счета или субсчет банка в котором открыт счет УФК России по г. Москве – нет
| Время pa6oты ИФНС: | Пepepыв: | |
пн: | 9.00-18.00 | 13.00-13.45 |
вт: | 9.00-18.00 | 13.00-13.45 |
cp: | 9.00-18.00 | 13.00-13.45 |
чт: | 9. 00-18.00 00-18.00 | 13.00-13.45 |
пт: | 9.00-16.45 | 13.00-13.45 |
Прием налогоплательщиков в операционном зале осуществляется без перерыва на обед понедельник, среда с 9.00 до 18.00; | ||
Прием запросов на предоставление выписок из ЕГРЮЛ/ЕГРИП осуществляется через форму заказа выписки на сайте http://na46.ru/ | ||
Выдача готовых выписок из ЕГРЮЛ/ЕГРИП При доставке выписки из ЕГРЮЛ/ЕГРИП, время согласовывается отдельно. | ||
<< Назад к списку ИФНС Москвы
Если Вы заметили на сайте опечатку или неточность, выделите её |
ОКМТО по ИНН | Как узнать ОКМТО? — Контур.Бухгалтерия
Организации и предприниматели обязаны уплачивать налоги и сборы. Заполняя отчетность и платежные документы, вы указываете реквизиты, среди которых код ОКТМО. В статье мы расскажем, что такое ОКТМО, каково его назначение и как узнать свой код.
Что такое ОКТМО
ОКТМО — это общероссийский классификатор территорий муниципальных образований. Классификатор состоит из 8 томов. Каждый том содержит коды для соответствующего федерального округа. На территории России множество областей, краев, республик. Они включают в себя муниципальные образования, каждому из которых присвоен свой код ОКТМО.
Для чего нужен ОКТМО
Код ОКТМО нужен государству, чтобы упростить и ускорить обработку информации о хозяйствующих субъектах, создать единую базу данных и прогнозировать развитие экономики. Кроме того, он определяет территориальную принадлежность налогоплательщика и указывает местный бюджет, в который казначейство перечислит платеж.
Предприниматели и руководители организаций должны знать свой код ОКТМО. Его нужно включать в реквизиты отчетных документов, налоговых деклараций и платежных поручений по налогам и другим обязательным платежам. Без верного ОКТМО нельзя сдать отчеты или получить налоговые вычеты.
Код присваивается не конкретной организации или ИП, а муниципальному образованию, на территории которого они зарегистрированы. Соответственно, один код может быть присвоен нескольким компаниям одновременно.
ОКТМО заменяет ОКАТО
В платежных документах обязательно указание кода. До введения ОКТМО в тех же целях применялся код ОКАТО (общероссийский классификатор объектов административно-территориального деления). Его недостаток в том, что он не указывает город, городской район или поселок в котором находится предприятие. ОКТМО уточняет эту информацию. Главное отличие кодов в принципе деления. ОКАТО зависит от субъекта РФ, а ОКТМО от муниципального образования.
До 2017 года указание кода ОКАТО вместо ОКТМО было допустимо. Теперь переходный период окончен, и неправильное заполнение реквизитов приведет к санкциям. Платежи по неправильным реквизитам попадают в категорию «невыясненных» и замедляют перераспределение средств между бюджетами.
Если вы указали неверный реквизит, то подайте заявление об уточнении платежа в ИФНС, ФСС или ПФР в зависимости от испорченного документа. На основании заявления госорганы примут решение об уточнении платежа и списании начисленных пеней.
Структура кода ОКТМО
ОКТМО включает два раздела: муниципальные образования и населенные пункты в составе муниципальных образований. Коды первого раздела состоят из восьми знаков, второго — из одиннадцати. Код содержит информацию:
- 1 и 2 знаки обозначают субъект РФ;
- 3-5 — городской округ или объединение, приравненное к нему;
- 6,7 и 8 — населенный пункт, в котором зарегестрированы организация или ИП.
Коды второго раздела включают эти 8 знаков, а 9, 10 и 11 обозначают населенный пункт внутри крупного муниципального образования. При этом значения с 001 по 049 присваиваются городам, с 051 по 099 — поселкам городского типа, а с 101 по 999 — сельским населенным пунктам. Чем крупнее населенный пункт, тем меньше знаков включает ОКТМО. Например, город Дмитров Московской области имеет код 46608000, а поселок Антропово Костромской области — 34602403101.
Как узнать код ОКТМО
Мы уже знаем, что ОКТМО необходим для заполнения множества документов, поэтому его нужно обязательно знать. Код присваивается организации и ИП автоматически налоговым органом по месту регистрации. Уведомление о присвоении кодов статистики направляют по почте.
Если вы впервые заполняете декларации и платежные документы или ваш код изменился из-за смены адреса регистрации, то появляется вопрос, как узнать свой ОКТМО.
Для этого можно подать заявление в налоговый орган по месту регистрации с просьбой сообщить присвоенный код в письменном виде, ответ вы получите в течение 5 дней. Можно обратиться в налоговую по горячей линии, если повезет, вам подскажут нужный код, но скорее всего вам предложат воспользоваться сайтом ФНС и проконсультируют.
При непосредственном контакте с налоговой, возникают временные задержки. Проще и быстрее воспользоваться интернетом. В сети множество ресурсов, которые предлагают узнать коды статистики, но для получения достоверной информации обращайтесь к официальным источникам.
Узнать код ОКТМО онлайн
Узнать код по ОКАТО можно на сайте ФНС или kod-oktmo.ru. Код ОКТМО заменил ранее используемый ОКАТО. Зная свой старый код, вы без труда сможете узнать новый.
Для этого на сайте https://www.nalog.ru перейдите в раздел “Электронные сервисы” и выберите «Узнай ОКТМО». Укажите в поле свой ОКАТО или введите наименование муниципального образования и нажмите кнопку найти. В окне «Код ОКТМО» появится нужный код. Аналогичная информация понадобится на сайте http://kod-oktmo.ru/.
На официальном портале МинФина представлена таблица соответствия кодов ОКАТО и ОКТМО со всеми изменениями https://www.minfin.ru/ru/ismf/eiasmfrf/.
Узнать код по адресу регистрации. Для ИП и физлиц понадобится адрес прописки, для организаций — адрес регистрации компании. Узнать код по адресу также можно на сайте ФНС и портале http://kod-oktmo.ru/. Если в сервисе «Узнай ОКТМО» вы не смогли получить код, то инспекторы рекомендуют воспользоваться http://fias.nalog.ru/ Федеральной информационной адресной системой. Для этого поставьте галочку в поле муниципальное деление и выберите расширенный поиск. Заполните все известные данные и нажмите кнопку “Найти”.
Узнать ОКТМО организации или ИП по ИНН может потребоваться, если кроме этого реквизита вам ничего не известно. Для этого используйте сервис Росстата — http://statreg.gks.ru/. Перейдя на страницу, выберите тип формируемого уведомления и укажите один из реквизитов: ИНН, ОГРН или ОКПО.
Найдите нужный филиал в предложенном списке и выберите «Коды ОК ТЭИ». Для вас будет сформировано уведомление, которое отправляется Росстатом при регистрации организации. Оно содержит коды статистики, в том числе ОКТМО.
Автор статьи: Елизавета Кобрина
При поиске кодов статистики используйте только надежные источники. Облачный сервис Контур.Бухгалтерия поможет формировать платежные документы и отчеты. ОКТМО и другие реквизиты заполняются автоматически. Новым пользователям доступно 14 дней бесплатной работы с сервисом для ознакомления. Ведите учет, формируйте отчетность и начисляйте зарплату сотрудникам вместе с нами.
Как узнать ИНН организации
Идентификационный номер налогоплательщика
Идентификационный номер налогоплательщика (ИНН) – это индивидуальный код, который выдается всем гражданам Российской Федерации, прошедшим процедуру регистрации в налоговой службе. ИНН имеет любое юридическое лицо, зарегистрированное на территории Российской Федерации, даже иностранное предприятие.
ИНН организации состоит из набора цифр, первые три из которых определяют код субъекта федерации, в котором зарегистрировано предприятие, следующие — номер налоговой инспекции, и остальные — номер записи в реестре юридических лиц.
gucqt74RS23uH0lVgJtwuVLphY9VrIk2LG6KaOjhC4ohScee1U1Av8xEhHABI35_peyZ4KhX7OISEE9RVh8yOTA9djk1:arT-KpMHHhoQXL1toziD2uVxeX9jc7za9sh06xthiK31JsUewUL185IPJe4HWnGu4oEZsGBZ1qm0KwpYZZWd1v1QIxE1 Что можно искать
Название компании, адрес, телефон, сайт, домен, ФИО руководителя, совладельца, доверительного управляющего, ИНН, ОГРН, ОКПО, БИК
Зачем существует ИНН
Идентификация налогоплательщиков как физических, так и юридических лиц, введена в 1993 году. Вслед за мировыми практиками в России было решено сделать прозрачным учет плательщиков налогов в государстве и облегчить работу налоговых органов.
Идентификатор присваивается организации или физическому лицу один раз и на все время существования. Этот номер является неотъемлемым признаком налогоплательщика и в любой момент может подтвердить его идентичность. Например, при наличии нескольких компаний с одинаковым наименованием, не исключена их регистрация по одному адресу, но исключено наличие у двух предприятий одного идентифицирующего признака. Поэтому поиск по ИНН юридического лица стал сегодня первым шагом в проверке контрагента на реальность ведения хозяйственной деятельности.
Где можно узнать ИНН организации
Итак, одним из обязательных пунктов проверки контрагента является необходимость удостовериться, что организация является зарегистрированной в установленном законом порядке и на дату заключения сделки не ликвидирована или не признана банкротом. Иными словами, задача найти организацию по ИНН – это та ежедневная практика, которую осуществляет практически каждый бизнес.
Поэтому очень удобно, что вся информация о ИНН находится в открытом доступе.
Есть несколько способов узнать ИНН:
- на сайте ФНС (ЕГРЮЛ/ЕГРИП)
- в едином федеральном реестре, содержащем информацию о деятельности юридических лиц и индивидуальных предпринимателей (Федресурс)
- в СПАРКе
Как узнать ИНН организации
Рассмотрим подробнее процедуру поиска организации по ИНН и идентификацию физического лица по этому номеру.
ИНН физического лица на сайте ФНСНа сайте ФНС в разделе «Узнать ИНН» вам будет предложено заполнить поля с ФИО, датой рождения физического лица, номер документа, удостоверяющего личность, его серию, номер и дату выдачи документа, а также цифры с картинки, после чего система выполнит поисковый запрос и покажет результаты.
ЕГРЮЛ/ЕГРИПНа сайте https://egrul.nalog.ru/ выберите вкладку «Юридическое лицо» или «Индивидуальный предприниматель/КФХ» и введите ОГРН или наименование юридического лица и регион местонахождения, а также заполните поле с цифрами с картинки. В качестве результата вы получите справку с указанием регистрационных данных, сведениях о юридическом адресе и других идентификационных кодах юридического лица или ИП.
Поиск в СПАРКеПо сути, основным инструментом для поиска любой информации в СПАРКе является строка поиска – сюда можно вбить название интересующей организации или любой из кодов или ФИО индивидуального предпринимателя. Поиск контрагента по ИНН в СПАРКе не составит труда.
Выбрав интересующую вас организацию и перейдя в карточку компании, вы сможете узнать ИНН в блоке с регистрационными данными. Таким образом, ваш поиск будет осуществлён всего в один клик!
ИНН также можно увидеть в разделе «Регистрационные данные»:
Читайте также:
Проверка ФН и ККТ на наличие внесения в реестр в ФНС
Чтобы проверить, что фискальный накопитель внесен в реестр ФНС рекомендуем:
1. Перейти на сайт налоговой по проверке ФН https://kkt-online.nalog.ru/
2. Выбрать модель фискального накопителя(модель ФН указывается в паспорте ФН)
3.Ввести заводской номер фискального накопителя. Заводской номер фискального накопителя можно взять из следующих источников:
- Заводской номер фискального накопителя указан на паспорте ФН
- Заводской номер фискального накопителя печатается на чеке
- Заводской номер фискального накопителя отображается на смарт-терминале в разделе «Настройки-Обслуживание кассы»
- Заводской номер фискального накопителя указан на этикетке, которая наклеена на паспорт смарт-терминала
Положительным результатом является ответ системы «ФН включен в реестр, не зарегистрирован в налоговых органах».
Если получен следующий ответ «ФН не включен в реестр, не зарегистрирован в налоговых органах», то следует:
- Сверить заводской номер ФН в паспорте ФН и на смарт-терминале в разделе «Настройки-Обслуживание кассы»
- Если номер ФН совпадает, то следует направить обращение в поддержку с приложенным фото паспорта ФН и фото из раздела «Настройки-Обслуживание кассы»
Чтобы проверить, что ККТ внесена в реестр ФНС нужно:
1. Перейти на сайт налоговой по проверке ККТ: https://kkt-online.nalog.ru/
2. Выбрать модель ККТ(модель указана в паспорте смарт-терминала)
- Модель 7.2 в реестре называется СТ2Ф
- Модель 7.3 в реестре называется СТ3Ф
- Модель 10 в реестре называется СТ3Ф
- Модель 5 в реестре называется СТ5Ф
3. Ввести заводской номер ККТ
4. Нажать на кнопку «Проверить»
Положительным результатом является ответ системы «ККТ включена в реестр, не зарегистрирована в налоговых органах».
Если получен следующий ответ «ККТ не включена в реестр, не зарегистрирована в налоговых органах», то следует:
- Сверить заводской номер ККТ в паспорте и на смарт-терминале в разделе «Настройки-Обслуживание кассы»
- Если номер ККТ совпадает, то следует направить обращение в поддержку с приложенным фото паспорта и фото из раздела «Настройки-Обслуживание кассы»
Врожденные ошибки IFN-иммунитета I типа у пациентов с опасным для жизни COVID-19
Врожденные пороки иммунитета к IFN I типа у пациентов с опасным для жизни COVID-19
Авторы: Цянь Чжан, Пол Бастард, Чжийонг Лю, Жереми Ле Пен, Марсела Монкада-Велес, Джи Чен, Масато Огиши, Ира К.Д. Сабли, Стефани Ходейб, Сесилия Король, Жереми Розайн, Кая Билгувар, Джункио Йе, Александрета Бигзэ , Руи Ян, Андрес Аугусто Ариас, Циньхуа Чжоу, Ю Чжан, Фанни Оноди, Сарантис Корниотис, Леа Карпф, Квентин Филиппот, Марва Чбихи, Люси Бонне-Мадин, Карим Доргам, Никайя Смит, Уильям М.Шнайдер, Брэндон С. Разуки, Ханс-Генрих Хоффманн, Элефтериос Михайлидис, Лин Моенс, Джи Ын Хан, Лазаро Лоренцо, Люси Бизьен, Филип Мид, Анна-Лена Нихус, Эйлин Камилла Угурбил, Орелиен Корно, Гаспар Цанган Кернер, Пенкен Рапапорт, Йоанн Зелеутнер, Джереми Манри, Сесиль Массон, Йоханн Шмитт, Агата Шлютер, Том Ле Войер, Таушиф Хан, Хуан Ли, Жак Феллай, Люси Руссель, Мохаммад Шахруэй, Мохаммед Ф. Алосайми, Давуд Хадсури, Давуд Мансури Аль-Мулла, Ферас Альмурфи, Салех Заид Аль-Мухсен, Фахад Альшиме, Саид аль-Турки, Рана Хасанато, Дидерик ван де Бик, Андреа Бионди, Лаура Рахель Беттини, Мариэлла Д’Анджио, Паоло Бонфанти, Луиза Имберти, Алессандри Симоне Пагера, Евгения Кирос-Ролдан, Камилло Росси, Эндрю Дж.Олер, Миранда Ф. Томпкинс, Камилла Альба, Изабель Вандернот, Жан-Кристоф Гоффар, Гийом Смитс, Изабель Мигеотт, Филомин Херинк, Пере Солер-Паласин, Андреа Мартин-Налда, Роджер Колобран, Пьер-Эммануэль Моранж, Севги Келес, Севги Келес , Тайфун Озчелик, Кадрие Карт Ясар, Севтап Сеноглу, Шемси Нур Карабела, Карлос Родригес-Гальего, Джузеппе Новелли, Сами Грайех, Ясин Танджауи-Ламбьотт, Ксавье Дюваль, Седрик Лауенан, клиника COVID, COVID, COVID, COVID COVID Cohort Study Group, CoV-Contact Cohort, Amsterdam UMC Covid-19 Biobank, COVID Human Genetic Effort, NIAID-USUHS / TAGC COVID Immunity Group, Andrew L.Сноу, Клифтон Л. Далгард, Джошуа Д. Милнер, Дональд Винь, Трине Х. Могенсен, Нико Марр, Андраш Н. Спаан, Бертран Буассон, Стефани Буассон-Дюпюи, Хасинта Бустаманте, Анн Пуэль, Майкл Дж. Чианканелли, Изабель Мейтс, Том Маниатис, Василий Сумелис, Али Амара, Мишель Нуссенцвейг, Адольфо Гарсиа-Састре, Флориан Краммер, Аврора Пухоль, Дарраг Даффи, Ричард П. Лифтон, Шен-Ин Чжан, Гай Горохов, Вивьен Безиат, Эммануэль Джоуи Симидзу, Чарльз М. Райс, Лоран Абель, Луиджи Д.Нотаранджело, Орели Кобат, Хелен С. Су, Жан-Лоран Казанова
Наука
Врожденные ошибки IFN-иммунитета I типа у пациентов с опасным для жизни COVID-19
Врожденные пороки иммунитета к IFN I типа у пациентов с опасным для жизни COVID-19
Цянь Чжан, Пол Бастард, Чжиюн Лю, Жереми Ле Пен, Марсела Монкада-Велес, Цзе Чен, Масато Огиси, Ира К.Д. Сабли, Стефани Ходейб, Сесилия Король, Жереми Розен, Кая Бильгувар, Цзюньцян Е, Александр Больз, Бенедетта Бигио, Руи Ян, Андрес Аугусто Ариас, Циньхуа Чжоу, Ю Чжан, Фанни Оноди, Сарантис Корниотпис, Леа Марва Чбихи, Люси Боннет-Мадин, Карим Доргам, Никайя Смит, Уильям М. Шнайдер, Брэндон С. Разуки, Ханс-Генрих Хоффманн, Элефтериос Михайлидис, Лин Моенс, Джи Юн Хан, Лазаро Лоренцо, Люси Бизьен, Филип Мид, Анна- Лена Нихус, Эйлин Камилла Угурбиль, Орелиен Корно, Гаспар Кернер, Пенг Чжан, Франк Рапапорт, Йоанн Зелеутнер, Джереми Манри, Сесиль Массон, Йоханн Шмитт, Агата Шлютер, Том Ле Войер, Таушиф Хан, Хуан Ли, Жакан Ли, Таушиф Кхан, Хуан Ли, Жакан Мохаммад Шахруэй, Мохаммед Ф.Алосайми, Давуд Мансури, Хайя Аль-Сауд, Фахд Аль-Мулла, Ферас Альмурфи, Салех Заид Аль-Мухсен, Фахад Альшиме, Саид Аль Турки, Рана Хасанато, Дидерик ван де Бик, Андреа Бионди, Лаура Рахель Д’Анджелла, Мариоэлла ‘, Паоло Бонфанти, Луиза Имберти, Алессандра Соттини, Симона Пагера, Юджиния Кирос-Ролдан, Камилло Росси, Эндрю Дж. Олер, Миранда Ф. Томпкинс, Камилла Альба, Изабель Вандернут, Жан-Кристоф Гоффар, Гийом Филом Смитс, Изабель Менидж Херинк, Пер Солер-Паласин, Андреа Мартин-Налда, Роджер Колобран, Пьер-Эммануэль Моранж, Севги Келес, Фатма Тёлькесен, Тайфун Озчелик, Кадрие Карт Ясар, Севтап Сеноглу, Шемси Нур Карабелау, Карлос-Гальперагес, Ги́лос-Гальперагес, Ги́лос-Гальперагуэс , Ясин Танджауи-Ламбьотт, Ксавье Дюваль, Седрик Лауэнан, клиницисты COVID-STORM, клиницисты COVID, Imagine COVID Group, Французская группа когортных исследований COVID, CoV-Contact Cohort, Амстердам UMC Биобанк Covid-19, COVID Human Genetic Effort-USUHS / TAGC COVID Immunity Group, Эндрю Л. .Сноу, Клифтон Л. Далгард, Джошуа Д. Милнер, Дональд Винь, Трине Х. Могенсен, Нико Марр, Андраш Н. Спаан, Бертран Буассон, Стефани Буассон-Дюпюи, Хасинта Бустаманте, Анн Пуэль, Майкл Дж. Чианканелли, Изабель Мейтс, Том Маниатис, Василий Сумелис, Али Амара, Мишель Нуссенцвейг, Адольфо Гарсиа-Састре, Флориан Краммер, Аврора Пухоль, Дарраг Даффи, Ричард П. Лифтон, Шен-Ин Чжан, Гай Горохов, Вивьен Безиат, Эммануэль Джоуи Симидзу, Чарльз М. Райс, Лоран Абель, Луиджи Д.Нотаранджело, Орели Кобат, Хелен С. Су, Жан-Лоран Казанова
Наука
Гемагглютинин вируса гриппа А противодействует ответам интерферона I типа (IFN), индуцируя деградацию рецептора IFN 1 типа
РЕЗЮМЕ
Вирус гриппа A (IAV) использует различные стратегии для обхода ответов интерферона I типа (IFN), в частности, путем ингибирования синтез IFN типа I. Однако плохо известно, регулирует ли IAV режим передачи сигналов, опосредованный рецептором IFN типа I (IFNAR), и каким образом.В этом исследовании мы демонстрируем, что IAV индуцирует деградацию субъединицы 1 IFNAR (IFNAR1), чтобы ослабить индуцированный IFN тип I противовирусный сигнальный путь. После инфицирования уровень белка IFNAR1, но не мРНК, снизился. Действительно, IFNAR1 фосфорилировался и убиквитинировался инфекцией IAV, что приводило к элиминации IFNAR1. Кратковременно сверхэкспрессированный IFNAR1 проявлял противовирусную активность за счет ингибирования репликации вируса. Важно отметить, что было доказано, что белок гемагглютинин (НА) IAV запускает убиквитинирование IFNAR1, снижая уровни IFNAR1.Кроме того, субъединица НА1 вируса гриппа А, но не субъединица НА2, подавляла регуляцию IFNAR1. Однако вирусная HA-опосредованная деградация IFNAR1 не была вызвана стрессовой реакцией эндоплазматического ретикулума (ER). IAV HA значительно снижает чувствительность клеток к IFN типа I, подавляя активацию STAT1 / STAT2 и индукцию IFN-стимулированных противовирусных белков. Взятые вместе, наши результаты показывают, что IAV HA вызывает деградацию IFNAR1, что, в свою очередь, помогает вирусу избежать мощной врожденной иммунной системы.Таким образом, исследование выявило вирусный механизм гриппа, позволяющий ускользнуть от сигнального пути IFNAR, что может дать новое понимание взаимодействия между вирусом гриппа и врожденным иммунитетом хозяина.
ВАЖНОСТЬ Инфекция, вызванная вирусом гриппа A (IAV), вызывает значительную заболеваемость и смертность во всем мире и остается серьезной проблемой для здоровья. При запуске вирусной инфекцией гриппа клетки-хозяева продуцируют интерферон I типа (IFN), чтобы блокировать репликацию вируса. Хотя было показано, что IAV имеет различные стратегии для уклонения от этого мощного, опосредованного IFN противовирусного ответа, четко не определено, влияет ли IAV на опосредованный рецептором IFN сигнальный путь.Здесь мы обнаружили, что белок гемагглютинина вируса гриппа (НА) вызывает деградацию субъединицы 1 рецептора IFN типа I (IFNAR1). HA способствует фосфорилированию и полиубиквитинированию IFNAR1, что облегчает деградацию этого рецептора. HA-опосредованная элиминация IFNAR1 заметно снижает чувствительность клеток к IFN типа I, о чем свидетельствует снижение экспрессии IFN-индуцированных антивирусных генов. Это открытие может помочь нам понять, как IAV регулирует врожденный иммунный ответ хозяина для создания среды, оптимизированной для выживания вирусов в клетках-хозяевах.
ВВЕДЕНИЕ
Инфекция вируса гриппа вызывает сезонный и пандемический грипп со значительной заболеваемостью и смертностью среди людей (1). Вспышки птичьего гриппа, вызванные высокопатогенными вирусами H5N1 и H7N9, повысили риск возникновения новой пандемии гриппа (2–4). Геном вируса гриппа A (IAV) кодирует не менее 11 белков, включая гемагглютинин (HA), нейраминидазу (NA), нуклеопротеин (NP), матричные белки (M1 и M2), неструктурные белки (NS1 и NS2), полимеразные белки ( PA, PB1 и PB2) и PB1-F2 (5, 6).Для лечения инфекции были разработаны противовирусные препараты против гриппа, которые блокируют функцию вирусных белков, таких как NA и M2. Однако из-за высокой мутабельности некоторые штаммы вирусов сезонного гриппа и птичьего гриппа оказались устойчивыми к современным противовирусным препаратам (6–8). Следовательно, разработка новых терапевтических средств и определение клеточных мишеней инфекции важны для эффективного контроля над гриппом.
Интерфероны типа I (IFN), которые включают несколько подтипов IFN-α и IFN-β, индуцируют экспрессию многочисленных интерферон-стимулированных генов (ISG), которые устанавливают антивирусные состояния (9–11).Следовательно, IFN типа I играют важную роль в системе защиты хозяина от вирусов, включая IAV (12–14). РНК вируса гриппа с 5’ppp запускают сигнальный путь, опосредованный ретиноевой кислотой, опосредованный геном 1 (RIG-I) (15). RIG-I привлекает митохондриальный противовирусный сигнальный белок (MAVS), который активирует киназы IκB, расположенные ниже по течению, киназы (IKKε) и TBK1 (16). Впоследствии эти киназы активируют фактор регуляции интерферона 3 (IRF3) фактора транскрипции, что приводит к индукции IFN типа I.После создания IFN секретируются и связываются с родственным рецептором IFN (IFNAR), чтобы вызвать путь передачи сигналов JAK / STAT. JAK1 и TYK2 фосфорилируют STAT1 / STAT2, который образует комплекс с IRF9, что приводит к экспрессии ISGs (17-19).
IFNAR состоит из двух субъединиц, IFNAR1 и IFNAR2. Было показано, что уровень IFNAR1 важен для стимуляции JAK / STAT-опосредованного сигнального пути ниже по течению (20). Однако высокие уровни IFN типа I снижают уровень IFNAR1, предположительно как негативный регуляторный механизм.Лиганд (IFN типа I) индуцирует фосфорилирование и убиквитинирование IFNAR1, что приводит к эндоцитозу рецептора и последующей деградации (21). Кроме того, стрессовая реакция эндоплазматического ретикулума (ER) может вызывать деградацию IFNAR1, что позволяет предположить, что уровень IFNAR1 важен для регуляции множественных клеточных состояний, опосредованных IFN I типа (22).
Сообщалось, что инфекции, вызываемые вирусами, такими как вирус везикулярного стоматита, вызывают деградацию IFNAR1, вызывая стрессовые реакции хозяина ER (22).Кроме того, вирус простого герпеса индуцировал деградацию IFNAR1 путем активации митоген-активируемой протеинкиназы p38 (MAPK), которая находилась ниже сигнального пути рецептора распознавания образов (23). Недавно было показано, что флавивирусы, в том числе вирус клещевого энцефалита и вирус Западного Нила, подавляют регуляцию IFNAR1 за счет взаимодействия протеина NS5 с пролидазой хозяина, что имеет решающее значение для эффективного распространения вируса (24). Эти результаты предполагают, что вирусы, а также хозяин имеют различные пути регуляции уровней IFNAR1.
Для того, чтобы установить эффективную инфекцию, IAV, по-видимому, разработал механизмы борьбы с системой IFN типа I (25–31). Сообщалось, что белки PB2 и PB1-F2 вируса гриппа ингибируют индукцию IFN типа I путем связывания с MAVS. Также было показано, что белок NS1 выполняет несколько функций в модуляции системы IFN хозяина. Например, NS1 предотвращает активацию RIG-I, ингибируя TRIM25-опосредованное убиквитинирование RIG-I (32). Таким образом, многие стратегии, которые использует IAV, по-видимому, мешают пути продукции IFN.Однако неизвестно, уклоняется ли и как IAV от IFNAR-опосредованного сигнального пути JAK / STAT.
В этом исследовании мы исследовали, регулирует ли IAV IFNAR1. Мы обнаружили, что IAV подавляет уровень IFNAR1 при заражении. Вирусная инфекция гриппа стимулировала фосфорилирование и убиквитинирование IFNAR1 для облегчения его деградации. Важно отметить, что белок НА вируса гриппа, как было показано, способствует убиквитинированию IFNAR1, вызывая его деградацию, что приводит к снижению поверхностного уровня IFNAR1.Следовательно, НА заметно ингибирует экспрессию IFN-индуцированных противовирусных генов.
МАТЕРИАЛЫ И МЕТОДЫ
Вирус и клетки. Вирус гриппа A / WSN / 33 (h2N1) был предоставлен Йошихиро Каваока (Университет Висконсина — Мэдисон). Вирус был амплифицирован на эпителиальных клетках собачьей почки Madin-Darby (MDCK), как описано в другом месте (33–35). Исследования вирусной инфекции и титрования проводили, как описано ранее (33, 36–38). Для заражения клетки инкубировали с IAV в течение 1 ч, а затем инкубировали со средой.Супернатанты, содержащие инфекционные вирусы, собирали для титрования с помощью анализа бляшек на клетках MDCK. Для анализа бляшек с использованием серийных разведений супернатантов культур вирусы адсорбировали на 2 × 10 5 клеток MDCK / мл в течение 1 ч, а затем клетки инкубировали с 2 × минимальной необходимой средой Игла (EMEM; Gibco), смешанной с равная часть 1% агарозы (SeaKem ME). Клетки 293 эмбриональной почки человека (HEK), клетки эпителия легких человека A549 и клетки Vero почки африканской зеленой мартышки культивировали в среде Игла, модифицированной Дульбекко (DMEM; Gibco), как описано в других источниках (35, 36, 39).Клетки MDCK культивировали в минимальной необходимой среде Eagle (MEM; Mediatech). Клетки эмбриональных фибробластов мыши (MEF) культивировали в среде DMEM с добавлением 1% l-глутамина (200 мМ; Gibco) и 1% раствора заменимых аминокислот MEM (Gibco). Люминесцентная пленка человека была получена коммерчески (Biological Specialty Corporation), и мононуклеарные клетки периферической крови (PBMC) были выделены градиентным центрифугированием с Ficoll (Sigma). Моноциты человека обогащали с использованием реагентов для отрицательной селекции человеческих моноцитов EasySep в соответствии с инструкциями производителя (Stem Cell Technologies).Человеческие моноциты дифференцировали в течение 6 дней в среде RPMI, содержащей рекомбинантный человеческий интерлейкин-4 (rhIL-4; 500 Ед / мл; Peprotech) и рекомбинантный человеческий гранулоцитарный макрофагальный колониестимулирующий фактор (rhGM-CSF; 1000 Ед / мл, лейкин; Genzyme ) (40). Клетки культивировали в инкубаторе CO 2 при 37 ° C, и все среды были дополнены 10% -ной эмбриональной сывороткой крупного рогатого скота (HyClone) и пенициллином (100 Ед / мл) -стрептомицином (100 мкг / мл) (Invitrogen).
Реагенты и антитела. Циклогексимид (CHX; Sigma-Aldrich), который использовали для блокирования синтеза белка, анти-DYKDDDDK (FLAG) G1 Affinity Resin (GenScript), ингибитор протеазы фенилметилсульфонилфторид (PMSF) (Gold Bio), иммунопреципитация ( IP) буфер для лизиса (Thermo Scientific), ингибитор протеасом MG132 (Fisher Scientific), ингибитор лизосом NH 4 Cl (Fisher Scientific) и рекомбинантные IFN-α и IFN-β человека (PBL Assay Science) были приобретены у указанных производителей. .Антитела против NP вируса гриппа, M2, IFNAR1 (41) и pIFNAR1 (S355 / S539) были приобретены у Abcam; антитело против NS1 вируса гриппа было приобретено в Санта-Крус; антитела против человеческого GAPDH (глицеральдегид-3-фосфатдегидрогеназа), α-субъединица эукариотического фактора инициации 2 (eIF2α), pelF2α, ISG15, ISG56, OAS1, TYK2, киназа, регулируемая внеклеточными сигналами (ERK), pERK, p38, p-p38 , STAT1, pSTAT1, STAT2, pSTAT2, FLAG-tag, Myc-tag и HA-tag были приобретены у Cell Signaling Technology; антитела против HA IAV h2N1, HA IAV h4N2, NA IAV H5N1 и HA птичьего IAV H5N1 были приобретены у GeneTex.
Конструкции и трансфекция. Ранее использовались экспрессионные плазмиды млекопитающих, кодирующие С-концевой 3 × FLAG-меченный IFNAR1 дикого типа (WT) и его некомпетентный к фосфорилированию мутант (IFNAR1-S535 / 539A) (22, 42, 43). Плазмиды для экспрессии млекопитающих, кодирующие 8 × HA-меченный убиквитин WT (tHA-Ub) и мутанты (tHA-Ub-K48 и tHA-Ub-K63), были предоставлены Марком Ханнинком (Университет Миссури — Колумбия) (44). Плазмида, кодирующая NS1 IAV A / Puerto Rico / 8/34 (h2N1), была предоставлена Адольфо Гарсиа-Састре (Медицинская школа Икана на горе Синай, Нью-Йорк, Нью-Йорк).Плазмиды, кодирующие вирусный гемагглютинин гриппа из вирусов гриппа A / New Caledonia / 20/99 (h2N1), A / Wisconsin / 67/2005 (h4N2) и A / Thailand / 1 (KAN-1) / 2004 (H5N1) и вирусную нейраминидазу (NA) из A / Thailand / 1 (KAN-1) / 2004 (H5N1) описаны в другом месте (45–47). Для создания конструкций HA1, меченных Myc, и HA2, меченных Myc, кодирующие последовательности HA1 и HA2 были амплифицированы с помощью ПЦР из ДНК полноразмерного HA вируса гриппа A / New Caledonia / 20/99 (h2N1), используя следующее соответствующие праймеры: HA1-F, 5′-CGG AAT TCG GAT GAA GGC CAA ACT GCT G-3 ‘и HA1-R, 5′-GGG GTA CCT CAT CTG CTC TGG ATG CTA GGG A-3′; HA2-F, 5’-CGG AAT TCG GGG ACT GTT TGG AGC CAT C-3 ‘и HA2-R, 5′-GGG GTA CCT CAG ATA CAG ATC CTG CAC TGC A-3’.Меченый Myc полноразмерный НА амплифицировали с помощью ПЦР с использованием праймеров HA1-F и HA2-R. Амплифицированные HA1, HA2 и полноразмерные HA-кодирующие ПЦР-фрагменты обрабатывали EcoRI / KpnI и вставляли в EcoRI / KpnI-расщепленный вектор pCMV-Myc-N (предоставленный Дэвидом Пинтелем из Университета Миссури — Колумбия). Нуклеотидные последовательности HA1, HA2 и полноразмерного HA в новых субклонах были подтверждены секвенированием ДНК. Для временной экспрессии в клетках HEK293 клетки трансфицировали плазмидами, кодирующими HA, NA или NS1, в концентрации 500 нг / мл, если не указано иное, с использованием реагента для трансфекции Lipofectamine 2000 (Thermo Scientific), следуя протоколам, рекомендованным производителем.Пустые контрольные векторные плазмиды использовали для гарантии того, что каждый образец трансфекции получил одинаковое количество общей ДНК. Для большинства экспериментов по трансфекции экспрессии НА использовали плазмиды, кодирующие НА вируса гриппа A / New Caledonia / 20/99 (h2N1), если не указано иное. Для временной экспрессии в MEF клетки трансфицировали плазмидами, кодирующими HA в концентрации 500 или 1000 нг / мл, или NA в концентрации 1000 нг / мл, используя реагент для трансфекции ДНК GenJet In Vitro для MEF (Ver.II) (SignaGen Laboratories) (48, 49) в соответствии с протоколом, рекомендованным производителем. Вкратце, трансфекционный комплекс получали при соотношении GenJet к ДНК 3: 1 (в микролитрах). Клетки MEF (10 6 ) суспендировали в комплексе для трансфекции и инкубировали при 37 ° C в течение 20 мин. В конце инкубации к клеткам добавляли два миллилитра предварительно нагретой среды. Затем клетки MEF высевали на 6-луночный планшет для культивирования. Эксперименты были независимо повторены трижды с аналогичными результатами.
Вестерн-блоттинг. Вестерн-блоттинг выполняли, как описано ранее (35, 36, 39). Вкратце, клетки лизировали в 2-кратном буфере для образцов, содержащем β-меркаптоэтанол, и нагревали при 95 ° C в течение 10 мин. Равные количества образцов белка разделяли на геле для электрофореза в 10% додецилсульфат-полиакриламидном геле (SDS-PAGE) и переносили на нитроцеллюлозную мембрану (Bio-Rad). Связанные с мембраной антитела детектировали с использованием субстрата усиленной хемилюминесценции (Thermo Scientific).Все представленные данные были повторены как минимум дважды с независимыми экспериментальными настройками.
Анализ иммунопреципитации и убиквитинирования. Для обнаружения убиквитинирования IFNAR1 во время инфекции IAV клетки HEK293 (10 6 ) трансфицировали FLAG-IFNAR1 (1 мкг) и tHA-Ub, tHA-Ub-K48 или tHA-Ub. -K63 (0,5 мкг). Через 24 часа после трансфекции клетки оставались неинфицированными или инфицированными IAV при множественности инфицирования (MOI), равной 1, в течение дополнительных 18 часов. MG132 (20 мкМ) и NH 4 Cl (10 мМ) добавляли за 5 ч до сбора урожая.Чтобы оценить убиквитинирование IFNAR1 при экспрессии НА, клетки HEK293 (10 6 ) трансфицировали FLAG-IFNAR1 (1 мкг) и tHA-Ub (0,5 мкг). Через 24 часа после трансфекции клетки трансфицировали либо контрольным вектором, либо увеличивающимися дозами плазмид НА, как указано. Клетки лизировали в 200 мкл буфера для лизиса, содержащего 1% SDS, и денатурировали кипячением при 95 ° C в течение 5 минут. Этот быстрый лизис инактивирует клеточные гидролазы убиквитина и, следовательно, сохраняет конъюгаты Ub-IFNAR1, присутствующие в клетках до IP.Эта процедура также нарушает белок-белковые взаимодействия, которые могут повлиять на результаты. Для экспериментов с IP эти клеточные лизаты разводили в 5 раз (конечный объем 1 мл) в обычном буфере для лизиса IP, содержащем ингибитор протеазы (PMSF, 1 мМ), и инкубировали с 20 мкл аффинной смолы Anti-DYKDDDDK G1 в течение ночи при вращении при 4 °. С. Гранулы трижды интенсивно промывали буфером для лизиса IP для удаления любых неспецифических связываний. Для анализа коиммунопреципитации (co-IP) клетки HEK293 (10 6 ) временно котрансфицировали HA, меченным Myc (500 нг), и либо контрольным вектором, либо IFNAR1, меченным FLAG (1 мкг).Клетки культивировали в течение 24 ч. MG132 (20 мкМ) и NH 4 Cl (10 мМ) добавляли за 5 ч до сбора урожая. Затем клетки лизировали в 1 мл обычного IP-буфера для лизиса и инкубировали с 20 мкл аффинной смолы Anti-DYKDDDDK G1. Гранулы промывали и осадки анализировали вестерн-блоттингом. Эксперименты были независимо повторены дважды с аналогичными результатами.
Проточный цитометрический анализ. Для определения поверхностных уровней IFNAR1 с помощью проточной цитометрии клетки HEK293 окрашивали конъюгированными с фикоэритрином (РЕ) мышиными моноклональными антителами против IFNAR1 человека (PBL Assay Science) в течение 1 ч, а затем дважды промывали.Данные собирали с помощью проточного цитометра CyAn ADP (Beckman Coulter) и анализировали с помощью программного обеспечения FlowJo (Treestar) (50). Аналогичные результаты были получены в трех независимых экспериментах.
Анализ репортерной люциферазы. Клетки HEK293 (2 × 10 5 ) котрансфицировали 250 нг интерферон-чувствительного ответного элемента (ISRE) промотор-репортерная плазмида люциферазы светлячка (подарок Джона Хискотта из Института Пастера), 10 нг pRL-CMV (Promega), кодирующая люциферазу Renilla в качестве контроля трансфекции, и либо плазмиды, кодирующие НА, либо контрольный вектор (250 нг).Через 24 часа после трансфекции клетки оставляли без обработки или обрабатывали rIFN-α в концентрации 20 или 100 Ед / мл в течение 24 часов. Затем клетки лизировали для измерения активности люциферазы Renilla и светлячка с использованием системы анализа двойной люциферазы-репортера (Promega) в соответствии с инструкциями производителя.
ПЦР в реальном времени. Общая клеточная РНК была очищена с использованием Tri Reagent (Sigma-Aldrich) в соответствии с инструкциями производителя и обработана ДНКазой I (Thermo Scientific) для удаления загрязненных ДНК.РНК подвергали обратной транскрипции с помощью случайного праймера (Invitrogen) или обратного праймера для NP IAV, а затем полученную кДНК анализировали с помощью количественной ПЦР в реальном времени (qPCR) с использованием ген-специфических праймеров. Праймеры для человеческого IFNAR1 (5′-CAC TTC TTC ATG GTA TGA GGT TGA CT-3 ‘и 5′-ATT GCC TTA TCT TCA GCT TCT AAA TGT-3′), GADD34 (5’-TCT TAT CCA CCA TCA CAC CG -3 ‘и 5′-CCT GGA GAC AAG GCA GAA GT-3′), CHOP (5’-CAC TCT TGA CCC TGC TTC TC-3 ‘и 5′-CTG GAA TCT GGA GAG TGA GG-3′), ISG15 (5’-CGC AGA TCA CCC AGA AGA TCG-3 ‘и 5′-TTC GTC GCA TTT GTC CAC CA-3′), ISG56 (5’-AGA AGC AGG CAA TCA CAG AAA A-3 ‘и 5’ -CTG AAA CCG ACC ATA GTG GAA AT-3 ‘), Mx1 (5′-GTT TCC GAA GTG GAC ATC GCA-3′ и 5’-CTG CAC AGG TTG TTC TCA GC-3 ‘), OAS1 (5’- GAT CTC AGA AAT ACC CCA GCC A-3 ‘и 5′-AGC TAC CTC GGA AGC ACC TT-3′) и IAV NP (5’-TGC TTC CAA TGA AAA CAT GG-3 ‘и 5’-GCC CTC TGT TGA TTG GTG TT-3 ‘).КПЦР выполняли с химическим анализом SYBR green I с использованием прибора для ПЦР в реальном времени StepOnePlus. Количества кДНК были нормализованы к количествам РНК GAPDH, измеренным в тех же образцах.
Статистический анализ. Все столбцы представляют собой средние значения, столбцы ошибок показывают стандартные ошибки средних значений (± SEM), а средние значения сравниваются с использованием двунаправленного непарного теста Стьюдента t . Данные представляют 2 или 3 независимых экспериментальных повтора.
РЕЗУЛЬТАТЫ
IAV индуцирует деградацию белка IFNAR1.Чтобы исследовать, изменяется ли экспрессия IFNAR1 во время инфекции IAV, мы контролировали уровни IFNAR1 после инфицирования IAV с помощью вестерн-блоттинга. После инфицирования уровни экспрессии IFNAR1 снизились в клетках HEK293 (фиг. 1A), клетках A549 (фиг. 1B), клетках Vero (фиг. 1C), дендритных клетках, происходящих из первичных моноцитов человека (DC) (фиг. 1D), и клетки эмбриональных фибробластов мыши (MEF) (фиг. 1E). Экспрессия IFNAR1 обратно коррелировала с повышенной репликацией IAV, которую оценивали по обнаружению вирусных NP или NS1 в клетках (рис.1A — E). Поскольку считается, что уровень IFNAR1 на поверхности клеток важен для передачи сигнала IFN типа I (20), мы измерили экспрессию IFNAR1, присутствующего на поверхности клеток, с помощью анализа проточной цитометрии. Подобно общему уровню IFNAR1, поверхностный уровень IFNAR1 был снижен инфекцией IAV как через 12 часов после инфицирования (hpi) (средняя интенсивность флуоресценции [MFI], от 235 до 170), так и через 24 часа на дюйм (MFI, от 235 до 146) (рис. 1F).
FIG 1IAV вызывает деградацию IFNAR1.(От A до E) клетки HEK293 (A), клетки A549 (B), клетки Vero (C), человеческие DC (D) и клетки MEF (E) не были инфицированы (Mock) или инфицированы вирусом гриппа A / WSN / 33 ( h2N1) вируса (IAV) с MOI, равным 1, в течение указанного времени. Уровни IFNAR1, вирусных NP и вирусных NS1 анализировали с помощью вестерн-блоттинга. Уровни GAPDH использовали в качестве внутреннего контроля загрузки. Относительные интенсивности для каждой полосы IFNAR1 определяли на основе уровней GAPDH с помощью денситометрии и отображали под каждым блотом. Относительные уровни IFNAR1 в неинфицированных образцах были установлены как 1.0. MW, молекулярная масса в тысячах. (F) Клетки HEK293 были либо оставлены неинфицированными (заштрихованная область), либо инфицированы IAV при MOI, равном 1. При 12 hpi (пунктирная линия) или 24 hpi (сплошная линия) клетки оставались неокрашенными (пунктирная линия) или окрашивались PE. -конъюгированные антитела против IFNAR1. Уровни поверхностной экспрессии IFNAR1 оценивали с помощью проточной цитометрии. Показана средняя интенсивность флуоресценции (MFI) каждого образца. Аналогичные результаты были получены в трех независимых экспериментах. (G) Клетки HEK293 были оставлены неинфицированными или инфицированными IAV при MOI 1.Относительные уровни мРНК IFNAR1 и вирусных NP анализировали с помощью кПЦР в реальном времени при 8 и 24 часах на дюйм. Планки погрешностей представляют собой средние значения ± стандартное отклонение, рассчитанные для трех реакций на образец. нс, не имеет значения. (H) Клетки HEK293 были неинфицированы или инфицированы IAV при MOI, равном 1. При 8 hpi клетки обрабатывали растворителем или циклогексимидом (CHX, 50 мкг / мл) в течение 0-4 часов, как указано. Уровни IFNAR1, вирусного NS1 и GAPDH анализировали с помощью вестерн-блоттинга. Показаны относительные интенсивности для каждой полосы IFNAR1.
Затем мы определили стадию, на которой произошло подавление IFNAR1. Уровни мРНК IFNAR1 в IAV-инфицированных и неинфицированных клетках сравнивали, выполняя обратную транскрипцию с последующей количественной ПЦР в реальном времени (qPCR). В отличие от уровней экспрессии белка, инфекция IAV не изменяла экспрессию мРНК IFNAR1 при 8 или 24 часах на дюйм (рис. 1G). Уровни вирусной РНК NP были показаны как инфекционный контроль (рис. 1G). Это говорит о том, что ингибирование экспрессии IFNAR1 происходило на посттранскрипционной стадии.Таким образом, мы контролировали стабильность белков IFNAR1, обрабатывая клетки циклогексимидом (CHX). Как показано на фиг. 1H, белок IFNAR1, по-видимому, со временем разлагается быстрее в IAV-инфицированных клетках, чем в неинфицированных клетках, что позволяет предположить, что инфекция сокращает период полужизни IFNAR1. В совокупности эти данные демонстрируют, что IAV подавляет уровень IFNAR1 за счет ускорения деградации белка IFNAR1.
Инфекция IAV запускает фосфорилирование и убиквитинирование IFNAR1. IFNAR1 может фосфорилироваться по сайтам серина 535/539 и убиквитинироваться в ответ на определенный тип стимуляции, что приводит к эндоцитозу и деградации IFNAR1 (21, 22, 51, 52).Таким образом, мы определили, способствует ли IAV фосфорилированию и убиквитинированию IFNAR1, чтобы вызвать деградацию рецептора. Для этой цели IFNAR1, меченный FLAG, который временно сверхэкспрессировался в клетках, подвергали иммунопреципитации, а затем оценивали статус фосфорилирования и убиквитинирования FLAG-IFNAR1 с помощью вестерн-блоттинга. Было показано, что инфекция IAV индуцирует фосфорилирование (S535 / S539) IFNAR1 и увеличивает уровень полиубиквитинирования IFNAR1 (фиг. 2A). Поскольку оба типа полиубиквитинирования, связанного с лизином 48 (K48) — и K63, важны для обеспечения эффективного удаления IFNAR1 (53), мы исследовали, участвуют ли оба типа полиубиквитинирования в IAV-опосредованном убиквитинировании IFNAR1.Чтобы исследовать это, были использованы две отдельные мутантные конструкции убиквитина, в которых все, кроме одного лизина (K48 или K63), были мутированы до остатков аргинина (44, 54). После инфицирования IAV конъюгация IFNAR1 с цепями убиквитина, содержащими только K48 или K63, а также цепями полиубиквитина увеличивалась (рис. 2B), что указывает на то, что инфекция индуцирует как связанные с K48, так и K63 события убиквитинирования. Затем мы определили, является ли фосфорилирование IFNAR1 S535 / S539 критическим для разложения IFNAR1, инициируемого IAV.Клетки трансфицировали конструкциями, экспрессирующими IFNAR1 дикого типа (WT) или IFNAR1 с мутацией сайта фосфорилирования, в которых Ser535 и Ser539 были мутированы до остатков аланина (S535 / 539A) (21). Мутация в сайте фосфорилирования (S535 / S539) блокирует последующее убиквитинирование и эндоцитоз IFNAR1, что приводит к деградации IFNAR1 (43, 55). Было показано, что мыши с нокаутом IFNAR1, у которых была мутация в сайте фосфорилирования мышиного IFNAR1, усиливали передачу сигналов IFN, что приводило к повышенной восприимчивости к экспериментальным воспалительным заболеваниям (56).Инфекция IAV заметно снижает экспрессию IFNAR1 дикого типа, тогда как уровень фосфорилирующего IFNAR1 (S535 / 539A) практически не изменяется после инфицирования (рис. 2C), что демонстрирует важность фосфорилирования в индуцированной вирусом деградации IFNAR1. Взятые вместе, эти данные показывают, что IAV способствует фосфорилированию (S535 / S539), а также K48- и K63-связанному полиубиквитинированию IFNAR1 для облегчения его деградации.
Рис. 2. ИнфекцияIAV индуцирует фосфорилирование и убиквитинирование IFNAR1.(A) Клетки HEK293 трансфицировали IFNAR1, меченным FLAG (FLAG-IFNAR1), или контрольным вектором и убиквитином, меченным НА (tHA-Ub). Через 24 часа после трансфекции клетки оставались неинфицированными или инфицированными IAV при MOI 1, как указано, в течение дополнительных 18 часов. Лизаты клеток подвергали эксперименту с денатурированным IP. Фосфорилирование и убиквитинирование иммунопреципитированного FLAG-IFNAR1 анализировали вестерн-блоттингом с использованием антител против HA tag (tHA) и против pIFNAR1 (S535 / 539). Также были проанализированы уровни tHA-Ub, вирусного HA и GAPDH в лизатах цельных клеток (нижние панели).(B) Клетки HEK293 трансфицировали указанными плазмидами, кодирующими FLAG-IFNAR1 или HA-меченный убиквитин дикого типа (WT) (tHA-Ub) или мутанты убиквитина (tHA-Ub-K48 или tHA-Ub-K63). Инфекцию и IP с последующим вестерн-блоттингом проводили, как описано для панели A, для обнаружения убиквитинирования и базальных уровней FLAG-IFNAR1. Выражения убиквитина в лизатах цельных клеток показаны на нижней панели. (C) Клетки HEK293 трансфицировали плазмидами, кодирующими IFNAR1-WT или IFNAR1-S535 / 539A, который является некомпетентным к фосфорилированию мутантом.Через 24 часа после трансфекции клетки не были инфицированы или инфицированы IAV при MOI 1 в течение 24 часов. Уровни экспрессии IFNAR1, NP вируса гриппа и GAPDH оценивали с помощью вестерн-блоттинга. MW, молекулярная масса в тысячах.
Подавление IFNAR1 имеет решающее значение для эффективной репликации IAV. Поскольку IFNAR1 необходим для запуска противовирусных реакций, опосредованных IFN I типа (12–14), расщепление IFNAR1 под действием IAV может быть полезным для репликации вируса. Также сообщалось, что ингибирование пути деградации убиквитин-протеасомы подавляет инфекцию и распространение IAV (57).Результаты предполагают, что IAV индуцирует зависимую от убиквитинирования деградацию клеточных белков, возможно, включая IFNAR1, для создания среды, оптимизированной для репликации вируса. Когда клетки обрабатывали MG132 (ингибитор протеасом), репликация IAV была нарушена (рис. 3A), что согласуется с опубликованным результатом (57). Ингибирование репликации вируса было связано с восстановлением экспрессии IFNAR1 (фиг. 3A).
Рис. 3.Восстановление экспрессии IFNAR1 ингибирует репликацию IAV.(A) Клетки HEK293 инфицировали IAV при MOI, равном 1, и культивировали в присутствии или в отсутствие MG132. Через 24 часа на дюйм уровни IFNAR1, вирусного M2 и GAPDH анализировали с помощью вестерн-блоттинга. (B — D) Клетки HEK293 трансфицировали контрольным вектором (-) или плазмидой, кодирующей FLAG-IFNAR1. Через 24 часа после трансфекции клетки инфицировали IAV при MOI, равном 1. Вестерн-блоттинг выполняли при 12 hpi для анализа уровней экспрессии NS1, NP, IFNAR1 и GAPDH (B). Через 24 часа на дюйм продукцию инфекционного IAV в супернатанте культуры оценивали с помощью анализа бляшек на клетках MDCK (C) ( n = 3 / группа; **, P ≤ 0.01). Экспрессию pSTAT1, STAT1, pSTAT2, STAT2, ISG56, OAS1 и GAPDH анализировали при 24 часах на дюйм (D). (E) Клетки HEK293 трансфецировали контрольным вектором (CTR) или плазмидами, кодирующими IFNAR1-WT с меткой FLAG или IFNAR1-S535 / 539A. Через 24 часа после трансфекции клетки инфицировали IAV при MOI 0,02. Вестерн-блоттинг выполняли при 60 hpi для анализа уровней экспрессии NS1, NP, IFNAR1 и GAPDH. (F) Клетки HEK293 трансфицировали контрольным вектором (CTR) или плазмидой, кодирующей IFNAR1-WT, меченный FLAG, или IFNAR1-S535 / 539A.Через 48 часов после трансфекции клетки инфицировали IAV при MOI 0,1. Титр инфекционного IAV в супернатантах культуры оценивали с помощью анализа бляшек на клетках MDCK при 60 hpi ( n = 4 / группа; *, P ≤ 0,05; **, P ≤ 0,01; ** **, P ≤ 0,0001). MW, молекулярная масса в тысячах.
Для дальнейшего изучения роли деградации IFNAR1 во время репликации IAV мы определили, влияет ли избыточная экспрессия IFNAR1 на репликацию IAV. С этой целью клетки трансфицировали плазмидой, кодирующей IFNAR1, или векторным контролем с последующим инфицированием IAV.Инфекция IAV подавляет IFNAR1; однако временная сверхэкспрессия IFNAR1 полностью восстанавливала общий уровень IFNAR1 в пределах 12 hpi (рис. 3B), хотя уровень IFNAR1, включая сверхэкспрессируемый IFNAR1, со временем снижается из-за инфекции, как показано на рис. 2. Важно отметить, что избыточная экспрессия (спасена) IFNAR1 ингибировал экспрессию вирусных белков, таких как NP и NS1, при инфицировании IAV (фиг. 3B). Кроме того, сверхэкспрессия IFNAR1 нарушала продукцию вирусов инфекционного гриппа из клеток (рис.3С). Затем мы исследовали, влияет ли избыточная экспрессия IFNAR1 на IFNAR-опосредованный сигнальный путь после инфекции. Фосфорилирование STAT1 и STAT2, которые являются важными факторами транскрипции, активируемыми после связывания IFN-IFNAR типа I, и уровни экспрессии ISG, таких как ISG56 и OAS1, повышались сверхэкспрессией IFNAR1 при IAV-инфекции (рис. 3D). Результаты показывают, что сверхэкспрессированный IFNAR1 проявляет активность против IAV за счет усиления сигнального пути IFN типа I.
Неспособный к фосфорилированию мутант IFNAR1 (S535 / 539A) не разлагается инфекцией IAV (фиг. 2C), тогда как эндогенные и сверхэкспрессированные белки IFNAR1 дикого типа со временем разрушаются после заражения (фиг. 1 и 2C). Таким образом, мы определили, проявляет ли сверхэкспрессия IFNAR1 (S535 / 539A) более сильную противовирусную активность, чем IFNAR1 дикого типа. Поскольку требуется время, чтобы временно сверхэкспрессируемый белок IFNAR1 дикого типа был расщеплен инфекцией IAV, противовирусная активность белка дикого типа и мутантного IFNAR1 была проанализирована при 60 hpi.Было показано, что эндогенный и временно сверхэкспрессируемый IFNAR1 дикого типа явно разлагается инфекцией IAV, тогда как IFNAR1 (S535 / 539A) оказался устойчивым к разложению, индуцированному IAV (фиг. 3E). Сверхэкспрессированный IFNAR1 (S535 / 539A) подавлял как экспрессию вирусного белка (фиг. 3E), так и продукцию инфекционного IAV из клеток сильнее, чем IFNAR1 дикого типа (фиг. 3F). Данные дополнительно демонстрируют, что деградация IFNAR1 важна для эффективной репликации IAV.
Белок гемагглютинин IAV индуцирует деградацию IFNAR1.Сообщалось, что лечение IFN типа I может вызвать интернализацию IFNAR1 с последующей деградацией рецептора (21). Однако IAV снижает уровни IFNAR1 в клетках Vero (рис. 1C), которые не могут синтезировать IFN типа I, что позволяет предположить, что деградация IFNAR1 не происходит главным образом из-за IFN типа I, продуцируемых инфекцией. Затем мы предположили, что вирусный белок (белки) гриппа вызывает разложение IFNAR1, что создает благоприятную среду для репликации вируса. Поскольку белок NS1 вируса гриппа выполняет несколько функций, чтобы избежать ответов IFN типа I (58), возможную роль NS1 в деградации IFNAR1 исследовали путем временной экспрессии белка NS1 IAV.Однако NS1 не смог подавить IFNAR1 (фиг. 4A), что указывает на то, что NS1 не отвечает за деградацию IFNAR1 во время инфицирования вирусом гриппа. Гликозилирование белков происходит в сети ER-Golgi и часто участвует в стрессовых ответах ER (59), которые также могут вызывать деградацию IFNAR1 (22). Поэтому мы проверили, регулируют ли гликопротеины вируса гриппа A, то есть гемагглютинин (HA) и нейраминидаза (NA), экспрессию IFNAR1. Интересно, что временно экспрессируемая НА значительно снижает уровень IFNAR1, тогда как белок NA гриппа не влияет на экспрессию IFNAR1 (рис.4А). Степень ингибирования IFNAR1 зависела от уровня экспрессии вирусного НА (фиг. 4B). Кроме того, НА вируса гриппа снижала поверхностный уровень IFNAR1 (MFI, с 1140 до 593), тогда как вирусные NA и NS1 не подавляли IFNAR1 с поверхности клетки, что было измерено с помощью проточного цитометрического анализа (фиг. 4C). Кроме того, экспрессия HA, но не NA, снижает уровни IFNAR1 в MEF (фиг. 4D), предполагая, что HA-опосредованное ингибирование IFNAR1 происходит как в человеческих, так и в мышиных клетках.Чтобы определить, обладает ли ингибирующая активность HA специфичностью подтипа, мы протестировали белки HA из трех различных вирусов гриппа A: A / New Caledonia / 20/99 (h2N1) и A / Wisconsin / 67/2005 (h4N2), оба из которых являются которые использовались в качестве вакцинных штаммов для людей в 2006-2007 гг., а также высокопатогенного вируса гриппа A / Thailand / 1 (KAN-1) / 2004 (H5N1) (рис. 4E). Все белки НА из этих подтипов были способны сильно снижать уровни эндогенного белка IFNAR1 (рис. 4E). Поскольку HA расщепляется на субъединицы HA1 и HA2 во время созревания, мы создали конструкции, кодирующие HA1 и HA2, из полноразмерного HA штамма A / New Caledonia / 20/99 (h2N1).Мы обнаружили, что временная экспрессия HA1, но не субъединицы HA2, может заметно снижать уровень IFNAR1 (рис. 4F). В совокупности эти данные указывают на то, что НА вируса гриппа отрицательно модулирует клеточные уровни IFNAR1.
Рис. 4.НА вируса гриппа негативно регулирует экспрессию IFNAR1. (A) Клетки HEK293 трансфицировали контрольным вектором (CTR) или плазмидами, кодирующими NS1 вируса гриппа A / Puerto Rico / 8/34 (h2N1), HA вируса гриппа A / New Caledonia / 20/99 (h2N1), которые был использован для большинства экспериментов по временной экспрессии НА, если не указано иное, или NA вируса гриппа A / Thailand / 1 (KAN-1) / 2004 (H5N1).Через 24 часа после трансфекции уровни IFNAR1, NS1, HA, NA и GAPDH анализировали вестерн-блоттингом. (B) Клетки HEK293 трансфицировали контрольным вектором (CTR) или возрастающими дозами HA-кодирующих плазмид (125, 250, 500 или 1000 нг / мл). Через 24 часа после трансфекции проводили вестерн-блоттинг для определения уровней IFNAR1, HA и GAPDH. (C) Клетки HEK293 трансфицировали контрольной плазмидой (CTR) (заштрихованная область) или плазмидами, кодирующими HA (сплошная линия), NA (короткая пунктирная линия) или NS1 (длинная пунктирная линия).Через 24 часа после трансфекции клетки оставляли неокрашенными (пунктирная линия) или окрашивали PE-конъюгированным антителом против IFNAR1. Уровни IFNAR1 на поверхности клеток оценивали с помощью проточной цитометрии. Показаны МФО. (D) Клетки MEF трансфицировали контрольным вектором (CTR), HA (0,5 или 1,0 мкг / мл) или NA (1,0 мкг / мл). Через двадцать четыре часа был проведен вестерн-блоттинг для обнаружения белков IFNAR1, HA, NA и GAPDH. Эксперимент повторили трижды с аналогичными результатами. (E) Клетки HEK293 трансфицировали контрольным вектором (CTR) или плазмидами, кодирующими белки HA из различных штаммов IAV (как указано на нижней панели, №1-3). Уровни IFNAR1, HA и GAPDH анализировали через 24 часа после трансфекции с помощью вестерн-блоттинга. Относительные интенсивности для каждой полосы IFNAR1 определяли на основе уровня GAPDH с помощью денситометрии и отображены под каждым блотом. Относительный уровень белка IFNAR1 из образца, трансфицированного контрольным вектором, был установлен как 1,0. (F) Клетки HEK293 трансфицировали контрольным вектором (CTR) или плазмидами, кодирующими HA1 с меткой Myc или HA2 с меткой Myc. Уровни IFNAR1, Myc-HA1, Myc-HA2 и GAPDH анализировали с помощью вестерн-блоттинга.MW, молекулярная масса в тысячах.
Чтобы понять механизм, с помощью которого белок HA регулирует экспрессию IFNAR1, уровень мРНК IFNAR1 был проанализирован после экспрессии HA. Подобно результату, полученному при заражении IAV, экспрессия НА не изменяла уровень мРНК IFNAR1 (фиг. 5A). Чтобы определить, индуцирует ли HA деградацию IFNAR1, клетки обрабатывали CHX в течение 3 часов перед сбором клеток через 19 часов после трансфекции плазмидой, кодирующей HA. Временные точки были выбраны потому, что HA-опосредованное снижение IFNAR1 было умеренным без обработки CHX в это время (<20 часов после трансфекции), что позволило нам сравнить деградацию IFNAR1 в условиях отсутствия лечения и лечения CHX.Обработка CHX снижает уровень IFNAR1 более сильно в присутствии белка HA (фиг. 5B), указывая на то, что HA снижает стабильность белка IFNAR1. Однако вирусная NA не влияла на деградацию IFNAR1 в тех же экспериментальных условиях. Действительно, только НА вируса гриппа стимулировало полиубиквитинирование IFNAR1 (фиг. 5C), даже несмотря на то, что базальный уровень иммунопреципитированного IFNAR1 был намного ниже в присутствии белка HA. Кроме того, мы обнаружили, что НА может существенно снижать уровень IFNAR1 дикого типа, но не мутант IFNAR1, не способный к фосфорилированию (S535 / 539A) (рис.5D), указывая на то, что фосфорилирование IFNAR1 имеет решающее значение для этой деградации. Таким образом, большинство результатов, полученных при заражении IAV, были обобщены, когда вирусный белок HA экспрессировался временно.
FIG 5HA гриппа нацелена на расщепление IFNAR1. (A) Клетки HEK293 трансфицировали контрольным вектором (CTR) или НА. Уровни мРНК IFNAR1 анализировали с помощью кПЦР в реальном времени через 24 часа после трансфекции. Планки погрешностей представляют собой стандартные отклонения, оцененные в трех независимых экспериментах.(B) Клетки HEK293 трансфицировали контрольным вектором (CTR), HA или NA, как указано. Через 16 часов после трансфекции клетки обрабатывали растворителем или CHX в концентрации 50 мкг / мл в течение 3 часов. Уровни IFNAR1, HA, NA и GAPDH анализировали с помощью вестерн-блоттинга. Относительные интенсивности для каждой полосы IFNAR1 определяли на основе уровней GAPDH с помощью денситометрии и отображены под каждым блотом. (C) Клетки HEK293 трансфицировали FLAG-IFNAR1 или контрольным вектором и tHA-Ub. Через 24 часа после трансфекции клетки трансфицировали либо контрольным вектором (CTR), либо двумя дозами (250 и 500 нг / мл) НА, как указано.Клетки инкубировали еще 16 часов. Уровни убиквитинирования FLAG-IFNAR1 анализировали IP с последующим вестерн-блоттингом с антителом против tHA. Лизаты цельных клеток анализировали для измерения уровней IFNAR1, tHA-Ub вирусного НА и GAPDH, которые показаны на нижних панелях. (D) Клетки HEK293 трансфицировали HA или NA и плазмидами, кодирующими IFNAR1-WT или IFNAR1-S535 / 539A. Через 24 часа после трансфекции лизаты цельных клеток из каждого образца анализировали вестерн-блоттингом для обнаружения IFNAR1, HA, NA и GAPDH.Относительные интенсивности для каждой полосы IFNAR1 определяли на основе уровня GAPDH и отображены под каждым блотом. (E) Клетки HEK293 трансфицировали контрольным вектором (CTR) или НА, как указано. Через 18 часов после трансфекции клетки обрабатывали указанным ингибитором (ами) или растворителем (диметилсульфоксид [ДМСО]) в течение дополнительных 6 часов. Уровни IFNAR1, HA и GAPDH оценивали с помощью вестерн-блоттинга. Относительные интенсивности для каждой полосы IFNAR1 определяли на основе уровня GAPDH с помощью денситометрии.MW, молекулярная масса в тысячах.
Существует два различных пути деградации белков, т.е. протеасомозависимый и лизосомозависимый механизмы. Когда клетки экзогенно снабжались либо MG132 (ингибитор протеасом), либо NH 4 Cl (ингибитор лизосом), активность HA в индукции деградации IFNAR1 была частично подавлена (фиг. 5E). Совместная обработка клеток MG132 / NH 4 Cl дополнительно ингибировала HA-индуцированную деградацию IFNAR1. Эти результаты предполагают, что оба пути вносят вклад в HA-опосредованную деградацию IFNAR1.
HA-опосредованная деградация IFNAR1 не вызвана клеточной стрессовой реакцией ER. Возможно, что IAV HA взаимодействует с IFNAR1, вызывая деградацию IFNAR1. Чтобы проверить это, был проведен эксперимент по совместному IP. Однако IAV HA, по-видимому, не связывается с IFNAR1, тогда как IFNAR1 взаимодействует с эндогенным Tyk2, как сообщается (19, 60) (фиг. 6A).
FIG 6HA не взаимодействует с IFNAR1 и не вызывает активации стрессового ответа ER на деградацию IFNAR1. (A) Клетки HEK293 трансфицировали HA, меченным Myc, и либо контрольным вектором (-), либо IFNAR1, меченным FLAG (FLAG-IFNAR1).Co-IP проводили с использованием аффинной смолы против FLAG, и антитела против TYK2 и против Myc использовали для обнаружения эндогенного TYK2 и HA, меченного Myc, соответственно. Уровни Myc-HA, TYK2 и GAPDH в лизатах цельных клеток также определяли вестерн-блоттингом (нижняя панель). (B) Клетки HEK293 трансфицировали контрольным вектором (CTR) или возрастающими дозами HA-кодирующих плазмид (250, 500 или 1000 нг / мл). Через 24 часа после трансфекции клетки собирали для определения уровней IFNAR1, HA, pelF2α, elF2α и GAPDH с помощью вестерн-блоттинга.(C, D) Клетки HEK293 трансфицировали контрольным вектором (CTR) или НА. Уровни экспрессии мРНК GADD34 (C) и CHOP (D) анализировали с помощью кПЦР в реальном времени через 24 часа после трансфекции. Планки погрешностей представляют собой стандартные отклонения, рассчитанные для трех реакций на образец. нс, не имеет значения. (E) Клетки HEK293 трансфицировали контрольной плазмидой (CTR) или НА. Через 3, 6, 12 и 24 часа после трансфекции клетки собирали для оценки уровней IFNAR1, pERK, ERK, p-p38, p38, HA и GAPDH с помощью вестерн-блоттинга.MW, молекулярная масса в тысячах.
Убиквитинирование, ведущее к деградации IFNAR1, индуцируется IFN типа I или клеточным стрессовым ответом ER, известным как ответ развернутого белка (UPR) (21, 22). Экспрессия одного НА не индуцирует IFN типа I (данные не показаны). Сообщалось, что стрессовая реакция ER, которая вызывает деградацию IFNAR1, активирует протеинкиназу R (PKR) -подобную ER-киназу (PERK), которая фосфорилирует α-субъединицу фактора инициации 2 эукариот (eIF2α), что приводит к увеличению набора специфических генов. такие выражения, как CHOP и GADD34 (22, 61).Чтобы выяснить, разрушает ли НА вируса гриппа IFNAR1, вызывая стрессовую реакцию ER, мы оценили экспрессию и активацию eIF2α в присутствии или в отсутствие НА. Хотя HA снижал экспрессию IFNAR1 зависимым от концентрации образом, уровни фосфорилированной формы eIF2α, а также белка eIF2α оставались постоянными независимо от экспрессии HA (фиг. 6B). Кроме того, когда экспрессия GADD34 (фиг. 6C) и CHOP (фиг. 6D), гены которых расположены ниже пути PERK, оценивались с помощью qPCR, они не изменялись по экспрессии HA.
Также сообщалось, что стрессовая реакция ER запускает активацию митоген-активируемой протеинкиназы p38 (MAPK), которая имеет решающее значение для деградации IFNAR1 (62). Поэтому мы исследовали, активирует ли НА вируса гриппа путь (пути) MAPK, измеряя фосфорилирование p38 и киназы, регулируемой внеклеточными сигналами (ERK). Уровень IFNAR1 начал снижаться между 6 и 12 часами после трансфекции плазмидами, кодирующими НА. Однако экспрессия только HA не влияла на базальные уровни или уровни фосфорилирования p38 или ERK с течением времени (рис.6E). Эти наблюдения привели нас к выводу, что белок HA IAV не индуцирует стрессовую реакцию ER для разрушения IFNAR1.
HA вируса гриппа ослабляет клеточный ответ на IFN типа I. Уровни IFNAR1 на поверхности клеток могут влиять на клеточную чувствительность к лиганду IFN-α / β (21, 43, 52, 53). Учитывая способность HA снижать поверхностные уровни IFNAR1, мы стремились получить представление о регуляторной функции HA в пути передачи сигналов, опосредованном IFN I типа. Во-первых, мы исследовали активацию STAT1 и STAT2 в ответ на IFN типа I в присутствии или в отсутствие экспрессии HA.Экзогенное добавление рекомбинантного IFN-α (rIFN-α) вызывало активацию STAT1, о чем свидетельствует повышенный уровень pSTAT1 (фиг. 7A). Однако экспрессия НА сильно ингибирует индуцированное IFN фосфорилирование STAT1. Денситометрический анализ показал, что уровень pSTAT1 снижался примерно на 60% через 60 мин после стимуляции rIFN-α в HA-экспрессирующих клетках по сравнению с таковым в контрольных клетках (фиг. 7A). Кроме того, активация STAT2, индуцированная rIFN-α, сильно подавлялась HA (фиг. 7A). Ингибирование rIFN-α-индуцированного фосфорилирования STAT1 / STAT2 с помощью HA коррелировало с подавлением IFNAR1.Чтобы дополнительно проверить связь между HA-опосредованной деградацией IFNAR1 и ингибированием STAT, клетки обрабатывали MG132 и NH 4 Cl в присутствии экспрессии HA. Ингибирование путей деградации белка восстановило экспрессию IFNAR1 и восстановило активацию STAT1 и STAT2 в ответ на rIFN-α даже в присутствии высоких уровней HA (фиг. 7A).
Рис. 7НА вируса гриппа делает клетки менее чувствительными к IFN типа I. (A) Клетки HEK293 трансфицировали контрольным вектором (CTR) или НА, как указано.Через 18 часов после трансфекции клетки обрабатывали растворителем (ДМСО) или MG132 / NH 4 Cl, как указано, в течение дополнительных 6 часов. Затем клетки оставляли необработанными или обрабатывали рекомбинантным человеческим IFN-α (rIFN-α, 100 Ед / мл) в течение указанного времени. Уровни pSTAT1, pSTAT2, STAT1, STAT2, IFNAR1, HA и GAPDH анализировали с помощью вестерн-блоттинга. Относительные интенсивности для каждой полосы pSTAT1 и pSTAT2 определяли на основе уровня GAPDH с помощью денситометрии. Уровень pSTAT1 и pSTAT2 из контрольного образца, трансфицированного вектором, при обработке rIFN-α в течение 60 мин был установлен как 1.0. (B) Клетки HEK293 котрансфицировали репортерной плазмидой ISRE промотор-люцифераза, люциферазной плазмидой Renilla и либо контрольным вектором (CTR), либо плазмидой, кодирующей HA. Через 24 часа после трансфекции клетки оставляли необработанными (-) или обрабатывали rIFN-α (20 Ед / мл или 100 Ед / мл) в течение 24 часов. Затем клетки анализировали на относительную активность люциферазы (Luc. Act.). Планки погрешностей представляют собой стандартные отклонения, полученные для трех образцов на группу (***, P ≤ 0,001; ****, P ≤ 0,0001). (C, D, E и F) Клетки HEK293 трансфицировали контрольным вектором (CTR) или плазмидами, кодирующими НА вируса гриппа A / Thailand / 1 (KAN-1) / 2004 (H5N1).Через 24 часа после трансфекции клетки оставляли необработанными (-) или обрабатывали rIFN-α в концентрации 1000 Ед / мл. Относительные уровни экспрессии мРНК ISG15 (C), ISG56 (D), Mx1 (E) и OAS1 (F) анализировали с помощью кПЦР в реальном времени через 24 часа после обработки. Планки погрешностей представляют собой стандартные отклонения, полученные для трех реакций на образец. (G) Клетки HEK293 трансфицировали контрольным вектором (CTR) или НА, как указано. Через 24 часа после трансфекции клетки оставляли без обработки или обрабатывали rIFN-α в указанных концентрациях в течение следующих 24 часов.Уровни белка ISG56, ISG15, IFNAR1, HA и GAPDH оценивали с помощью вестерн-блоттинга. (H) Клетки HEK293 трансфицировали контрольным вектором (CTR) или плазмидами, кодирующими НА вируса гриппа A / Thailand / 1 (KAN-1) / 2004 (H5N1), как указано. Через 24 часа после трансфекции клетки оставляли без обработки или обрабатывали rIFN-α в указанных концентрациях в течение следующих 24 часов. Уровни белка ISG56, IFNAR1, HA и GAPDH оценивали с помощью вестерн-блоттинга. (I) Клетки HEK293 снабжали rIFN-β в присутствии или в отсутствие НА.Экспрессию ISG56, IFNAR1, HA и GAPDH анализировали, как описано для панели H. MW, молекулярные массы в тысячах.
Индуцированная IFN экспрессия противовирусных ISG типа I через промотор ISRE важна для контроля репликации вируса. Таким образом, мы определили, регулирует ли НА вируса гриппа экспрессию этих генов. Во-первых, промоторная активность ISRE в ответ на IFN типа I была измерена с помощью люциферазного репортерного анализа. После обработки rIFN-α относительная активность промотора ISRE заметно подавлялась экспрессией HA (рис.7Б). Во-вторых, профили транскрипции ISG, таких как ISG15, ISG56, Mx1 и OAS1 в ответ на rIFN-α в присутствии или в отсутствие HA, анализировали с помощью qPCR (фиг. 7C-F). Было показано, что НА вируса гриппа существенно подавляет экспрессию мРНК ISG15, ISG56, Mx1 и OAS1, запускаемую rIFN-α. Наконец, мы оценили уровни белка ISG56 и ISG15 с помощью вестерн-блоттинга. В соответствии с результатами анализа мРНК накопление белков ISG56 и ISG15, вызванное rIFN-α, было заметно подавлено в клетках, экспрессирующих HA IAV, по сравнению с контрольными клетками (рис.7G). Аналогичный результат был получен при использовании HA гриппа A / Thailand / 1 (KAN-1) / 2004 (H5N1) (рис. 7H). Кроме того, опосредованная rIFN-β экспрессия ISG56 ингибировалась экспрессией НА (фиг. 7I). В совокупности эти результаты указывают на то, что НА вируса гриппа значительно снижает клеточную чувствительность к IFN типа I, запуская IFN-опосредованный сигнальный путь I типа.
ОБСУЖДЕНИЕ
Наше исследование демонстрирует, что вирус гриппа вызывает деградацию клеточного рецептора IFN типа I, мощных противовирусных молекул.Важно отметить, что вирусный белок НА вызывает разложение IFNAR1, что приводит к сильному подавлению клеточной чувствительности к IFN типа I.
Вирус гриппа, по-видимому, разработал различные стратегии для вмешательства в производство IFN типа I. Например, сообщалось, что белки вируса гриппа, такие как NS1, PB2 и PB1-F2, обладают способностью нарушать сигнальные пути синтеза IFN типа I (25–27, 32, 63). Однако полная блокада выработки IFN вирусом гриппа представляется сложной, поскольку IFN типа I может быть обнаружен во многих экспериментальных системах и у пациентов, инфицированных вирусом гриппа (64, 65).IFN секретируются и связываются с родственным рецептором (IFNAR), чтобы активировать сигнальный путь JAK / STAT, тем самым индуцируя экспрессию ISG (17-19). Белок NS1 вируса гриппа может ингибировать активацию нескольких ISG, индуцированных IFN типа I (66–68). Однако существуют различные ISG, которые могут подавлять репликацию вируса гриппа, включая Mx1, ISG15, ISG56 и OAS. Следовательно, деградация IFNAR1 в клетках, инфицированных вирусом гриппа, может быть высокоэффективным способом избежать противовирусной активности IFN типа I путем десенсибилизации клеток к IFN, т.е.е., подавление экспрессии ISG.
Известно, что многие вирусы с РНК с отрицательной цепью запрещают активацию / транслокацию STAT, препятствуя экспрессии ISG. Белок С вируса Сендай и белок V вируса кори предотвращают фосфорилирование STAT1 / 2 (69–73). Белки V вирусов Nipah и Hendra блокируют ядерную транслокацию белков STAT1 / 2, тем самым блокируя транскрипцию ISG (74, 75). Однако неизвестно, регулируют ли белки вируса гриппа напрямую активацию STAT1 / 2. В этом исследовании было показано, что белок НА вируса гриппа ослабляет клеточные ответы на IFN, воздействуя на рецептор IFN типа I для деградации.Эта стратегия могла бы эффективно подавлять опосредованную рецептором IFN передачу сигналов JAK / STAT, что могло бы создать клеточную среду, благоприятную для репликации и размножения вируса гриппа.
Было показано, что инфекция вирусом гриппа активирует путь инозитол-требующего фермента 1 (IRE1) стрессового ответа ER с небольшой сопутствующей активацией пути PERK или без нее (76). Наше исследование также показало, что HA вируса гриппа не запускает сигнальный путь PERK стрессового ответа ER (рис.6). Кроме того, было документально подтверждено, что активация p38 MAPK имеет решающее значение как для ответа на стресс ER, так и для опосредованной TLR4 / 9 деградации IFNAR1 (23, 62). Однако активация p38 MAPK не наблюдалась после экспрессии НА (фиг. 6E). Было показано, что латентные мембранные белки вируса Эпштейна-Барра LMP2A и LMP2B снижают общий уровень IFNAR1 без изменения поверхностного уровня IFNAR1 (77). Белок NS5 флавивируса индуцировал подавление IFNAR1 на поверхности клетки, взаимодействуя с клеточной пролидазой (24).Однако неясно, способствуют ли эти вирусные белки фосфорилированию или убиквитинированию рецепторов для облегчения деградации. Мы обнаружили, что HA-опосредованная деградация IFNAR1 вируса гриппа зависела от фосфорилирования IFNAR1, и действительно, HA стимулировало убиквитинирование IFNAR1, которое, как известно, индуцирует эндоцитоз и деградацию этого рецептора, экспрессируемого на поверхности клетки. Кроме того, исследования ингибиторов предполагают, что HA-опосредованная деградация IFNAR1 происходит как через протеасомные, так и через лизосомозависимые пути.
После инфицирования вирусом гриппа A сверхэкспрессируемый IFNAR1 часто имел более низкую молекулярную массу (рис. 2B). Однако временная экспрессия HA не влияла на размер IFNAR1, что позволяет предположить, что HA не несет ответственности за опосредованное инфекцией изменение молекулярной массы IFNAR1. Поскольку IFNAR1 гликозилирован по множеству сайтов и пальмитоилирован (78, 79), вирусная инфекция может регулировать процесс посттрансляционной модификации. Механизм этого явления требует дальнейшего изучения.
Сообщалось, что некоторые вирусы вызывают деградацию противовирусных факторов хозяина, манипулируя путем убиквитинирования хозяина. Например, связанный с саркомой герпесвирус Капоши разрушает главный комплекс гистосовместимости класса I (MHC-I) вирусными белками K3 и K5, которые действуют как убиквитинлигазы E3 (80, 81). Белок Vpu ВИЧ-1 связывается с противовирусным белком тетерином, что способствует его деградации (82, 83). Это побудило нас проверить, взаимодействует ли HA вируса гриппа с IFNAR1, чтобы вызвать его убиквитинирование и деградацию.Однако прямого связывания между HA и IFNAR1 в эксперименте по совместному IP не наблюдалось (фиг. 6A). Тем не менее, все еще возможно, что НА регулирует связывание IFNAR1 с киназами, убиквитиназой или еще не идентифицированными клеточными белками, способствуя деградации IFNAR1. Следовательно, точные механизмы, с помощью которых НА вируса гриппа регулирует активацию и взаимодействие киназ и компонентов убиквитиназы, еще предстоит изучить.
HA вируса гриппа — это основной гликопротеин, обнаруживаемый на поверхности вирусной частицы, который является основной мишенью нейтрализующих антител против вируса гриппа.Функция HA в прикреплении вируса и слиянии мембран хорошо известна (84, 85). Короче говоря, НА связывается с рецепторами клеток-мишеней, содержащими сиаловую кислоту, и опосредует высвобождение вирусного генома в цитоплазму, вызывая слияние эндосомальной мембраны хозяина с вирусной мембраной. Кроме того, сообщалось, что накопление в мембранах белка НА гриппа и его ассоциация с доменами липидных рафтов важны для запуска активации ERK MAPK, которая усиливает ядерный экспорт вирусных рибонуклеопротеидных комплексов и, таким образом, увеличивает репликацию вируса (86, 87). .Однако после экспрессии только HA не наблюдалось значительного увеличения уровня фосфорилированной ERK в наших экспериментальных условиях (фиг. 6E), что позволяет предположить, что HA-индуцированная деградация IFNAR1 не связана с активацией ERK MAPK.
Хотя HA является важным детерминантом вирусной патогенности, роль HA в модуляции врожденных иммунных ответов хозяина не исследовалась. Представленные здесь результаты подчеркивают недавно обнаруженную регуляторную функцию HA вируса гриппа как антагониста ответов IFN типа I, которые влияют на систему защиты хозяина.Изучение вирусных механизмов регуляции IFNAR вируса гриппа может помочь нам лучше понять взаимодействие между вирусом гриппа и врожденной иммунной системой хозяина и может стать основой для разработки инновационных подходов к лечению гриппа.
БЛАГОДАРНОСТИ
Мы благодарим Йошихиро Каваока (Университет Висконсина — Мэдисон), Адольфо Гарсиа-Састре (Медицинская школа Икана на горе Синай), Дэвида Пинтела (Университет Миссури — Колумбия), Джона Хискотта (Пастер) и Марка Ханнинка. (Университет Миссури — Колумбия) за предоставление исследовательских реагентов, как описано в разделе «Материалы и методы».Также мы благодарим центр Cell & Immunology Core Университета Миссури — Колумбия.
СНОСКИ
- Получено 27 октября 2015 г.
- Принято 8 декабря 2015 г.
- Рукопись принята, размещена в Интернете 16 декабря 2015 г.
- Адресная корреспонденция Bumsuk Hahm, hahmb {at} health.missouri.edu.
Citation Xia C, Vijayan M, Pritzl CJ, Fuchs SY, McDermott AB, Hahm B. 2016. Гемагглютинин вируса гриппа A противодействует ответам интерферона I типа (IFN), вызывая деградацию рецептора IFN 1 типа I.J Virol 90: 2403–2417. DOI: 10.1128 / JVI.02749-15.
- Авторские права © 2016, Американское общество микробиологии. Все права защищены.
Цитокиновый шторм при COVID-19: патогенез и обзор противовоспалительных средств, используемых в лечении
Коронавирусная болезнь 2019 (COVID-19) — это клинический синдром, вызванный мутационным РНК-вирусом, названным вирусом тяжелого острого респираторного синдрома CoronaVirus 2 (SARS-CoV-2). Первоначально возникнув в Китае в декабре 2019 года, он распространился по всему миру и признан Всемирной организацией здравоохранения (ВОЗ) пандемией 11 марта 2020 года.SARS-CoV-2 — это бета-коронавирус, похожий на два других коронавируса, вызывающих смертельные инфекции в течение последних двух десятилетий, то есть вирус короны тяжелого острого респираторного синдрома (SARS-CoV) и вирус короны ближневосточного респираторного синдрома (MERS-CoV). ) [1].
Хотя инфекции SARS-CoV-2 могут протекать бессимптомно или вызывать только легкие симптомы в большинстве случаев и менее смертельны, чем инфекции MERS-CoV, они могут прогрессировать до интерстициальной пневмонии и острого респираторного дистресс-синдрома (ARDS) почти в 10– 20% случаев, особенно у лиц пожилого возраста и сопутствующих заболеваний.Эта подгруппа пациентов отличается очень высокими уровнями сывороточного ферритина и D-димера, печеночной дисфункцией, тенденцией к тромбообразованию и диссеминированным внутрисосудистым свертыванием (ДВС), предполагающим возникновение синдрома активации макрофагов (MAS), также известного как вторичный гемофагоцитарный лимфогистиоцитоз ( sHLH) [2, 3]. Подобные клинические и лабораторные данные были также зарегистрированы у пациентов с инфекциями SARS-CoV и MERS-CoV [1, 2].
В этом контексте мы стремились рассмотреть инфекцию COVID-19, уделяя особое внимание ее связи с цитокиновым штормом.С этой целью в период с 11 по 26 апреля 2020 г. проводился поиск в PubMed и Google Academic. Исходные данные всех исследований (включая отчеты о случаях и серии случаев), которые касались определения, причин и классификации COVID-19 и гемофагоцитоза, MAS, гемофагоцитоза. лимфогистиоцитоз и цитокиновый шторм, опубликованные на английском языке в рецензируемых журналах, были включены. Дополнительный поиск полнотекстовых статей с теми же ключевыми словами был выполнен в базах данных, на которые подписан Университет Алтынбаша.
Результаты нашего поиска были изложены следующим образом: сначала мы обсудили патогенез и иммунологические особенности инфекции COVID-19, затем нормальные взаимодействия между врожденной иммунной системой и вирусами, фон цитокинового шторма, вторичный по отношению к инфекции COVID-19, и, наконец, лечение иммунологических осложнений.
Патогенез инфекции COVID-19
Лихорадка, сухой кашель, одышка, миалгия, утомляемость, склонность к лейкопении и радиологические признаки прогрессирующей пневмонии, которая может вызвать ОРДС, аналогичны клиническим и лабораторным данным, наблюдаемым при COVID- 19, инфекции SARS-CoV и MERS-CoV.Это может свидетельствовать о сходстве их патогенеза [2]. Мы считаем, что любая гипотеза, касающаяся патогенеза COVID-19, должна объяснять очень высокие уровни ферритина и D-димера в сыворотке, непропорциональные тяжести инфекции, а также склонность к моноцитозу, а не лимфоцитозу, включая низкое количество естественных киллеров. (NK) и цитотоксические Т-клетки и, наконец, склонность к ДВС-синдрому. Действительно, эти поразительные особенности в основном отражают наличие MAS и цитокинового шторма.
Спайковые гликопротеины являются наиболее иммуногенными частями коронавирусов, которые могут связываться с рецепторами ангиотензинпревращающего фермента-2 (АПФ-2) и проникать в клетку-хозяина. Было показано сходство между спайковыми гликопротеинами SARS-CoV и SARS-CoV-2. Распределение экспрессии рецептора ACE-2 интенсивно на поверхности клеток альвеолярного эпителия типа II, сердечных, почечных, кишечных и эндотелиальных клеток согласуется с вовлеченными органами-мишенями и клинической картиной инфекции COVID-19 [2, 4].
SARS-CoV-2 распространяется главным образом при прямом контакте через капли слюны или выделения из дыхательных путей, когда инфицированный человек кашляет или чихает [1]. После связывания с рецептором ACE-2 на клеточной поверхности гликопротеином-шипом он проникает в цитоплазму клетки, где высвобождает геном РНК и реплицируется, что приводит к образованию новых вирусных частиц. Затем клетка распадается, и вирус распространяется на другие клетки.
Поскольку иммунная система распознает вирусные антигены, антигенпрезентирующие клетки обрабатывают эти антигены и представляют их как естественным киллерам, так и CD8-положительным цитотоксическим Т-клеткам в контексте основных антигенов тканевой гистосовместимости (MHC), как обычно.Эта презентация активирует как врожденный, так и адаптивный иммунитет, вызывая выработку большого количества провоспалительных цитокинов и хемокинов. У некоторых пациентов эта активация становится настолько массивной, что развивается цитокиновый шторм, что приводит к тенденции к тромбообразованию и полиорганной недостаточности, что в конечном итоге приводит к смерти [5, 6].
Еще один патогенетический механизм, независимый от связывания с ACE-2 на клеточной поверхности, также предполагался, утверждая, что вирус может связываться с бета-цепью порфиринов внутри эритроцитов, что приводит к нарушению метаболизма гема и высвобождению железа.Однако это предположение требует дальнейшего изучения и остается неуловимым [7, 8].
Иммунологические особенности при заражении COVID-19
Zhang et al. сообщили, что количество Т-лимфоцитов, включая как подтипы CD4, так и CD8, и особенно NK-клетки, намного ниже, чем ожидалось, у пациентов с тяжелым течением заболевания [9]. Количество регуляторных Т-клеток также очень низкое. Тяжелая лимфопения — очень ранний признак заболевания, предшествующий легочным проблемам, и имеет тенденцию к нормализации по мере улучшения состояния пациента.Лимфопения входит в число диагностических критериев в Китае. Несмотря на низкое количество, как CD4, так и CD8-положительные лимфоциты экспрессируют большое количество HLADR4 и CD38, демонстрируя гиперактивность. Кроме того, Т-клетки CD8 содержат высокие концентрации цитотоксических гранул; т.е. 31,6% были положительными на перфорин, 64,2% были положительными на гранулизин и 30,5% были положительными как на гранулизин, так и на перфорин. Общее количество лейкоцитов и нейтрофилов, а также соотношение нейтрофилов / лимфоцитов (NLR) увеличиваются, особенно в тяжелых случаях; NLR может использоваться в качестве параметра последующего наблюдения у пациентов с инфекцией COVID-19 [10, 11].Как правило, количество CD8 T-лимфоцитов восстанавливается через 2–3 месяца, тогда как восстановление CD4 T-лимфоцитов памяти при инфекции SARS CoV может занять почти год [9,10,11,12,13].
Помимо низкого количества периферических лимфоцитов, наблюдается поразительная атрофия вторичных лимфоидных органов, включая лимфатические узлы и селезенку, что подтверждается результатами вскрытия. Сообщалось о связанной с некрозом атрофии лимфатических узлов и селезенки, значительной дегенерации клеток селезенки, очаговом геморрагическом некрозе, пролиферации макрофагов и повышенном апоптозе макрофагов в селезенке.Иммуногистохимическое окрашивание показало снижение количества CD4-положительных и CD8-положительных Т-клеток в лимфатических узлах и селезенке [14, 15].
С другой стороны, количество моноцитов и макрофагов увеличивается, что может объяснять повышенные уровни провоспалительных цитокинов, таких как интерлейкин (IL) -6, IL-1, фактор некроза опухоли (TNF) α и IL-8, которые у некоторых пациентов оказывается цитокиновый шторм, о чем подробнее будет сказано ниже.
Подавляющее большинство воспалительных клеток, инфильтрирующих легкие, представляют собой моноциты и макрофаги.Результаты вскрытия показали наличие моноцитов и макрофагов и умеренного количества многоядерных гигантских клеток, связанных с диффузным повреждением альвеол. Однако инфильтрирующих в легкие лимфоцитов было мало, и в основном они были положительными по CD4. Эти результаты не отличались от результатов, полученных для пациентов с инфекциями SARS-CoV и MERS-CoV [14].
У пациентов с COVID-19 повышенный уровень D-димера важен, и его стойкое повышение ухудшает прогноз. Развитие ДВС-синдрома — еще одна проблема, характеризующаяся удлинением протромбинового времени и активированным частичным тромбопластиновым временем, высоким уровнем продуктов распада фибрина и тяжелой тромбоцитопенией, которая может быть опасной для жизни [16].
Тромботическая тенденция у пациентов с COVID-19, вероятно, вызвана активацией или повреждением эндотелиальных клеток из-за связывания вируса с рецептором ACE-2. Было обнаружено, что наличие традиционных факторов риска венозной тромбоэмболии высоко среди пациентов с COVID-19. Высокий уровень медиаторов воспаления и иммуноглобулинов может привести к повышению вязкости крови; искусственная вентиляция легких и сосудистые вмешательства, такие как катетеризация центральной вены, могут дополнительно вызвать повреждение эндотелия сосудов у тяжелых или критически больных пациентов.Уровни антикардиолипиновых антител также были высокими в небольших группах, о которых сообщалось. Сочетание всех этих факторов может привести к тромбозу глубоких вен или даже к летальной тромбоэмболии легких. Таким образом, пациенты, инфицированные COVID-19, госпитализированные или амбулаторные, нуждаются в ранней и длительной профилактике низкомолекулярным гепарином [9, 16]. С другой стороны, у пациентов с тяжелой формой COVID-19 сообщалось об ишемических изменениях пальцев рук и ног, имитирующих васкулит [13].
Быстрая интерпретация этих вопросов, изложенных выше, показывает, что болезнь начинается как простая вирусная инфекция, но через некоторое время выходит из-под контроля и прогрессирует к смертельному исходу с развитием цитокинового шторма и серьезным повреждением органов. Чтобы понять, почему и как происходит этот процесс, и что мы можем сделать, чтобы контролировать этот процесс, нам необходимо знать дополнительные подробности патогенеза COVID-19 и цитокинового шторма.
Нормальные взаимодействия между врожденной иммунной системой и вирусами
В контексте нормальной врожденной иммунной системы макрофаги, моноциты, дендритные клетки и нейтрофилы экспрессируют множество рецепторов распознавания образов (PRR), которые определяют молекулярные паттерны, связанные с патогенами (PAMPs) ), которые выражаются инфекционными агентами.Среди PRR семейство связанных с мембраной толл-подобных рецепторов (TLR) распознает в основном PAMP во внеклеточной среде и, в меньшей степени, во внутриклеточной среде. Запущенный процесс передачи сигналов приводит к экспрессии провоспалительных цитокин-индуцирующих факторов транскрипции, таких как NF-kB, а также к активации факторов регуляции интерферона, которые опосредуют интерферон-зависимый противовирусный ответ типа I [17]. Второй набор сенсоров распознавания патогенов присутствует в цитозоле и включает другое семейство белков с богатыми лейцином повторами (NLR) нуклеотид-связывающего домена (NLRP1, NLRP3, NLRP7 и NLRC4), белка, отсутствующего в меланоме 2 (AIM2), и пирин.Эти сенсоры необходимы для обнаружения эндогенных молекулярных паттернов, связанных с опасностями (DAMP), экспрессируемых внутри клетки. Связывание DAMPs активирует NLR, вызывая образование мультибелковых цитоплазматических комплексов, называемых инфламмасомами, которые превращают прокаспазу-1 в активную каспазу-1. Затем каспаза-1 превращает проИЛ-1β в активный ИЛ-1β, который является очень важным провоспалительным цитокином [17, 18] (рис. 1). Следует отметить, что, если эти процессы активации сигналов находятся под контролем, они служат на благо человеческого организма.
Рис. 1Генерация инфламмасомы и путь активации IL-1
Для вирусов PAMP обычно представляют собой их нуклеиновые кислоты. Вирусная РНК связывается с эндосомными TLR-3, TLR-7 и цитозольными рецепторами, включая RIG-I-подобные рецепторы (RLR). Семейство RLR состоит из трех членов, а именно, гена I, индуцированного ретиноевой кислотой (RIG-I), гена 5, ассоциированного с дифференцировкой меланомы (MDA5), и лаборатории генетики и физиологии 2 (LGP2) [19, 20]. Кроме того, RIG-I и MDA5 имеют две карты CARD (N-концевые домены активации и рекрутирования каспазы).После связывания РНК с RLR, CARD взаимодействует с белком MAVS (митохондриальный адаптер противовирусного сигнала), что приводит к активации гена, кодирующего интерфероны 1 типа (IFN). Интерфероны типа 1 играют важную роль в координации реакций клеточного иммунитета на вирусные инфекции, тем самым способствуя нормальному противовирусному иммунитету [21].
В нормальных условиях инфицированные вирусом клетки разрушаются NK-клетками врожденного иммунитета и CD8-положительными цитолитическими Т-клетками адаптивного иммунитета с использованием перфорин-опосредованной секреции гранулизина.Это приводит к апоптозу антигенпрезентирующих клеток и соответствующих цитотоксических Т-клеток, чтобы избежать ненужной активации после прекращения антигенной активности. Однако, если возникает дефект цитолитической активности лимфоцитов, будь то из-за генетических проблем или приобретенных состояний, это может привести к неспособности NK и цитолитических CD8 T-клеток лизировать инфицированные и активированные антигенпрезентирующие клетки, что приводит к длительным и усиленным взаимодействиям между клетки врожденного и адаптивного иммунитета. В этом случае многие провоспалительные цитокины, включая TNF, интерферон-γ, IL-1, IL-6, IL-18 и IL-33, секретируются безудержным образом, вызывая цитокиновый шторм.Весь патологический процесс, начинающийся с дефекта цитолитической активности лимфоцитов, протекающий с повышенной активностью макрофагов и активацией всей иммунной системы, приводящий к цитокиновому шторму, ОРДС и полиорганной недостаточности, также называется МАС [3, 22, 23]. Это опасное для жизни состояние является одной из основных причин смерти пациентов с COVID-19. Нет единого мнения или предложения о том, какую терминологию следует использовать: цитокиновый шторм, MAS или sHLH? Мы решили использовать термин цитокиновый шторм вторичный по отношению к COVID-19; тем не менее, использование терминологии MAS или sHLH не будет неопровержимым.
Предпосылки для MAS и цитокинового шторма во время инфекции COVID-19
Среди пациентов, первоначально зарегистрированных в Ухане, возникновение MAS, цитокинового шторма и ОРДС было отмечено очень высокими уровнями провоспалительных цитокинов в сыворотке крови и ферритина. В прошлом у пациентов с тяжелыми инфекциями SARS-CoV или MERS-CoV также выявлялись значительно более высокие сывороточные уровни IL-6, IFN-α, CCL5, CXCL8 и CXCL-10 по сравнению с пациентами с более легкими инфекциями [24].
Клинические и лабораторные особенности MAS включают стойкую лихорадку, повышенные уровни ферритина и триглицеридов в сыворотке, панцитопению, фибринолитическую коагулопатию, дисфункцию печени и спленомегалию.Кроме того, низкая или отсутствующая активность NK-клеток, повышенные уровни sCD25 и sCD163 в сыворотке и наличие гемофагоцитоза, который определяется как поглощение клеток крови, включая эритроциты, лейкоциты или тромбоциты, фагоцитарными клетками, подтверждают диагноз MAS [ 3].
Предлагаемые факторы предрасположенности к MAS и цитокиновому шторму, вторичному к инфекции COVID-19, обсуждаются ниже:
- (1)
Нарушение вирусного клиренса
Основная проблема при заражении COVID-19 — нарушение вирусного клиренса, как при инфекциях SARS-CoV и MERS-CoV.У этих вирусов есть несколько стратегий борьбы с защитными механизмами хозяина. SARS-CoV и MERS-CoV могут продуцировать везикулы, имеющие двойные мембраны без PRR, и реплицироваться внутри этих везикул [25]. Эти стратегии приводят к нарушению противовирусного иммунного ответа и клиренса вируса. Хотя тест ПЦР отрицательный, присутствие вирусных телец включения в легочных альвеолярных клетках и макрофагах, по крайней мере, в течение 2 недель, по-прежнему поддерживает возможность неудачного удаления вируса [14].
- (2)
Низкий уровень интерферонов I типа
Другой способствующий фактор — низкие уровни интерферонов типа I, которые действительно очень важны для противовирусного ответа и вирусного клиренса [21].Клеточные белки, распознающие вирусные нуклеиновые кислоты, опосредуются стимуляцией интерферонов во время вирусных инфекций. Распознавание вирусной РНК MDA5 необходимо для противовирусного иммунитета, а дефицит MDA5 вызывает тенденцию к вирусным инфекциям у людей [26]. Дополнительный белок БВРС-КоВ, называемый 4a, связывается с двухцепочечной РНК, тем самым блокируя активацию MDA5 и индукцию IFN [27]. Следует отметить, что у людей, умерших во время вспышки гриппа H5N1 в 1997 г., наблюдалась атрофия лимфоидной ткани, связанная с высоким титром циркулирующих цитокинов, включая IL-6 [28].Подобная повышающая регуляция провоспалительных цитокинов вместе с понижающей регуляцией противовирусных цитокинов наблюдалась при инфекции БВРС-КоВ [29].
- (3)
Увеличение внеклеточных ловушек нейтрофилов (NET)
Нейтрофилы могут убивать вторгшиеся патогены, включая вирусы, не только за счет поглощения микробов, образования активных форм кислорода, дегрануляции и секреции противомикробных препаратов, но также за счет образования NET.Сети представляют собой сети внеклеточных волокон, в основном состоящие из ДНК нейтрофилов, которые связываются и убивают внеклеточные патогены, сводя к минимуму повреждение клеток-хозяев [30]. Barnes et al. предположил, что нейтрофилы могут вносить вклад в патогенез COVID-19 с использованием NET, основываясь на результатах аутопсии. Они также предположили, что лечение дорназой альфа может быть полезным для лечения этой инфекции [31]. Перенос фрагментов ДНК во внеклеточное пространство может быть вызван высвобождением митохондриальной ДНК вместе с разрушением плазматической мембраны или вызван процессом, известным как НЕТоз.НЕТоз — это тип запрограммированной гибели клеток, отличный от апоптоза и некроза. Вирусная РНК и провоспалительные цитокины могут стимулировать образование как NET, так и NETosis. Хотя точная роль NET в противовирусном иммунитете еще не выяснена, они могут вносить вклад в патогенез COVID-19 [30,31,32].
- (4)
Разные прочие механизмы:
Пироптоз представляет собой сильно воспалительную и зависимую от каспазы-1 форму запрограммированной гибели клеток, которая наиболее часто возникает при инфицировании внутриклеточными патогенами и является частью противомикробного ответа.Было высказано предположение, что пироптоз с быстрым разрывом плазматической мембраны и высвобождением провоспалительного внутриклеточного содержимого также может играть роль в патогенезе COVID-19. Быстрая репликация вируса, вызывающая усиление пироптоза, может привести к массовому высвобождению медиаторов воспаления [33, 34].
Лю и др. подчеркнули важность антител против спайкового гликопротеина (анти-S-IgG) как промоторов накопления провоспалительных моноцитов / макрофагов в легких. Они предположили, что вирус-специфический ответ антител может вызывать патологические изменения, которые могут быть ответственны за вирус-опосредованное повреждение легких [35].Голонка и др. предположили, что белок гликопротеина S на коронавирусах может претерпевать конформационные изменения и проникать в клетки-хозяева через Fc-область IgG. Другими словами, они предложили механизм, позволяющий антитело-зависимое усиление проникновения вируса в клетки-хозяева [32].
Как обсуждалось выше, нарушение метаболизма гемов может быть одной из причин высоких уровней свободного железа в сыворотке крови и способствовать воспалению [8]. Недавно сообщалось, что опосредованная железом гибель клеток, известная как ферроптоз, играет роль в патогенезе различных заболеваний [35, 36].Роль ферроптоза в патогенезе COVID-19 и его место в качестве мишени лечения должны быть исследованы.
Взятые вместе, механизмы ускользания вируса, позволяющие избежать противовирусного иммунитета, вместе с генетическими или приобретенными дефектами защиты хозяина могут нарушать клиренс вируса, что приводит к MAS и несоответствующей иммунной активации, вызывая ОРДС и полиорганную недостаточность. Почему течение болезни варьируется от бессимптомного до летального, можно объяснить генетическими факторами и факторами хозяина [37]. Это также может объяснить, почему в некоторых семьях может быть много смертей.Учитывая, что генетические факторы также играют роль в первичных случаях HLH / MAS, был проведен метаанализ для анализа стран, в которых часто регистрируются случаи HLH / MAS, и где частота тяжелых и летальных инфекций COVID-19 высока [38 ]. Интересно, что географическое распределение оказалось схожим. Генетические мутации, вызывающие склонность к первичному HLH, могут представлять собой фактор риска тяжелого течения заболевания при COVID-19. Напротив, можно предположить, что генетические мутации, связанные с семейной средиземноморской лихорадкой (FMF), способствуют более легкому течению заболевания, основываясь на исторической гипотезе, утверждающей, что такие мутации могут придавать устойчивость к некоторым вирусным и бактериальным патогенам.Действительно, более низкие показатели смертности от инфекций COVID-19, зарегистрированные в Турции и Израиле, могут подтвердить это предположение (на основе https://covid19.who.int/, доступ к которому был получен 25.04.2020). Интересно, что MAS нечасто встречается при FMF, несмотря на то, что это аутовоспалительное заболевание [39].
Управление потенциальными иммунологическими осложнениями инфекции COVID-19
Помимо противовирусных препаратов, очень важно лечение иммунологических осложнений, включая цитокиновый шторм, с использованием соответствующих иммуносупрессивных и иммуномодулирующих препаратов [40, 41].В настоящее время не существует специфического противовирусного агента или вакцины от COVID-19. Однако существует множество лекарств, большинство из которых знакомо ревматологам, которые используются на основе их фармакологических свойств. Кортикостероиды (CS), хлорохин (CQ), гидроксихлорохин (HCQ), антагонисты IL-6R, включая тоцилизумаб (TCZ), антагонисты IL-1, включая анакинру, ингибиторы TNF и ингибиторы киназы Janus, входят в число агентов, используемых для этой цели [5, 9]. С другой стороны, нестероидные противовоспалительные средства, особенно ибупрофен, не рекомендуются для лечения инфекции COVID-19 из-за наблюдений, что они могут усугублять симптомы, увеличивая экспрессию ACE-2 [42] .
Хлорохин и гидроксихлорохин
Эти два противомалярийных агента обычно используются в ревматологической практике для лечения пациентов с ревматоидным артритом (РА), системной красной волчанкой (СКВ) и синдромом Шегрена, основываясь на их иммуномодулирующем действии. Ранее сообщалось, что помимо противомалярийных эффектов, CQ и HCQ обладают противовирусной активностью против многих вирусов, таких как лихорадка денге, лихорадка Эбола, SARS и H5N1. Недавно сообщалось, что они также полезны при COVID-19 и были включены в рекомендации многих стран, включая Китай и Италию [43,44,45,46,47,48,49].
CQ и HCQ накапливаются в лизосомах и повышают уровень pH эндосомы, что может препятствовать проникновению вируса и / или выходу из клеток-хозяев [48]. Кроме того, эти два агента могут мешать рецепторам ACE-2, которые SARS-CoV-2 усиливают их экспрессию и проникают в клетку, связываясь с этими рецепторами. CQ и HCQ могут снижать гликозилирование рецепторов ACE-2, тем самым препятствуя эффективному связыванию SARS-CoV-2 с клетками-хозяевами [48, 49]. Недавно Венчжон и др. заявили, что противомалярийные препараты могут блокировать связывание вируса SARS Cov-2 с порфиринами и, таким образом, предотвращать проникновение вируса в клетку [8].Наконец, они могут блокировать выработку провоспалительных цитокинов, включая ИЛ-6, тем самым блокируя путь, который впоследствии приводит к ОРДС. Какими бы ни были механизмы, в многоцентровых исследованиях, проведенных в Китае, сообщалось о положительном влиянии этих агентов на пациентов с COVID-19 [49]. Хотя есть несколько противоположных отчетов, похоже, что CQ и HCQ останутся основными препаратами от COVID-19.
Можно задаться вопросом, могут ли пациенты ревматологов, уже получающие HCQ, быть защищены от инфекций COVID-19.Недавно сообщалось, что у 22 пациентов с ревматическими заболеваниями, получающих лечение HCQ, была инфекция COVID-19, и один из них умер. Хотя результаты этого исследования еще не опубликованы, похоже, что профилактическое лечение с помощью HCQ не может предотвратить заражение COVID-19 (испытание в Twitter) (https://twitter.com/rheum_covid). Мы также заметили, что у некоторых из наших пациентов развился COVID-19 во время приема HCQ. Но пациенты с ревматизмом часто имеют сопутствующие заболевания и также принимают многие другие лекарства.Кроме того, обычная суточная доза HCQ составляет 200 мг, что ниже рекомендуемой дозы для COVID-19. Поэтому мы не рекомендуем профилактическое использование HCQ для предотвращения заражения COVID-19.
Ингибиторы киназы Янус
COVID-19 может проникать внутрь клетки посредством эндоцитоза и проникать в клетку. AP2-ассоциированная протеинкиназа I (AAK1) является членом семейства ассоциированных с онемением киназ (NAK), которая служит регулятором опосредованного клатрином эндоцитоза, а ингибиторы AAK1 могут предотвращать проникновение вируса в клетку [40, 50].Барицитиниб является ингибитором пути JAK-STAT, который используется для подавления продукции провоспалительных цитокинов и системного воспаления при РА. Барицитиниб также является ингибитором NAK с особенно высоким сродством к AAK [40, 51]. Основываясь на этих исходных данных, Stebbing J et al. предположили, что барицитиниб 2–4 мг в день можно сочетать с противовирусным лечением при тяжелых инфекциях COVID-19 [40]; однако ингибирование продукции IFN в результате сопутствующей блокады пути JAK-STAT может вызвать нарушение противовирусного иммунитета [52].С другой стороны, тофацитиниб не может ингибировать AAK1 и не рекомендуется для этой цели [40]. Склонность к общим инфекциям и возможность дивертикулита — другие недостатки ингибиторов JAK [50].
Ингибиторы интерлейкина-6
Как упоминалось выше, инфекции SARS и COVID-19 могут вызывать MAS и цитокиновый шторм. Т-лимфоциты гиперактивированы, и существует огромное количество провоспалительных цитокинов, включая ИЛ-6 и ИЛ-1, которые способствуют проницаемости сосудов, утечке плазмы и ДВС-синдрому, тем самым вызывая легочное поражение и ОРДС, а также мультиорганные отказ [22].Цитокиновый шторм и связанные с ним аналогичные проблемы также наблюдаются после лечения Т-лимфоцитами химерного антигена (CAR-T) [53].
TCZ представляет собой гуманизированное антитело против рецептора IL-6, ингибирующее IL-6. TCZ в настоящее время используется не только для лечения РА, височного артериита и многих других аутоиммунных ревматических заболеваний [54], но также для лечения цитокинового шторма, который может быть вызван лечением CAR-T [53].
На основании этих наблюдений лечение TCZ также было опробовано у пациентов с тяжелой инфекцией SARS-CoV-2, осложненной цитокиновым штормом и ОРДС.В ретроспективных исследованиях, проведенных в Китае, сообщалось об исчезновении лихорадки и гипоксемии, а также об улучшении уровней СРБ в сыворотке и данных КТ легких [40, 41, 55, 56, 57]. Наш собственный опыт также согласуется с этими отчетами. Для лечения цитокинового шторма рекомендуемая доза TCZ составляет 8 мг / кг внутривенно однократно или разделенными на две дозы с интервалами 12–24 ч (максимальная доза 800 мг). Склонность к общим инфекциям, гепатотоксичность, гипертриглицеридемия и возможность дивертикулита являются основными недостатками лечения TCZ [58].
Ингибиторы интерлейкина-1
Как упоминалось выше, IL-1 является еще одним провоспалительным цитокином, играющим доминирующую роль в цитокиновом шторме, а SARS-CoV-2 может вызывать пироптоз под действием IL-1β [5]. Анакинра представляет собой рекомбинантный антагонист IL-1R (rHIL-1Ra) и является первым продуцируемым биологическим агентом, блокирующим IL-1. Анакинра блокирует связывание как IL-1α, так и IL-1β с IL-1R, тем самым подавляя провоспалительные эффекты IL-1 [59]. На основании данных рандомизированного клинического исследования фазы 3 было обнаружено, что анакинра эффективна у пациентов с тяжелым сепсисом без значительных побочных эффектов [60].Рекомендуемая п / к доза анакинры для взрослых составляет от 100 до 200 мг в день до 100 мг три раза в неделю; педиатрическая доза составляет 1 мг / кг в сутки. Биодоступность п / к инъекций составляет 95% с периодом полувыведения 4–6 часов. При почечной недостаточности (СКФ <30 мл / мин) его следует вводить каждые 2 дня. Заболевания печени не требуют коррекции дозы. В отличие от TCZ, анакинра не подавляет синтез CRP напрямую; следовательно, уровни CRP в сыворотке можно использовать для отслеживания системного острофазового ответа [59].Другой молекулой, продуцируемой для блокирования ИЛ, является канакинумаб, который представляет собой высокоаффинное, полностью гуманизированное моноклональное антитело против ИЛ-1β с изотипом IgG1 / κ. После подкожной инъекции 150 мг максимальная концентрация в сыворотке достигается через 7 дней. Рекомендуемый интервал между приемами - каждые 2 месяца [59]. Третьей молекулой, разработанной для блокады IL-1, является рилонасепт, который представляет собой рекомбинантный растворимый рецептор IL-1. Период полувыведения рилонасепта составляет 6,3–8,6 суток. Рекомендуемая ударная доза составляет 2,2 мг / кг, максимальная - 160 мг; поддерживающая доза составляет половину ударной дозы еженедельно [61].О применении канакинумаба или рилонасепта при тяжелых инфекциях COVID-19 пока не сообщалось.
Ингибиторы TNF-α
TNF-α является ключевым провоспалительным цитокином, способствующим различным острым и хроническим воспалительным патологиям, включая некоторые аутоиммунные заболевания и септический шок. Агенты против TNF обычно используются для лечения ревматоидного артрита, анкилозирующего спондилита и псориатического артрита. В то время как уровни TNF-α в сыворотке были умеренно повышены у пациентов с SARS, гораздо более высокие уровни в сыворотке наблюдались у пациентов с инфекцией COVID-19, что положительно коррелировало с тяжестью заболевания.Хотя лечение анти-TNF было предложено в качестве потенциального лечения COVID-19, достаточных данных нет [40, 41].
Кортикостероиды
Системное лечение кортикостероидами (КС) при тяжелом ОРДС является спорным вопросом; тем не менее, многие врачи используют это лечение у пациентов с тяжелым вирусным ОРДС. Его использование не рекомендуется пациентам с COVID-19, исходя из данных пациентов с h2N1, SARS и MERS [5]. Международные руководящие принципы рекомендуют использовать умеренные дозы системного лечения CS в течение короткого времени, только когда гемодинамические параметры не улучшаются после восполнения жидкости и вазопрессорной поддержки [40, 41].Текущее использование системного лечения кортикостероидами во время инфекции COVID-19 ограничено пациентами, имеющими летальные осложнения, связанные с цитокиновым штормом, такими как ОРДС, острое сердечное повреждение, почечная недостаточность, и пациентами с более высокими уровнями D-димера в сыворотке крови. Поскольку нет никаких положительных доказательств, полученных в результате рандомизированных клинических испытаний, руководство ВОЗ от 13 марта 2020 г. не рекомендует рутинно использовать системное лечение КС для пациентов с COVID-19 [62]. По нашему мнению, метилпреднизолон 40 мг один раз в день в течение 4–5 дней в дополнение к лечению TCZ может быть полезным во время цитокинового шторма, а также может помочь избежать рецидива после TCZ.
Внутривенный иммуноглобулин (ВВИГ)
ВВИГ содержит объединенный поликлональный иммуноглобулин G (IgG), поступающий из плазмы примерно тысячи или более здоровых доноров крови. В клинической практике ВВИГ используется у пациентов с иммунодефицитом для лечения инфекционных заболеваний, а также у резистентных к лечению пациентов с аутоиммунными заболеваниями в качестве иммуномодулирующего средства. Предыдущий благоприятный опыт пациентов с SARS и MERS предполагал использование высоких доз IVIG (0,3–0,5 г / кг) у пациентов с серьезной инфекцией COVID-19 на ранней стадии заболевания [63, 64] .Не следует упускать из виду антикоагуляцию и гидратацию из-за повышенной тенденции к тромбозу во время лечения внутривенным иммуноглобулином для пациентов с COVID-19.
Колхицин
Колхицин — противовоспалительное и иммуномодулирующее средство, долгое время широко применяемое для лечения подагры, ССЛ и синдрома Бехчета. Было высказано предположение, что колхицин может быть полезен для лечения некоторых осложнений инфекции COVID-19 на основании его способности подавлять выработку IL-1 [41]. Исследование COLCORONA (Colchicine Coronavirus SARS-CoV2) — это многоцентровое рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование фазы 3 для оценки эффективности и безопасности колхицина у взрослых пациентов, у которых диагностирована инфекция COVID-19 и которые имеют как минимум один критерий высокого риска.В настоящее время результаты этого исследования еще не опубликованы (идентификатор ClinicalTrials.gov: NCT04322682).
Другие методы лечения
Для лечения COVID-19 и его осложнений также было предложено множество других препаратов и вмешательств. Всем госпитализированным пациентам с COVID-19 настоятельно рекомендуется использование низкомолекулярного гепарина (НМГ) или нефракционированного гепарина в дозах, указанных для профилактики венозной тромбоэмболии. Если у пациентов есть противопоказания к антикоагулянтной терапии, их следует лечить компрессией нижних конечностей [65].
Для профилактики и лечения цитокинового шторма и возможного фиброза легких после пневмонии, вызванной COVID-19, иммуномодуляция на основе мезенхимальных стволовых клеток (МСК) была предложена в качестве подходящего терапевтического подхода. С этой целью в настоящее время проводится множество исследований [66]. Ленг и др. пришли к выводу, что внутривенная трансплантация МСК была безопасной и эффективной у пациентов с пневмонией COVID-19, особенно у пациентов в критически тяжелых условиях [67]. Однако в настоящее время не существует утвержденных подходов на основе МСК для профилактики и / или лечения пациентов с COVID-19, но первые результаты клинических испытаний кажутся многообещающими.
Переливание иммунной плазмы, которое является способом пассивной иммунизации, — это старый метод лечения многих инфекций. Опыт заражения SARS-CoV показал, что это лечение может работать, если его назначать соответствующему пациенту или даже членам семьи, ухаживающим за пациентами с COVID-19 дома [68]. Однако, исходя из опыта инфекций SARS-CoV и MERS-CoV, после переливания гипериммунного глобулина существует риск усиления заболевания, опосредованного антителами [69].
Высокий уровень циркулирующих интерферонов типа I, типа II и типа III ассоциируется с отчетливыми клиническими признаками активной системной красной волчанки | Arthritis Research & Therapy
Здесь мы представляем первое сравнительное исследование функциональной активности IFN I типа, измеренной in vitro с помощью анализа репортерных клеток WISH, метода, часто используемого в качестве золотого стандарта для оценки сигнатуры IFN при СКВ, и измерения циркулирующего типа I , IFN типа II и типа III.Наше исследование уникально, поскольку мы измерили все три типа ИФН в большой и очень хорошо охарактеризованной когорте СКВ. Этот подход позволил нам определить, как разные подтипы IFN связаны друг с другом и с клиническими подмножествами СКВ.
Мы обнаружили, что активность IFN типа I коррелирует с циркулирующими уровнями IFN типа I и типа II, но слабо с IFN типа III, который, насколько нам известно, ранее не наблюдался. Было известно, что уровни IFN-γ повышаются за годы до постановки диагноза СКВ.Наблюдаемая корреляция между активностью IFN и IFN-γ предполагает, что роль IFN-γ может быть столь же важной, как IFN типа I при СКВ. Следовательно, IFN-γ также может быть важной мишенью для терапевтических стратегий. Кроме того, многомерные модели номинальной регрессии позволили нам идентифицировать фенотипические подмножества СКВ, связанные с высокими уровнями различных подтипов ИФН.
Мы сообщаем о новом наблюдении, согласно которому активный LN связан как с высокой активностью IFN, так и с высокими уровнями циркулирующего IFN-γ.Среди случаев волчаночного нефрита (активного или перенесенного) мы наблюдали долю пациентов с перекрывающимся повышением активности IFN, IFN-γ и сывороточного IFN-α, как сообщалось ранее [10, 32]. Таким образом, наши результаты расширяют предыдущие знания о том, что почечные обострения связаны с комбинированной сигнатурой генов IFN-α и IFN-γ [32, 33]. Помимо IFN-γ, другие типы IFN, по-видимому, имеют большое значение. Исследование азиатского населения показало, что высокие уровни IFN-λ1 также связаны с LN [34]. Мы не смогли подтвердить эту связь, возможно, из-за того, что некоторые пациенты уже проходили индукционную терапию при наборе; тем не менее, в нашем более раннем исследовании мы обнаружили, что высокие уровни IFN-λ1 были связаны с плохими почечными исходами [11].Интересно, что в нашей когорте высокие уровни IFN-α в сыворотке были связаны с лучшим сохранением функции почек, и это наблюдение осталось после корректировки по возрасту [11].
Артрит с СКВ был связан как с высокой активностью IFN типа I, так и с высоким IFN-γ. Ранее мы сообщали, что артрит был связан с активацией IP-10 / CXCL-10 [11]. В целом, наши наблюдения предполагают, что артрит при СКВ связан с несколькими цитокинами в путях ИФН [11].
Как и другие исследователи, наши данные демонстрируют, что поражение слизистых и кожных покровов связано с высокой активностью IFN типа I in vitro и с высокими уровнями циркулирующего IFN-α [8, 35], что позволяет предположить, что эта подгруппа может получить пользу от блокаторов IFN-α [20].
Мы также наблюдали, что образцы аутоантител связаны с различными подтипами IFN.
Активность IFN типа I соответствует большинству субспецифичностей ANA, как сообщалось ранее [8, 31, 32, 35]. В многопараметрическом анализе мы выявили новую ассоциацию, согласно которой высокий уровень IFN-γ наиболее сильно связан с анти-Ro60. Мы подтверждаем предыдущие данные об IFN-α, который, как известно, связан с анти-Ro52 и анти-La [8].
В нескольких исследованиях изучалась взаимосвязь между ИФН и сосудистыми исходами при СКВ [36].Более ранние сообщения из более широких этнических групп наблюдали связь aPL и высокой активности IFN типа I в определенных группах предков [37]. В нынешней когорте, в основном кавказской, многофакторный анализ продемонстрировал более низкую вероятность сосудистых событий, назначение АФЛ и варфарина для пациентов с изолированным высоким ИФН-альфа. Кроме того, в группе с высоким содержанием IFN-γ частота сосудистых событий была несколько ниже, поскольку назначение антикоагулянтов было менее распространенным. Высокий уровень IFN-λ1 был связан с антинуклеосомными аутоантителами и численно, но не значительно, с более высокой частотой aPL, сосудистых событий и использования варфарина.Наши результаты показывают, что в этой европейской популяции IFN типа I и типа II в первую очередь связаны с аутореактивностью с внутриклеточными аутоантигенами, но не с aPL, которые нацелены на неядерные структуры, такие как белки плазмы и фосфолипиды мембран [30]. Насколько нам известно, ранее не сообщалось о связи между сердечно-сосудистыми заболеваниями и уровнями периферических уровней ИФН типа II и III.
Известно, что высокая активность IFN I типа связана с гематологическими проявлениями [35].В нашем отчете добавлена новая информация о том, что гематологические проявления также связаны с повышенным уровнем IFN-γ. Как и ожидалось, мы подтверждаем, что низкие уровни комплемента следуют за высокой активностью IFN типа I, а также за высокими уровнями IFN-α и IFN-γ [2, 9, 28, 29].
Значительная часть более ранних исследователей полагалась на оценки активации IFN-гена и их связи с активностью заболевания СКВ [32, 37, 38]. Однако каждый исследователь предпочел измерить различные гены, регулируемые IFN, и поэтому исследования трудно сравнивать.Еще одним осложняющим фактором при оценке сигнатуры IFN является то, что одни и те же гены могут регулироваться несколькими типами IFN. Наши результаты показывают, что пациенты с активной СКВ имеют высокий уровень циркулирующих ИФН типа I, типа II и типа III и что поражение различных органов, по-видимому, связано с различными типами ИФН. Представленные данные свидетельствуют о том, что измерение уровней циркулирующего IFN более информативно, чем оценка сигнатуры IFN, и может иметь значение для выявления пациентов, которым анти-IFN терапия при СКВ будет полезна.
Мы демонстрируем, что несколько основных клинических проявлений связаны с доминирующим типом IFN, но все же некоторые пациенты имеют другие типы IFN с повышенной регуляцией. Было бы интересно, если бы наши наблюдения могли быть подтверждены в других когортах. В клинической практике было бы важно измерить все три типа ИФН и определить доминирующий, чтобы адаптировать направленную терапию. Кроме того, наши результаты показывают, что соединения, блокирующие несколько путей IFN внутри клетки, будут более многообещающим терапевтическим подходом, чем моноклональные антитела, блокирующие один циркулирующий IFN или его рецептор [20, 39].
Активация IFN-регулируемых путей I типа считается ключевым механизмом в патогенезе СКВ [40], но новые данные демонстрируют, что важную роль также играют IFN типа II и ось цитокинов Th27 [9, 11, 41]. Фаза 2 испытаний устекинумаба, антител, блокирующих путь IL-12 / IL-23, при СКВ была недавно опубликована с положительными и многообещающими результатами [42]. Хороший ответ на устекинумаб был связан со снижением уровней IFN-γ, в то время как показатели подписи IFN I типа не снижались.Ранее мы сообщали, что высокие уровни IL-23 и IL-17 связаны с резистентными к лечению ЛУ с плохими результатами [10, 36, 37]. В целом, накопленные данные подтверждают роль IFN-γ и оси Th27 в СКВ, предполагая, что при тяжелых проявлениях, включая LN, могут помочь агенты, блокирующие IFN-γ и / или Th27.
IFN-β является важным членом семейства IFN типа I. К сожалению, мы не измерили циркулирующие уровни IFN-β. Возможно, что некоторые расхождения в наших результатах между анализом IFN функционального типа I и ELISA IFN-α связаны с тем, что функциональный анализ также измеряет IFN-β.Хотя это могло быть объяснением, было показано, что IFN-α является основным циркулирующим IFN типа I в большинстве сывороток при СКВ [12]. Таким образом, представляется вероятным, что функциональный анализ более чувствителен, чем ELISA, для общего измерения IFN-α [14].
Мы наблюдали, что пациенты с высокой активностью IFN имели немного более высокие OR для доз преднизолона более 10 мг, но не наблюдали никаких других ассоциаций между уровнями IFN и иммуномодулирующей терапией. Дизайн представленного исследования был перекрестным, и в него были включены пациенты с сильно различающимися показателями активности заболевания, а также различные виды лечения.Этот факт мог ограничить нашу возможность проанализировать, как различные методы лечения могут влиять на уровни IFN. Проспективное лонгитюдное исследование было бы лучшим вариантом для изучения этих вопросов.
Исторически контролируемое экспериментальное испытание с участием одной руки
Abstract
На сегодняшний день не существует одобренных противовирусных препаратов для лечения болезни, вызванной вирусом Эбола (БВВЭ). Основываясь на нашем доказательстве in vitro противовирусной активности интерферона (IFN) -бета в отношении вируса Эбола, мы провели одноэтапное клиническое исследование в Гвинее, чтобы оценить безопасность и терапевтическую эффективность лечения БВВЭ с помощью IFN-β-1a.Девять человек, инфицированных вирусом Эбола, лечились IFN β-1a и ретроспективно сравнивались с подобранной когортой из 21 инфицированного пациента, получавшего стандартизированную поддерживающую терапию только в течение того же периода времени в том же лечебном отделении. Осознавая ограничения лечения только 9 человек с БВВЭ, собранные данные внимательно рассматриваются. По сравнению только с поддерживающей терапией лечение IFN β-1a, по-видимому, способствовало выведению вируса из крови и, по-видимому, связано с более ранним исчезновением симптомов заболевания.Выживаемость, рассчитанная от даты согласия участников исследования и даты поступления от участников контрольной когорты до даты смерти, составила 19% для тех, кто получал только поддерживающую терапию, по сравнению с 67% для тех, кто получал поддерживающую терапию плюс IFN β-1a. С учетом различий в исходной виремии крови между контрольной группой и группой, получавшей IFN, для анализа подмножества были включены 17 дополнительных контрольных групп из других лечебных учреждений в Гвинее, сопоставленных с пациентами, получавшими IFN, на основе возраста и исходной виремии крови. .Анализ подмножества с использованием этой расширенной контрольной когорты показывает, что у пациентов, не получавших лечения IFN β-1a, вероятность смерти в 1,5–1,9 раза выше, чем у пациентов, получавших лечение. В целом полученные результаты предлагают обоснование для дальнейшей клинической оценки IFN β-1a.
Образец цитирования: Конде М.К., Бейкер Д.П., Траоре Ф.А., Соу М.С., Камара А., Барри А.А. и др. (2017) Интерферон β-1a для лечения болезни, вызванной вирусом Эбола: исторически контролируемое индивидуальное испытание, подтверждающее концепцию. PLoS ONE 12 (2): e0169255.https://doi.org/10.1371/journal.pone.0169255
Редактор: Джузеппе Витторио Де Социо, Azienda Ospedaliera Universitaria di Perugia, ИТАЛИЯ
Поступила: 15 августа 2016 г .; Одобрена: 13 декабря 2016 г .; Опубликован: 22 февраля 2017 г.
Авторские права: © 2017 Konde et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в бумажных и вспомогательных информационных файлах.
Финансирование: Это исследование было поддержано грантом канадских институтов исследований в области здравоохранения (Институт инфекций и иммунитета), предоставленного ENF. Спонсор предоставлял поддержку в виде заработной платы авторам [MKK, FAT, MSS, AC, AAB, IK, DM, AB, AAR], но не играл никакой дополнительной роли в дизайне исследования, сборе и анализе данных, решении опубликовать или подготовить рукопись.Конкретные роли этих авторов сформулированы в разделе «Авторский вклад». Кроме того, поддержку оказала Европейская мобильная лаборатория (EMLab), технический партнер Лабораторной сети ВОЗ по новым и опасным патогенам (EDPLN), а также Глобальная сеть оповещения о вспышках болезней и ответных мер (GOARN). Работа EMLab проводилась в контексте проектов EVIDENT (Болезнь, вызванная вирусом Эбола: корреляты защиты, детерминанты исхода и клиническое ведение), которые получили финансирование в рамках исследовательской и инновационной программы Европейского Союза Horizon 2020 в рамках грантовых соглашений No.666100, а также в контексте контракта на обслуживание IFS / 2011 / 272-372, финансируемого Генеральным директоратом по международному сотрудничеству и развитию. Оба соглашения нет. Финансовая поддержка 666100 и IFS / 2011 / 272-372 не имела никакого отношения к дизайну исследования, сбору и анализу данных, принятию решения о публикации или подготовке рукописи.
Конкурирующие интересы: Никаких источников коммерческого финансирования для поддержки этого исследования предоставлено не было. DPB получил зарплату от Biogen. DPB в настоящее время работает в компании Sanofi Genzyme, но эта работа началась после завершения данного исследования.Ни Biogen, ни Sanofi Genzyme не принимали участие в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи. Такое присоединение не влияет на нашу приверженность всем политикам PLOS ONE в отношении обмена данными и материалами.
Введение
Вирус Эбола Заира (EBOV), член семейства филовирусов, вызывает тяжелые, часто смертельные инфекции у людей и приматов [1]. С декабря 2013 года вспышка болезни, вызванной вирусом Эбола (БВВЭ), в Западной Африке унесла жизни 11 314 из 28 630 подтвержденных случаев.Клинические симптомы в начале БВВЭ включают головную боль, лихорадку, астению, артралгию и миалгию. Развиваются желудочно-кишечные симптомы, включая боль в животе, тошноту, рвоту и диарею, что приводит к дисбалансу электролитов, связанному с истощением внутрисосудистого объема. Действительно, БВВЭ ассоциируется с глубокой эндотелиальной дисфункцией, ведущей к сдвигу жидкости, что может привести к сердечно-сосудистому коллапсу и почечной недостаточности [2, 3]. Примечательно, что общие показатели летальности различались в 3 странах с наибольшим числом подтвержденных случаев: 67% в Гвинее, 45% в Либерии и 28% в Сьерра-Леоне [4].Такие переменные, как степень виремии, время до начала поддерживающей терапии и уровень поддерживающей терапии, внесли свой вклад в коэффициент летальности [5]. В отсутствие каких-либо одобренных методов лечения высокий коэффициент летальности побудил рассмотреть возможные варианты лечения, включая перепрофилирование одобренных лекарств.
Интерфероны типа I (IFN) IFN-α и IFN-β обладают широким спектром противовирусной активности с продемонстрированной клинической эффективностью против вирусов HBV, HCV, гриппа A и SARS-CoV [6].Продукция IFN-α / β происходит как самый ранний неспецифический ответ на вирусную инфекцию, напрямую ингибируя вирусную инфекцию и активируя врожденный и адаптивный иммунные ответы на чистый вирус. Действительно, вирусы разработали стратегии уклонения от иммунитета, специально нацеленные против ответа IFN типа I, что подтверждает важность IFN как противовирусных препаратов. Эта стратегия уклонения от иммунитета особенно актуальна, когда рассматривается инфекция IFN и EBOV. Экспериментальные данные показывают, что белки VP24 и VP35 EBOV ингибируют системы клеток-хозяев, которые приводят к продукции IFN типа I, а также ингибируют события, связанные с ответом IFN [7–9].Соответственно, раннее постэкспозиционное лечение IFN типа I может преодолеть эти ингибирующие эффекты EBOV. Было показано, что терапия IFN-β-1a продлевает выживаемость в модели летального БВВЭ у макака-резуса [10], а лечение IFN-α2b снижает виремию и увеличивает время до смерти в аналогичной модели летального БВВЭ у яванок [11]. Комбинация моноклональных антител, нацеленных против EBOV (ZMAb), защищает макак от летального БВВЭ со снижением эффективности, если лечение откладывается до 2 дней после инфицирования [12].Добавление экспрессируемого аденовирусом векторного IFN-α к ZMAb увеличивало окно лечения и улучшало защиту [12]. Более того, у мышей и морских свинок при использовании этого аденовируса человека с дефицитом репликации, экспрессирующего только рекомбинантный IFN-α, постэкспозиционная обработка вызывала полную защиту от летальных доз адаптированного к мышиным и морским свинкам EBOV [13]. Примечательно, что исследование образцов сыворотки инфицированных людей во время вспышки EBOV в Судане в Уганде в 2000 г. показало, что у выживших пациентов уровень IFN-α был значительно выше в течение первых нескольких дней после начала критического заболевания [14].
В совокупности эти исследования позволили нам оценить лечение ИФН БВВЭ. В исследованиях с использованием компетентных по транскрипции вирусоподобных частиц и инфекционного вируса eGFP-Эбола мы предоставили доказательства того, что IFN-α / ß ограничивает инфекцию вируса Эбола (EBOV) in vitro , и показали, что IFN ß-1a проявляет более высокую противовирусную активность по сравнению с IFN-α [15]. Эти результаты послужили основой для этого пилотного пилотного исследования, подтверждающего концепцию, с целью оценки безопасности и эффективности лечения ИФН-β при БВВЭ.Это исследование было проведено в ЕТУ недалеко от Коя, Гвинея, во время вспышки Эболы в 2014–2015 годах. Хотя плацебо-контролируемое исследование не было разрешено органами здравоохранения Гвинеи из-за этических соображений, лабораторные и клинические данные о людях, инфицированных EBOV, которые получали только поддерживающую терапию в том же лечебном центре и в тот же период, что и те, кто получал IFN β- 1а был доступен для сравнения. Мы предоставляем предварительные доказательства, подтверждающие дальнейшую оценку IFN β-1a при любой последующей вспышке.
Материалы и методы
Дизайн исследования
Учитывая (i) острую необходимость во внедрении лекарств, снижающих смертность от БВВЭ, (ii) ограниченные данные о клинических и биохимических параметрах, связанных с БВВЭ, и (iii) ограниченные возможности оказания помощи, доступные в лечебных отделениях во время вспышки, Дизайн исследования был сфокусирован на объективных конечных точках снижения виремии в крови, разрешении клинических симптомов, улучшении выживаемости и безопасности лечения IFN β-1a.
Протокол исследования и информированное согласие
Протокол исследования (английская версия;) предоставляется в качестве дополнительных материалов. Разрешения были получены от Министерства здравоохранения Гвинеи (# 0777 / CNRE; д-р Сакоба Кейта) (29 февраля 2015 г.), CNERS, Гвинея (016 / CNERS / 15; проф. Oumou Younoussa Sow) (16 февраля 2015 г.) и Комиссия по исследованию Эболы, Национальный институт общественного здравоохранения, Гвинея (д-р Ламин Койвогуи) (12 декабря 2014 г.). Письменное информированное согласие было получено от всех пациентов, получавших лечение IFN β-1a.
Пробная регистрация
ISRCTN 17414946. Регистрация этого испытания была отложена. Министерство здравоохранения Гвинеи зарегистрировало исследование под номером 0777 / CNRE 29 февраля 2015 г.
Выбор пациентов
Первоначальная популяция исследования включала пациентов, которые были госпитализированы в отделение лечения Эболы (ETU) в сельской местности недалеко от города Коя на западе Гвинеи в период с 26 марта 2015 года по 12 июня 2015 года. Включение (соответствие критериям) Критериями терапии ИФН-β-1а были (1) появление симптомов в течение 6 дней, (2) положительный результат на EBOV, подтвержденный ОТ-ПЦР крови, (3) информированное согласие пациента / на использование ИФН-β-1а.Критерии исключения включали (1) появление симптомов более чем за 6 дней до госпитализации, (2) возраст <17 или> 70 лет, (3) противопоказания к применению IFN β-1a или любого из компонентов лекарственного препарата. В условиях сокращающейся вспышки набор пациентов был затруднен, что ограничило это экспериментальное исследование экспериментальным исследованием. Девять пациентов соответствовали критериям включения в лечение IFN β-1a. Когорта исторического контроля из 28 пациентов была доступна для сравнения с леченными пациентами. Из этой группы были исключены 7 пациентов: 4 были моложе 17 лет, 2 имели начало симптомов более чем за 6 дней до госпитализации и 1 был старше 70 лет.21 контрольный пациент был госпитализирован в Coyah ETU в тот же период времени, что и пациенты, получавшие IFN β-1a, с EBOV крови, подтвержденной RT-PCR (таблица 1). Мы также включили еще 17 пациентов, которые соответствовали пациентам, получавшим IFN, по критериям отбора на основе ≤ 6 дней с момента появления симптомов, возраста и нахождения под наблюдением в лечебном центре Гвинеи, которые лучше соответствовали исходным значениям CT. Поскольку нам не были доступны данные о серийных значениях КТ для этих дополнительных пациентов, в качестве результата использовалось только жизненное состояние (живые или мертвые).
Протокол лечения
Соответствующим критериям пациентам вводили IFN β-1a (0,5 мл жидкого лекарственного препарата AVONEX, Biogen) подкожно ежедневно. См. Графики дозирования в Таблице 2. Каждые 0,5 мл содержали 30 мкг (6 x 10 6 МЕ) IFN β-1a. Все пациенты, получавшие IFN β-1a, и все исторические контрольные группы получали поддерживающую терапию, которая была доступна в условиях ограниченных ресурсов, по мере необходимости, включая: раствор для регидратации (пероральный), раствор лактата Рингера (перфузируемый), растворы изотонической соли / глюкозы (перфузируемые ), обезболивающие и жаропонижающие: новальгин (в / в), парацетамол (перорально), анталгин (перорально) или трамадол (перорально), лечебная диета Plumpy’Nut (перорально), комплекс витаминов B (перфузированный), витамин С (в / в / перфузия), Циметидин (в / в), Омепразол (перорально) или метоклопрамид в / в (для лечения симптомов гастроэзофагеального рефлюкса), вогален (в / в) (для лечения симптомов тошноты и рвоты), Циметидин (в / в) (подавляет выработку кислоты в желудке), Дицинон (в / в) (антигеморрагический), цефалоспориновые антибиотики цефиксим (перорально) и цефтриаксон (в / в), антибиотик метронидазол (перфузируемый) и антималярийный коартем (пероральный) (подробные сведения о поддерживающей терапии, предоставляемой пациентам, принимающим IFN, см. в файле Excel S1).Примечательно, что все исторические контрольные группы получали такую же поддерживающую терапию, как и пациенты, принимавшие ИФН. Боль и лихорадка купировались в индивидуальном порядке, как и желудочно-кишечные проблемы, потребности в питании, сопутствующие инфекции и геморрагические явления. Важно, чтобы каждый пациент, о котором мы сообщаем, независимо от того, участвовал ли он в клиническом исследовании лечения интерфероном или в контрольной группе, получал поддерживающую терапию, как описано.
Пациенты были выписаны после исчезновения клинических симптомов и после 2 последовательных отрицательных результатов ОТ-ПЦР крови на виремию (≥ значение КТ 40) с интервалом 48 часов в соответствии с рекомендациями ВОЗ [16].
Неблагоприятные события, отчетность и управление
См. Протокол Study S1. Вкратце, нежелательные явления, о которых сообщалось, описаны в монографии по продукту AVONEX. Протокол исследования указывал на корректировку или отмену дозы в случае серьезных побочных эффектов (ухудшение и тяжелые клинические симптомы, связанные с БВВЭ (включая постоянно повышенные уровни АСТ и АЛТ) и / или разрешение болезни (значение CT ≥ 40).
Лабораторные исследования
Лабораторные исследования включали серийные ОТ-ПЦР-анализы крови на EBOV и биохимические анализы.Забор крови в пробирки с ЭДТА немедленно обрабатывали для определения виремии. Диагноз БВВЭ был проведен с использованием полуколичественного анализа RT-PCR (набор 1.0 RealStar Filovirus Screen RT-PCR, altona Diagnostics, GmbH). Измерения выражаются в виде значений CT (порог цикла), обратно пропорциональных вирусной нагрузке. Значение CT для положительности вируса Эбола было ≤ 40.
Статистический анализ
Исходные характеристики и лечение контрольных групп и групп, получавших IFN β-1a, представлены в виде медиан, диапазонов или чисел и процентов для всех клинических параметров, значений биохимии и симптомов.Сравнение двух когорт проводилось с использованием либо критерия Манна-Уитни для непрерывных переменных (например, значений CT), либо точного критерия Фишера для категориальных переменных. Процент выживаемости и графики были основаны на оценках Каплана-Мейера. Кривые выживаемости сравнивали с использованием лог-рангового критерия (показано значение p). Лечение IFN β-1a, а также значение CT (как непрерывное) также тестировали с использованием теста Вальда в рамках модели пропорциональных рисков Кокса. Эффект лечения IFN β-1a был протестирован с корректировкой модели для значения CT.Предположения о пропорциональности опасностей и линейности (для значения CT) были проверены, и отклонений не было обнаружено. Скорость изменения во времени значений CT и лихорадки, а также различия этих показателей между лечением IFN β-1a и контрольной когортой были протестированы с использованием моделирования смешанного эффекта. Этот тип моделирования может учитывать возможные корреляции между наблюдениями, принадлежащими одному и тому же человеку. При осмотре остатков отклонений от нормы не наблюдалось.
Различие в изменении симптомов с течением времени между экспериментальной группой и контрольной группой исследовали с использованием общих моделей оценочного уравнения (ну и так) со связью logit (для двоичного результата). Наличие симптома было результатом, а лечение, день и их взаимодействие были ковариатами. Термин взаимодействия измеряет разницу в скорости изменения появления симптомов между двумя группами (контрольные группы по сравнению с обработанными IFN β-1a). Значения p взаимодействия были скорректированы для множественных сравнений с использованием подхода Хохберга [17].Анализ проводился с использованием R-3.2.2. Пакеты, необходимые для этого анализа, были gee и NIME.
Результаты
См. Рис. 1. Первоначальная популяция исследования включала 19 женщин и 11 мужчин в возрасте от 18 до 70 лет в отделении лечения Коя, Гвинея. EBOV был подтвержден у всех участников исследования с помощью ОТ-ПЦР крови. Важно отметить, что, хотя IFN β-1a был доступен в качестве варианта лечения, лица, инфицированные EBOV, и / или их назначенные лица имели право отказаться от лечения IFN β-1a, что 4 сделали.Группы лечения IFN β-1a и контрольные группы не различались по возрасту, полу или дню госпитализации относительно появления симптомов (таблица 1). Повышенные уровни аланинаминотрансферазы (ALT), аспартатаминотрансферазы (AST), креатинина (CRE) и C-реактивного белка (CRP) были характерными чертами БВВЭ у всех участников исследования. Из 9 пациентов, получавших IFN β-1a, 5 начали лечение IFN на 3 день после появления симптомов, 1 на 4 день после появления симптомов, один на 5 день после появления симптомов и один на 6 день после появления симптомов.Один пациент начал лечение на следующий день после поступления в лечебное отделение на основании того, что он был контактом с высоким риском, который протекал бессимптомно, но был положительным по результатам ПЦР. Учитывая повышенные уровни АЛТ, АСТ и CRE у всех пациентов с БВВЭ, мы не смогли определить, повлияло ли лечение IFN β-1a отрицательно на эти биохимические измерения крови. 1 пациент (таблица 2, № 4) с отрицательным результатом ПЦР получил снижение дозы (3 × 10 6 МЕ), связанное с повышенными уровнями АСТ и АЛТ, и имел второй 2 последовательных отрицательных результата ПЦР на этой уменьшенной дозе.Другой пациент (№5) получил снижение дозы (3х10 6 МЕ) из-за быстрого исчезновения клинических симптомов и совпадающего первого отрицательного результата ПЦР. У этого пациента также был последовательный отрицательный результат ПЦР на сниженную дозу IFN β-1a. 1 пациент был прекращен из-за тяжелых клинических симптомов и впоследствии умер. 2 пациента получали лечение более 10 дней, пока они не стали отрицательными по результатам ПЦР (таблица 2). 3 из 9 пациентов, получавших IFN β-1a, умерли. Примечательно, что АЛТ, АСТ и CRE были значительно повышены у всех 3 умерших пациентов, несмотря на то, что у одного пациента (№ 7) наблюдалось снижение виремии крови по сравнению со значением CT, равным 20.1 в начале лечения IFN β-1a до значения CT 38 на 10-й день, когда пациент скончался от болезни (таблица 2).
Данные на фиг. 2 показывают процент выживаемости для контрольных пациентов (19% через 21 день) и пациентов, получавших IFN β-1a (67% через 21 день, логарифмический ранг p = 0,026). Отношение рисков (HR) для лечения, когда оно использовалось отдельно в модели, составляет 0,27, 95% ДИ: 0,08–0,94, p = 0,039 (критерий Вальда). Этот анализ показывает, что лечение полезно для пациентов с ЧСС 0,27 (без лечения — примерно 3.В 7 раз больше шансов умереть). Возраст и пол не влияли на выживаемость. HR для значений CT, как непрерывных, когда они используются только в модели, для необработанной контрольной когорты составляет 0,8, 95% ДИ: 0,62–0,97, p = 0,0234. Эти результаты показывают, что значения CT имеют прогностический эффект, при этом более высокие значения связаны с лучшей выживаемостью. С каждым уменьшением КТ на единицу риск смерти увеличивается в 1,25 раза. Когда модель настраивается на значения CT, эффект лечения становится слабее (HR = 0,79), а для CT немного сильнее (HR = 0.76 на каждую единицу увеличения значения CT). Этот анализ показывает, что для тех же значений CT риск смерти для нелеченых в 1,26 раза по сравнению с группой, получавшей IFN, и каждое уменьшение значения CT увеличивает риск смерти в 1,31 раза. Для значения CT 19 (медиана для CT) вероятность смерти для тех, кто не лечился, была в 1,35 раза больше, чем для тех, кто лечился. Из-за меньшего числа смертей в этой когорте невозможно скорректировать модель для большего количества ковариат.
Рис 2.Влияние лечения IFN β-1a на выживаемость пациентов с БВВЭ.
Кривые выживаемости для пациентов с БВВЭ, получавших только поддерживающую терапию (n = 21) (——) или поддерживающую терапию плюс лечение IFN β-1a (n = 9) (——). Выживаемость рассчитывалась от даты согласия для тех, кто получал лечение IFN β-1a, и даты госпитализации для тех, кто в контрольной когорте, до даты смерти. Графики выживаемости были основаны на оценках Каплана-Мейера, и графики сравнивались с использованием логарифмического рангового критерия (p = 0,026).
https://doi.org/10.1371/journal.pone.0169255.g002
Учитывая, что недавний анализ исходных значений компьютерной томографии подтверждает наши выводы об их прогностическом эффекте [18], мы расширили наш анализ влияния лечения на выживаемость как исход с использованием расширенной когорты нелеченных и инфицированных пациентов. Мы включили еще 17 пациентов, которые соответствовали пациентам, получавшим ИФН, по критериям отбора, основанным на сроках ≤ 6 дней с момента появления симптомов, возраста и на лечении в лечебном центре Гвинеи, которые лучше соответствовали исходным значениям КТ.Примечательно, что этих пациентов никогда не приглашали для участия в исследовании лечения IFN β-1a. Поскольку нам не были доступны данные о серийных значениях компьютерной томографии для этих дополнительных пациентов, мы использовали только жизненный статус (живые или мертвые) в качестве результата. Было проведено три анализа логистической регрессии: (i) анализ, в который были включены все пациенты: 9 леченных IFN и 38 контрольных. Результаты показывают, что лечение имеет значение, даже если модель скорректирована с учетом значения CT. У пациентов без лечения отношение шансов умереть 7.В 54 раза чаще, чем у леченных, с поправкой на значение CT. Для значения CT 20 (медиана для CT) вероятность смерти для тех, кто не лечился, была в 1,89 раза больше, чем для тех, кто лечился (таблица S1). (Ii) Анализ, в котором пациенты старше 50 лет (что является максимальным возрастом в Группа, обработанная IFN) и с исходными значениями CT <16 или> 31 (диапазон значений для группы, обработанной IFN) были исключены. У пациентов, не получавших лечения, вероятность смерти в 6,39 раза выше, чем у пациентов, получавших лечение, с поправкой на значение CT.Для значения CT 20 (медиана для CT) вероятность смерти для тех, кто не лечился, была в 1,81 раза выше, чем для тех, кто лечился (таблица S2). (iii) Соответствующий анализ. Каждого пациента из группы, получавшей IFN, сравнивали с группой пациентов из контрольной группы, так что разница в возрасте не превышала 5 лет, а разница CT не превышала 2. Для 5 пациентов были найдены подходящие совпадения: Для IFN 02 одно совпадение, для IFN 03 одно совпадение, для IFN 04 три совпадения, для IFN 08 два совпадения и для IFN 10 три совпадения.Для IFN 05, IFN 06, IFN 07 и IFN 09 совпадений не обнаружено, и они не вошли в этот анализ. Эффект лечения, основанный на условной логистической регрессии, является значимым (OR = 0,17, p = 0,012). У пациентов, не получавших лечения, вероятность смерти в 6,0 раз выше, чем у пациентов, получавших лечение. Вероятность смерти для тех, кто не лечился, была в 1,5 раза выше, чем для тех, кто лечился (таблица S3).
Затем была оценена скорость выведения вируса из крови с использованием исходной 21 контрольной когорты, для которой у нас были серийные данные (рис. 3).Чтобы устранить систематическую ошибку, связанную со значениями CT у пациентов, которые умерли от болезни, то есть не избавились от вируса, этот анализ проводился только на пациентах, которые были живы в конце исследования, то есть с удаленным вирусом. Мы наблюдаем тенденцию к более быстрому выведению у пациентов, получавших IFN β-1a, по сравнению с контрольной группой (рис. 3, вставка). Значения CT увеличиваются на 1,53 единицы / день в контроле и на 1,62 единицы / день для пациентов, получавших IFN. Разница (0,19) не является статистически значимой (p = 0,36).
Рис. 3. Влияние лечения IFN β-1a на клиренс вируса из крови.
Последовательные количественные значения ПЦР-КТ (пороговые значения цикла) в образцах венозной крови от участников исследования, которые оказались отрицательными при ПЦР (выжившие). * снижение дозы из-за повышенного уровня АСТ и АЛТ; ** снижение дозы из-за быстрого разрешения БВВЭ; ___ элементы управления; —— Обработка IFN β-1a. вставка: аппроксимированные графики значений CT для каждой группы.
https://doi.org/10.1371/journal.pone.0169255.g003
Симптомы пациентов регистрировались утром, днем и вечером для всех участников исследования. См. Таблицу 3. Частота и количество клинических симптомов описаны в Таблице S4. В целом данные в таблице 3 показывают, что лечение IFN-β-1a привело к более раннему разрешению многих клинических симптомов, в том числе связанных с желудочно-кишечной дисфункцией БВВЭ, а именно боли в животе, рвоты и диареи. На фоне лихорадки значения температуры колебались от 34 ° до 40 °.5 ° среди всех участников исследования (данные не показаны). Лихорадка не снижалась по-разному между двумя группами, с p-значением взаимодействия s = 0,069, 0,63, 0,82 для утра, дня и вечера, соответственно. В целом, в обеих группах лихорадка, по-видимому, немного снизилась во второй половине дня (0,07 ° C, p <0,001). Статистически значимого снижения температуры, измеренной утром или вечером, в обеих группах не наблюдалось (p = 0,069 и p = 0,93, соответственно). Пульс днем уменьшился на 0.6 в день в контрольной когорте (p = 0,19) и увеличивалось на 1,1 в день в группе, получавшей IFN β-1a (p = 0,0042). Разница между этими показателями (срок взаимодействия) была статистически значимой (р = 0,0053). Скорость изменения утреннего или вечернего пульса существенно не изменилась между двумя группами с течением времени (p = 0,33 и 0,19, соответственно). Точно так же скорость изменения систолического артериального давления не различалась между группами (p = 0,37 для утра, p = 0,92 для полудня и p = 0.49 для вечернего измерения).
Обсуждение
Эти предварительные результаты, осторожно интерпретированные, предполагают, что лечение IFN β-1a может быть связано с удалением вируса из крови, улучшением клинических характеристик и потенциально улучшением выживаемости (кратко изложено в Контрольном списке S1 CONSORT). Поскольку коэффициент летальности для БВВЭ связан с уровнем виремии в крови, результаты, представленные в настоящем документе, действительно необходимо интерпретировать с осторожностью, учитывая разницу в значениях CT между контрольной группой и пациентами, получавшими IFN β-1a, и ограниченный размер выборки.Несмотря на ограничения нерандомизированного исследования в одной группе, мы делаем вывод из этих данных, что лечение IFN β-1a заслуживает дальнейшего рассмотрения для лечения БВВЭ.
В начале вспышки и в последующие месяцы существовал значительный скептицизм в отношении потенциальной терапевтической эффективности интерферонов типа I. Наша стратегия вначале заключалась в оценке безопасности и эффективности лечения IFN, поэтому было принято решение использовать непегилированную версию IFN с коротким периодом полувыведения, которую можно было бы прекратить или снизить дозу с быстрым выздоровлением, чтобы решить проблему. потенциальные опасения по поводу нежелательных явлений.Более того, обширный клинический опыт с IFN-α и IFN-β подготовил нас к потенциальным неблагоприятным исходам и решениям для них. Решение о проведении этого исследования было основано на предварительных научных доклинических данных и, что, возможно, наиболее уместно, на отсутствии каких-либо одобренных противовирусных препаратов для лечения БВВЭ. Доступность и холодное хранение не представляли проблем, в отличие от других экспериментальных антивирусных препаратов, которые рассматривались во время недавней вспышки.
Уникальным аспектом этого испытания было то, что команда на месте состояла исключительно из 11 граждан Гвинеи.Медицинские работники впервые прошли соответствующее обучение по всем операционным и административным аспектам проведения исследования. В настоящее время в Гвинее работает группа из 11 человек, включая докторов медицины и административный персонал, которые обладают способностями и компетенциями для проведения клинических испытаний в соответствии с международными стандартами.
Хотя текущая вспышка БВВЭ в Западной Африке была объявлена ВОЗ 14 января 2016 г., в последующие дни в Сьерра-Леоне был зарегистрирован новый случай с выявленными контактами с риском развития БВВЭ.Следовательно, продолжает существовать возможность возобновления БВВЭ или появления дивергентной деформации [19]. Конечно, вакцины обладают потенциалом защиты населения от возродившегося штамма EBOV, идентичного тому, который отражен в нынешних вакцинах, находящихся на стадии оценки, но остается неясным, обеспечивают ли эти вакцины постконтактную защиту или какова продолжительность защиты до контакта. Соответственно, существует потребность в противовирусных препаратах, которые обеспечивают более широкий спектр активности против различных штаммов EBOV.В целом полученные данные подтверждают дальнейшую оценку IFN β-1a для лечения БВВЭ.
Вспомогательная информация
S3 Таблица. Сопоставленный анализ: исходные характеристики и регрессионный анализ влияния лечения на выживаемость.
Для каждого пациента в группе IFN была предпринята попытка сопоставить с нелеченными пациентами, у которых разница в возрасте была менее 5 лет и разница в исходном значении CT составляла менее 2 единиц. Для 5 пациентов были найдены подходящие совпадения: для IFN 02 одно совпадение, для IFN 03 одно совпадение, для IFN 04 три совпадения, для IFN 08 два совпадения и для IFN 10 три совпадения.Для IFN 05, IFN 06, IFN 07 и IFN 09 совпадений не обнаружено, и они не вошли в этот анализ.
https://doi.org/10.1371/journal.pone.0169255.s004
(DOCX)
S4 Таблица. Влияние IFN β-1a на частоту клинических симптомов, связанных с БВВЭ.
Симптомы регистрировались утром, после полудня и е (вечером), как указано. Что касается астении после полудня (выделено серым цветом), этот симптом оставался относительно неизменным в течение 3 периодов времени, исследованных среди контрольной группы, получавшей только поддерживающую терапию (54%, 74%, 56%), и значение p не является значимым ( р = 0.47). Для пациентов, получавших IFN ß-1a, частота астении (pm) снижается в течение 3 периодов времени (69%, 43%, 8%) с OR в этой группе 0,65 и p <0,0001. При сравнении OR между историческим контролем и группой, получавшей IFN, OR в контрольной группе в 1,65 раза больше, чем OR в группе, получавшей IFN, следовательно, значимость записана в последнем столбце таблицы 3.
https://doi.org/10.1371/journal.pone.0169255.s005
(DOCX)
Благодарности
Европейская мобильная лаборатория.персонал, обеспечивающий лабораторную поддержку в Coyah ETU: Софи Дураффур (*, §), Джозеф Акой Бор (*), Фара Раймонд Кундуно (*), Джулия Хинцманн (*, $), Марк Мертенс (*,%), Инес Виториано ( *, &), Кристофер Х. Лог (*, &), Ян Питер Ботчер (*, $), Элиза Паллаш (*, §), Андреас Сакс (*, $), Амаду Ба (*, #), Мар Кабеса -Cabrerizo (*, §), Катя Ницше (*, §), Ева Куисма (*, &), Джанин Мишель (*, $), Тобиас Холм (*, §), Эльза Г. Зекенг (*, = ,! ), Изабель Гарсия-Доривал (*, =).
(*) Европейский консорциум мобильных лабораторий, Институт тропической медицины Бернхарда-Нохта,
Гамбург, Германия
(§) Институт тропической медицины Бернхарда Нохта, Гамбург, Германия
($) Институт Роберта Коха, Берлин, Германия
(%) Институт Фридриха Лёффлера, Грайфсвальд, Германия
(&) Public Health England, Porton Down, Wiltshire, UK
(#) Швейцарский институт тропиков и общественного здравоохранения, Базель, Швейцария
(=) Институт инфекций и глобального здравоохранения Ливерпульского университета, Ливерпуль, Великобритания
(!) Отдел исследований защиты здоровья NIHR по возникающим и зоонозным инфекциям, Ливерпульский университет, Ливерпуль, Великобритания
Авторы благодарят Biogen Inc.за подарок IFN β-1a (лекарственный препарат AVONEX в жидкой форме) и за поддержку нескольких сотрудников компании, без которых исследование было бы невозможно. Авторы также благодарят правительство Гвинеи и доктора Кристофера Пейджа, бывшего вице-президента по исследованиям, UHN, за их поддержку.
Вклад авторов
- Концептуализация: ENF MKK.
- Формальный анализ: ENF MP.
- Финансирование: ENF.
- Исследование: MKK FAT MSS AC AAB DM AB M3C IK AAR AHB ENF.
- Методология: ЭНФ МКК ДПБ МП.
- Администрация проекта: ENF MKK.
- Ресурсы: SG.
- Надзор: ENF MKK.
- Подтверждение: ENF MKK SG.
- Визуализация: ENF.
- Написание — первоначальный эскиз: ENF DPB MP.
- Написание — просмотр и редактирование: MKK ENF.
Ссылки
- 1.Feldmann H, Geisbert TW. Геморрагическая лихорадка Эбола. Ланцет 2011; 377: 849–862. pmid: 21084112
- 2. Bah EI, Lamah MC, Fletcher T., Jacob ST, Brett-Major DM, Sall AA et al. Клиническая картина пациентов с болезнью, вызванной вирусом Эбола, в Конакри, Гвинея. N Engl J Med. 2015; 372: 40–47. pmid: 25372658
- 3. Мартинес MJ, Салим AM, Уртадо JC, Kilgore PE. Инфекция, вызванная вирусом Эбола: обзор и обновленная информация о профилактике и лечении. Заражение Dis Ther. 2015; 4: 365–90.pmid: 26363787
- 4. ВОЗ: apps.who.int/ebola-situation-reports
- 5. Фэй О, Андронико А., Фэй О, Салье Х., Боэлл П.Й., Магассуба Н. и др. Использование виремии для оценки исходного коэффициента летальности от болезни, вызванной вирусом Эбола, и получения информации для исследований лечения: ретроспективное когортное исследование. PLOS Med. 2015; 12: e1001908. pmid: 26625118
- 6. Ван БХ, Рыба EN. Инь и Ян вирусов и интерферонов. Trends Immunol. 2012; 33: 190–197. pmid: 22321608
- 7.Карденас В.Б., Лоо Ю.М., Гейл М-младший, Хартман А.Л., Кимберлин С.Р., Мартинес-Собридо Л. и др. J Virol. 2006; 80: 5168–5178. pmid: 16698997
- 8. Йен Б., Малдер LC, Мартинес О., Basler CF. Молекулярная основа подавления эболавирусом VP35 созревания дендритных клеток человека. J Virol. 2014; 88: 12500–12510. pmid: 25142601
- 9. Audet J, Kobinger GP. Иммунное уклонение при эболавирусных инфекциях. Viral Immunol. 2015; 28: 1–9.
- 10. Smith LM, Hensley LE, Geisbert TW, Johnson J, Stossel A, Honko A et al.Терапия интерфероном-β продлевает выживаемость на моделях макак-резус при Эболе и геморрагической лихорадке Марбург. J Infect Dis. 2013; 208: 310–318. pmid: 23255566
- 11. Ярлинг П.Б., Гейсберт Т.В., Гейсберт Дж.Б., Сверенген Дж.Р., Бра М, Яакс Н.К. и др. Оценка иммуноглобулина и рекомбинантного интерферона-α2b для лечения экспериментальных инфекций, вызванных вирусом Эбола. J Infect Dis. 1999; 179: S224–234. pmid: 9988188
- 12. Цю Х, Вонг Дж., Фернандо Л., Одет Дж., Белло А., Стронг Дж. И др.mAb и терапия с использованием Ad-вектора IFN-α спасают инфицированных эболой нечеловеческих приматов при введении после обнаружения виремии и симптомов. Science Transl Med. 2013; 5: 1–10.
- 13. Ричардсон Дж. С., Вонг Дж., Пиллет С., Шиндл С., Эннис Дж., Тернер Дж. И др. Оценка различных стратегий постконтактного лечения инфекции вирусом Эбола у грызунов. J Bioterr Biodef. 2011; S1: 007.
- 14. Хатчинсон К.Л., Роллин ЧП. Экспрессия цитокинов и хемокинов у людей, инфицированных суданским вирусом Эбола.J Infect Dis. 2007; 196: S357 – S363. pmid: 17940971
- 15. McCarthy SD, Majchrzak-Kita B, Racine T., Kozlowski HN, Baker DP, Hoenen T. et al. Быстрый скрининговый анализ определяет монотерапию интерфероном-β и комбинированную терапию с аналогами нуклеозидов как эффективные ингибиторы вируса Эбола. PLOS NTD 2016; 10: e0004364.
- 16. КТО. Клиническое ведение пациентов с вирусной геморрагической лихорадкой: карманный справочник для рядового работника. http: //www.who.Int / CSR / ресурсы / публикации / клинические-менеджмент-пациенты / en /
- 17. Хохберг Х. Более точная процедура Бонферрони для множественных тестов значимости. Биометрика 1988; 75: 800–803.
- 18. Sissoko D, Laouenan C, Folkesson E, M’Lebing AB, Beavogui AH, S. Baize S et al. Экспериментальное лечение болезни, вызванной вирусом Эбола, с помощью фавипиравира (испытание JIKI): исторически контролируемое одностороннее испытание с подтверждением концепции в Гвинее. PLOS Med. 2016; 10: 1001967.
- 19.Де ла Вега М.А., Штейн Д., Кобингер Г.П. Эволюция эболавируса: прошлое и настоящее. PLOS Pathogens 2015; 11: e1005221. pmid: 26562671
Семейство интерферонов (IFN) — Creative Diagnostics
Обзор
Интерфероны (IFN) представляют собой группу сигнальных белков, вырабатываемых и высвобождаемых клетками-хозяевами в ответ на присутствие нескольких патогенов, таких как вирусы, бактерии, паразиты и опухолевые клетки.В типичном сценарии инфицированная вирусом клетка выделяет интерфероны, заставляя соседние клетки повышать свою противовирусную защиту.
IFN относятся к большому классу белков, известных как цитокины / молекулы, которые используются для связи между клетками, чтобы запустить защитные механизмы иммунной системы, которые помогают уничтожить патогены. Интерфероны названы из-за их способности «мешать» репликации вирусов, защищая клетки от вирусных инфекций. IFN также имеют различные другие функции: они активируют иммунные клетки, такие как естественные клетки-киллеры и макрофаги; они повышают защиту хозяина за счет активации презентации антигена за счет увеличения экспрессии антигенов главного комплекса гистосовместимости (MHC).Определенные симптомы инфекций, такие как лихорадка, мышечная боль и «симптомы гриппа», также вызваны выработкой IFNs и других цитокинов.
Члены IFN
У животных, включая человека, идентифицировано более двадцати различных генов и белков IFN. Обычно их делят на три класса: IFN типа I, IFN типа II и IFN типа III. IFN, принадлежащие ко всем трем классам, важны для борьбы с вирусными инфекциями и для регуляции иммунной системы.
Таблица 1. Продукты, относящиеся к семейству IFN
Все IFN типа I связываются со специфическим рецепторным комплексом клеточной поверхности, известным как рецептор IFN-α / β (IFNAR), который состоит из цепей IFNAR1 и IFNAR2. Интерфероны типа I, присутствующие в организме человека, представляют собой IFN-α, IFN-β, IFN-ε, IFN-κ и IFN-ω.
Рисунок 1. Трехмерная структура человеческого интерферона бета.
| IFN-α | Белки IFN-α продуцируются лейкоцитами.Они в основном участвуют в врожденном иммунном ответе против вирусной инфекции. Гены, ответственные за их синтез, делятся на 13 подтипов, которые называются IFNA1, IFNA2, IFNA4, IFNA5, IFNA6, IFNA7, IFNA8, IFNA10, IFNA13, IFNA14, IFNA16, IFNA17, IFNA21. Эти гены находятся вместе в кластере на хромосоме 9. IFN-α также производится синтетически в качестве лекарства от лейкемии волосатых клеток. Международное непатентованное название (МНН) продукта — интерферон альфа. Рекомбинантный тип — интерферон альфакон-1.Пегилированные типы представляют собой пегилированный интерферон альфа-2a и пегилированный интерферон альфа-2b. |
| IFN-β | Белки IFN-β в больших количествах продуцируются фибробластами. Они обладают противовирусной активностью, которая участвует в основном в врожденном иммунном ответе. Были описаны два типа IFN-β: IFN-β1 (IFNB1) и IFN-β3 (IFNB3) (ген, обозначенный IFN-β2, на самом деле является IL-6). IFN-β1 используется для лечения рассеянного склероза, поскольку он снижает частоту рецидивов.IFN-β1 не подходит для лечения пациентов с прогрессирующими, не рецидивирующими формами рассеянного склероза. |
| IFN-κ | Интерферон каппа, также известный как IFN-каппа, представляет собой белок, который у человека кодируется геном IFNK. IFN-каппа является членом семейства интерферонов типа I. Интерфероны типа I представляют собой группу родственных гликопротеинов, которые играют важную роль в защите хозяина от вирусных инфекций.Этот белок экспрессируется в кератиноцитах, и ген находится на хромосоме 9, рядом с кластером интерферона типа I. |
| IFN-ω | IFN-ω, хотя и имеет только одну функциональную форму, описанную на сегодняшний день (IFNW1), имеет несколько псевдогенов: IFNWP2, IFNWP4, IFNWP5, IFNWP9, IFNWP15, IFNWP18 и IFNWP19 у человека. Многие плацентарные млекопитающие, не являющиеся приматами, экспрессируют несколько подтипов IFN-ω. |
Единственный член составляет интерфероны типа II (IFN), которые называются IFN-γ (гамма).Зрелый IFN-γ представляет собой антипараллельный гомодимер, который связывается с комплексом рецептора IFN-γ (IFNGR), чтобы вызвать сигнал в своей клетке-мишени. IFNGR состоит из двух субъединиц, и каждая из молекул обозначает IFNGR1 и IFNGR2.
IFN-γ участвует в регуляции иммунных и воспалительных реакций; у человека есть только один тип гамма-интерферона. Он вырабатывается активированными Т-клетками и естественными клетками-киллерами. IFN-γ обладает некоторыми противовирусными и противоопухолевыми эффектами, но, как правило, слабыми.Однако этот цитокин усиливает действие IFN типа I. IFN-γ, выделяемый клетками Th2, привлекает лейкоциты к месту инфекции, что приводит к усилению воспаления. Он также стимулирует макрофаги убивать бактерии, которые были поглощены. IFN-γ, выделяемый клетками Th2, также важен для регуляции ответа Th3. Поскольку IFN-γ жизненно важен для регуляции иммунного ответа, его продукция может приводить к аутоиммунным нарушениям.
Фигура 2.Трехмерная структура гамма-интерферона человека.
Недавно классифицированная группа интерферонов типа III состоит из трех молекул IFN-λ (лямбда), называемых IFN-λ1, IFN-λ2 и IFN-λ3 (также называемых IL29, IL28A и IL28B соответственно). Эти сигналы IFN через рецепторный комплекс состоят из IL10R2 (также называемого CRF2-4) и IL28RA (также называемого IFNLR1, CRF2-12). Недавно новый белок со сходной функцией, связанный с IFN-λ3, был обнаружен в том же геномном локусе и был обозначен как IFN-λ4.Его внутриклеточная передача сигналов осуществляется через IFNLR1 и, следовательно, считается интерфероном типа III. Однако доказательства его биологической активности in vivo все еще остаются спорными.
IL29 | Интерлейкин-29 (IL-29) представляет собой белок, который у человека кодируется геном IL29, который находится на хромосоме 19. Он является членом семейства спиральных цитокинов и представляет собой интерферон III типа.Он также известен как IFNλ1 и очень похож по аминокислотной последовательности на IL-28, другой интерферон типа III. IL-29 играет важную роль в защите хозяина от микробов, и его ген в высокой степени регулируется в клетках, инфицированных вирусами. IL29 не присутствует в геноме мыши. |
| IL28 | Интерлейкин-28 (IL-28) представляет собой цитокин, который представлен в двух изоформах, IL-28A и IL-28B, и играет роль в иммунной защите от вирусов, включая индукцию «антивирусного состояния» путем включения белков Mx, 2 ‘, 5’-олигоаденилатсинтетаза, а также ISGF3G (фактор 3 генов, стимулированный интерфероном).IL-28A и IL-28B относятся к семейству цитокинов интерферона III типа и очень похожи (по аминокислотной последовательности) на IL-29. Их классификация как интерферонов обусловлена их способностью вызывать противовирусное состояние, в то время как их дополнительная классификация как цитокинов обусловлена их хромосомным положением, а также тем фактом, что они кодируются несколькими экзонами, в отличие от одного экзона, как большинство типов. -I IFNs есть. |
Функции сотовой связи
Все интерфероны обладают несколькими общими эффектами: они являются противовирусными агентами и модулируют функции иммунной системы.Экспериментально показано, что введение IFN типа I ингибирует рост опухоли у животных, но положительное действие в отношении опухолей человека широко не документировано. Клетка, инфицированная вирусом, выделяет вирусные частицы, которые могут заразить соседние клетки. Однако инфицированная клетка может подготовить соседние клетки к потенциальной инфекции вирусом, высвобождая интерфероны. В ответ на интерферон клетки продуцируют большое количество фермента, известного как протеинкиназа R (PKR). Этот фермент фосфорилирует белок, известный как eIF-2, в ответ на новые вирусные инфекции; фосфорилированный eIF-2 образует неактивный комплекс с другим белком, называемым eIF2B, для снижения синтеза белка в клетке.Другой клеточный фермент, РНКаза L, также индуцируемый действием интерферона, разрушает РНК внутри клеток, чтобы еще больше снизить синтез белка как вирусных генов, так и генов хозяина. Подавленный синтез белка разрушает как вирус, так и инфицированные клетки-хозяева. Кроме того, интерфероны индуцируют выработку сотен других белков, известных под общим названием гены, стимулированные интерфероном (ISG), которые играют роль в борьбе с вирусами и других действиях, вызываемых интерфероном. Они также ограничивают распространение вируса за счет увеличения активности р53, который убивает инфицированные вирусом клетки, способствуя апоптозу.Влияние IFN на p53 также связано с его защитной ролью против некоторых видов рака.
Другой функцией интерферонов является активация основных молекул комплекса гистосовместимости, MHC I и MHC II, и повышение активности иммунопротеасом. Более высокая экспрессия MHC I увеличивает представление вирусных пептидов цитотоксическим Т-клеткам, в то время как иммунопротеасома обрабатывает вирусные пептиды для загрузки на молекулу MHC I, тем самым увеличивая узнавание и уничтожение инфицированных клеток.Более высокая экспрессия MHC II увеличивает представление вирусных пептидов хелперным Т-клеткам; эти клетки выделяют цитокины (например, большее количество интерферонов и интерлейкинов, среди прочих), которые сигнализируют и координируют активность других иммунных клеток. Интерфероны, такие как гамма-интерферон, непосредственно активируют другие иммунные клетки, макрофаги и естественные клетки-киллеры.
Рис. 3. Линейное и мультипликационное изображение димера IFNγ.
Роль в заболевании
Интерферон бета-1a и интерферон бета-1b используются для лечения и контроля рассеянного склероза, аутоиммунного заболевания.Это лечение эффективно для уменьшения приступов рецидивирующе-ремиттирующего рассеянного склероза и замедления прогрессирования и активности заболевания при вторично прогрессирующем рассеянном склерозе.
Интерфероновая терапия используется (в сочетании с химиотерапией и лучевой терапией) для лечения некоторых видов рака. Это лечение можно использовать при гематологических злокачественных новообразованиях; лейкоз и лимфомы, включая лейкоз волосатых клеток, хронический миелоидный лейкоз, узловую лимфому и кожную Т-клеточную лимфому.Пациенты с рецидивирующими меланомами получают рекомбинантный IFN-α2b. И гепатит В, и гепатит С лечат IFN-α, часто в сочетании с другими противовирусными препаратами. Некоторые из тех, кто лечится интерфероном, обладают устойчивым вирусологическим ответом и могут элиминировать вирус гепатита. Наиболее опасный штамм — вирус гепатита С генотипа I — можно лечить с 60-80% успешностью лечения с помощью действующего стандарта лечения интерфероном-α, рибавирином и недавно одобренными ингибиторами протеазы, такими как телапревир (Инсивек), май 2011 г. , Боцепревир (Victrelis) май 2011 г. или ингибитор нуклеотидного аналога полимеразы Софосбувир (Sovaldi) декабрь 2013 г.Биопсия пациентов, получавших лечение, показывает уменьшение повреждений печени и цирроза. Некоторые данные показывают, что введение интерферона сразу после заражения может предотвратить хронический гепатит С, хотя диагностика на ранней стадии инфекции затруднена, поскольку физические симптомы на ранней стадии инфицирования гепатитом С редки. Контроль хронического гепатита С с помощью IFN связан с уменьшением гепатоцеллюлярной карциномы.
Имеются доказательства низкого качества, свидетельствующие о том, что глазные капли с интерфероном могут быть эффективным средством лечения людей с эпителиальным кератитом, вызванным вирусом простого герпеса, типом глазной инфекции.Нет четких доказательств того, что удаление инфицированной ткани (санация) с последующим нанесением капель интерферона является эффективным подходом к лечению этих типов глазных инфекций. Доказательства низкого качества предполагают, что комбинация интерферона и противовирусного агента может ускорить процесс заживления по сравнению с одной противовирусной терапией.
Артикулы:
| 1. | Де Андреа М., Равера Р., Джоя Д., Гариглио М., Ландольфо С. (2002).«Интерфероновая система: обзор». Европейский журнал детской неврологии . 6 Suppl A (6): A41–6; обсуждение A55–8. |
| 2. | Леви Д.Е., Мари И. Дж., Дурбин Дж. Э. (декабрь 2011 г.). «Индукция и функция интерферона типа I и III в ответ на вирусную инфекцию». Текущее мнение в области вирусологии. 1 (6): 476–86. |
| 3. | Германт П., Михильс Т. (2014).«Интерферон-λ в контексте вирусных инфекций: продукция, ответ и терапевтические последствия». Журнал врожденного иммунитета . 6 (5): 563–74. |
| 4. | Navratil V, de Chassey B, Meyniel L, Pradezynski F, André P, Rabourdin-Combe C, Lotteau V (июль 2010 г.). «Сравнение на системном уровне белок-белковых взаимодействий между вирусами и сетью системы интерферона человека I типа». Журнал протеомных исследований. 9 (7): 3527–36. |
| 5. | Шарифф К.А., Дункан Д., Юноси З. (февраль 2002 г.). «Достижения в лечении хронического гепатита С:« пегилированные »интерфероны». Медицинский журнал Кливлендской клиники. 69 (2): 155–9. |
| 6. | Тан Й.Х., Тишфилд Дж., Раддл Ф.Х. (февраль 1973 г.). «Связывание генов человеческого интерферон-индуцированного противовирусного белка и признаков индофенолоксидазы-B с хромосомой G-21». 2019 © Все права защищены. |

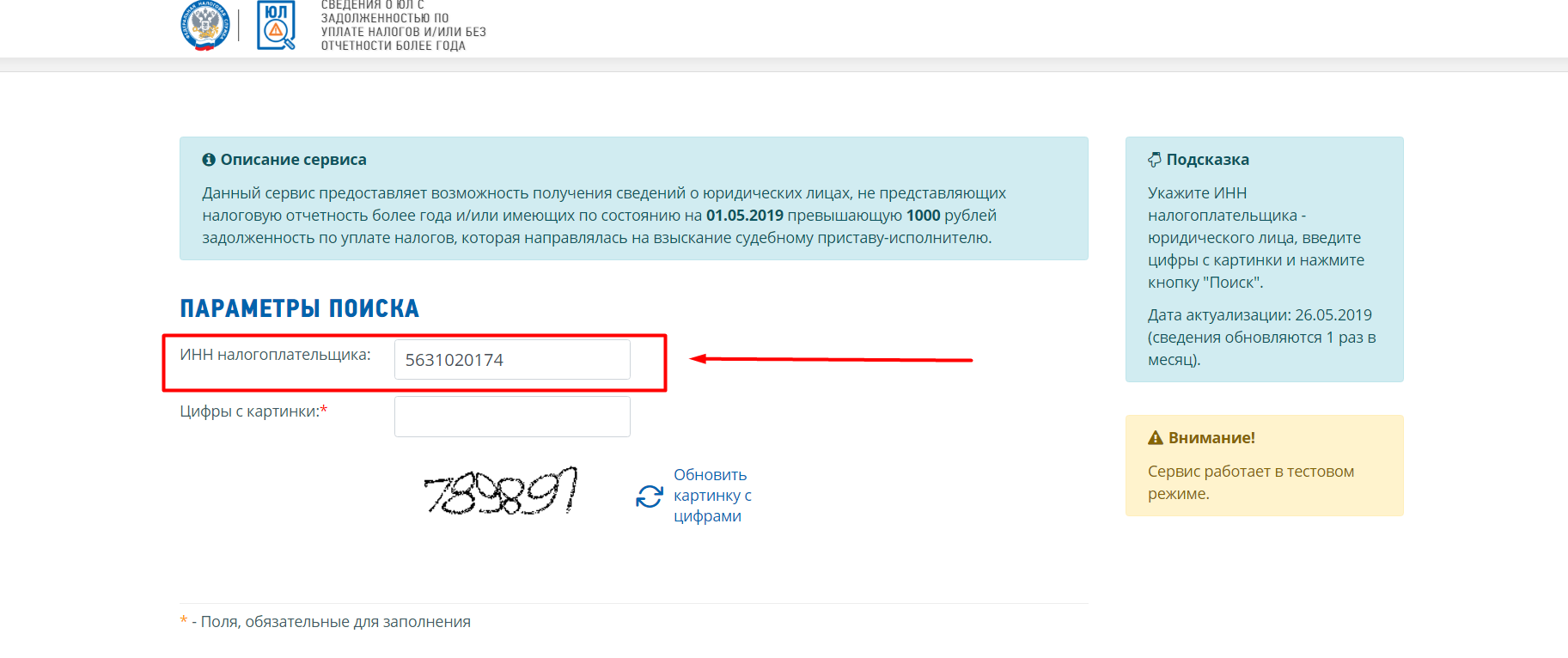 Москва, Старый Петровско-Разумовский проезд, д.1/23, стр.1
Москва, Старый Петровско-Разумовский проезд, д.1/23, стр.1 esphere.ru
esphere.ru 6
6 Санкт-Петербург, ул. Шпалерная, д. 26
Санкт-Петербург, ул. Шпалерная, д. 26 Санкт-Петербург, ул.Шпалерная,26
Санкт-Петербург, ул.Шпалерная,26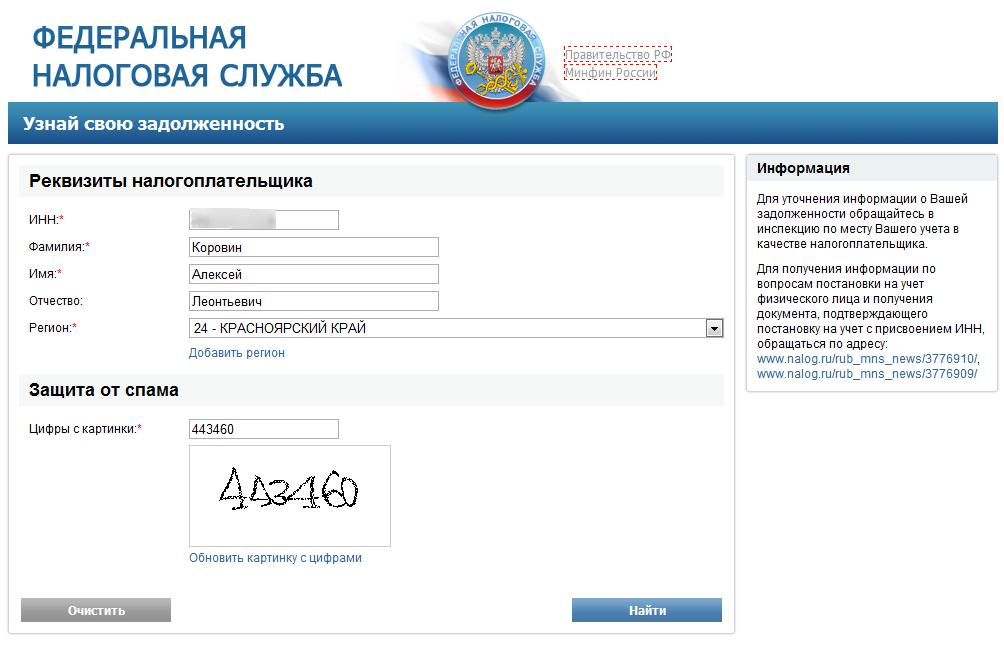 Санкт-Петербург, ул.Кронштадтская, д.10, лит.А
Санкт-Петербург, ул.Кронштадтская, д.10, лит.А net/
net/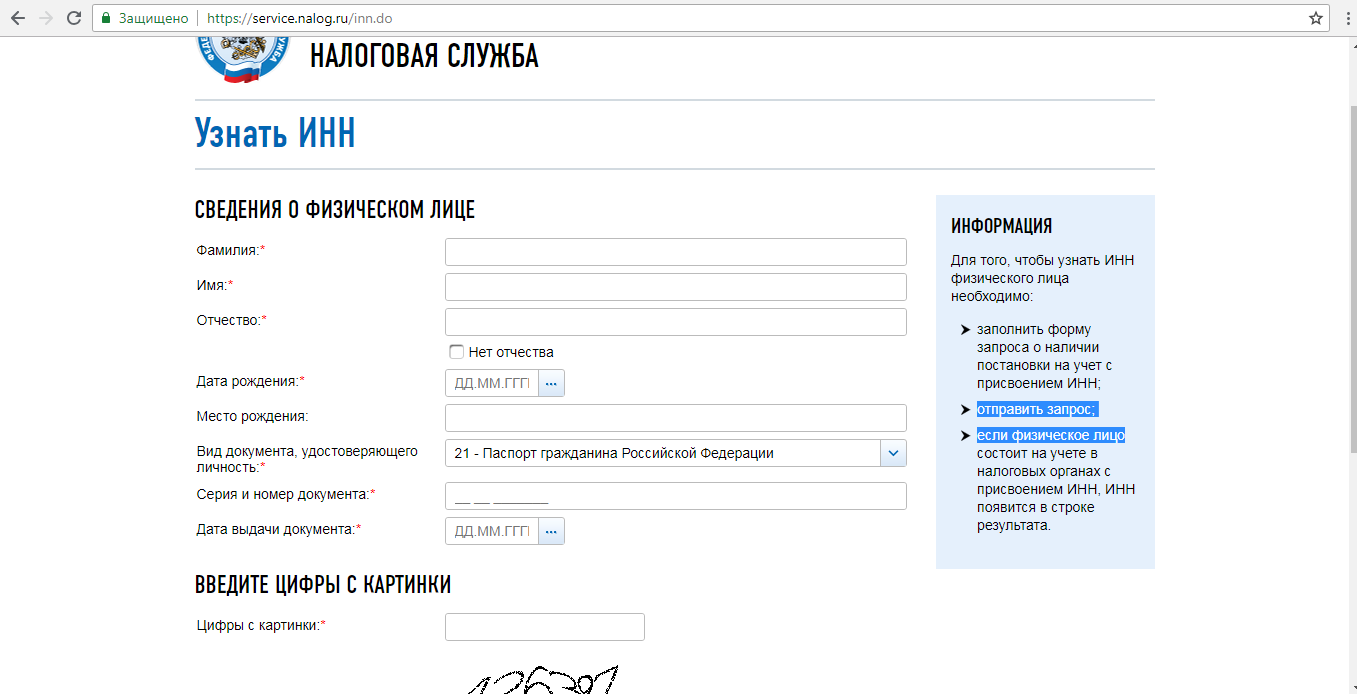 stek-trust.ru/
stek-trust.ru/ pro
pro Софьи Перовской, д.83
Софьи Перовской, д.83 Красноярск, ул. 78й Добровольческой бригады 2, офис 242
Красноярск, ул. 78й Добровольческой бригады 2, офис 242 r73.center-inform.ru/
r73.center-inform.ru/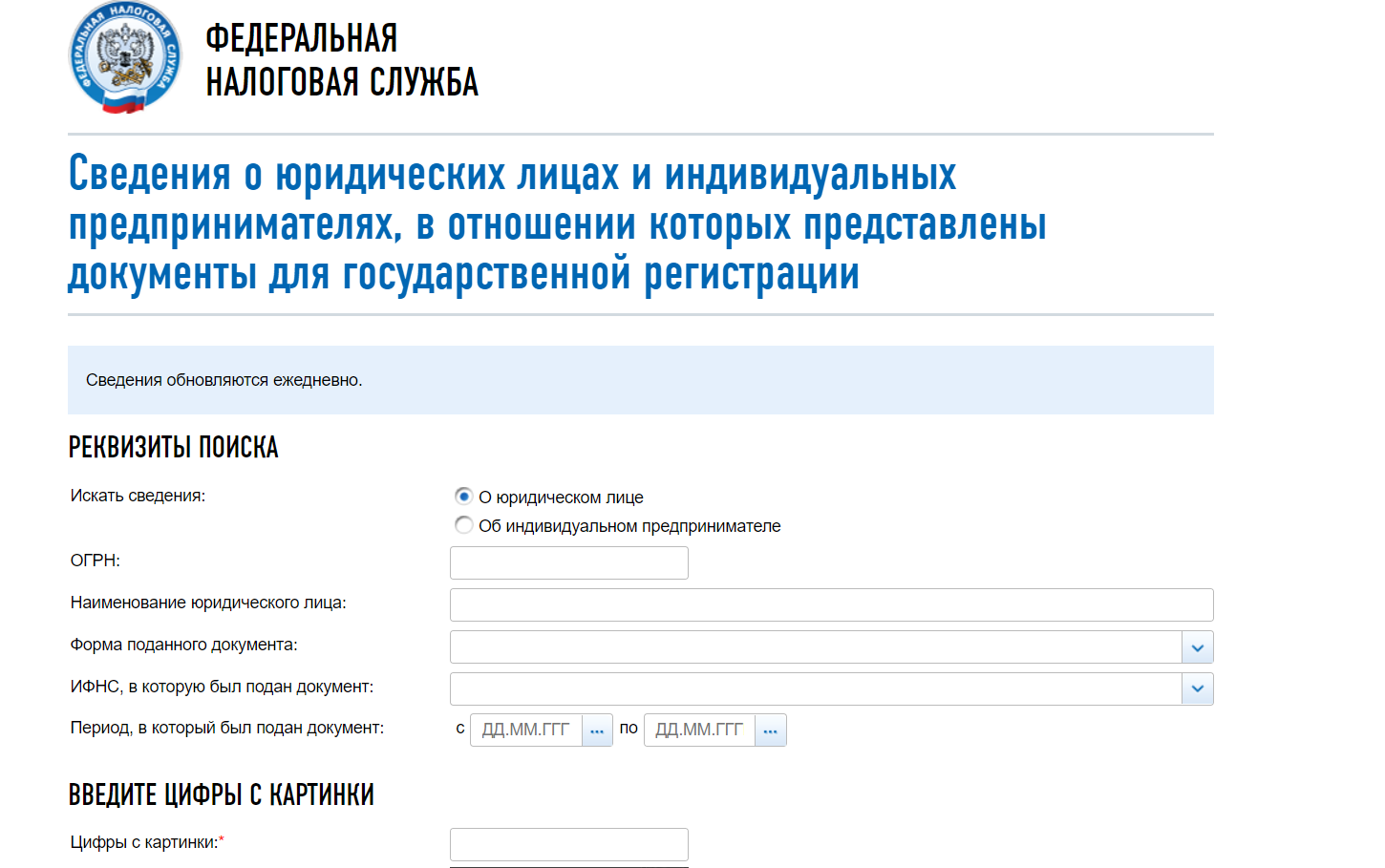 ekey.ru/
ekey.ru/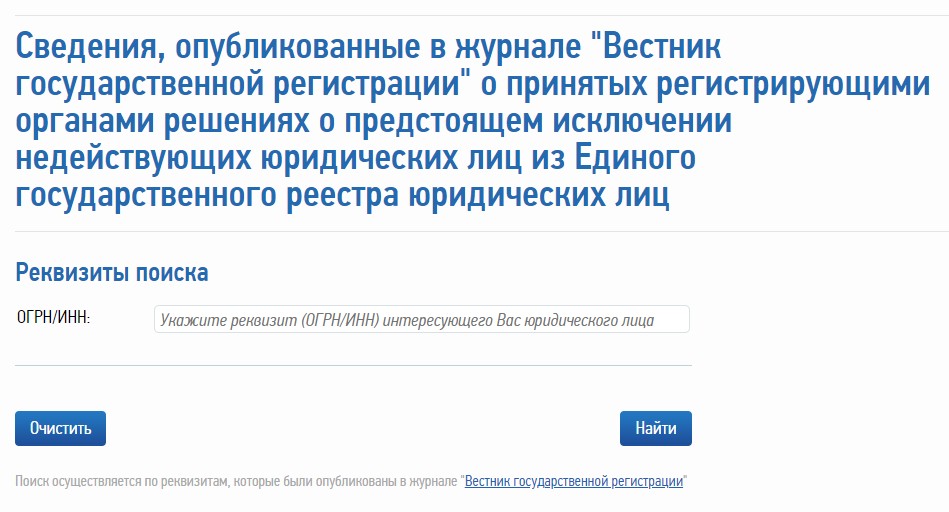 69
69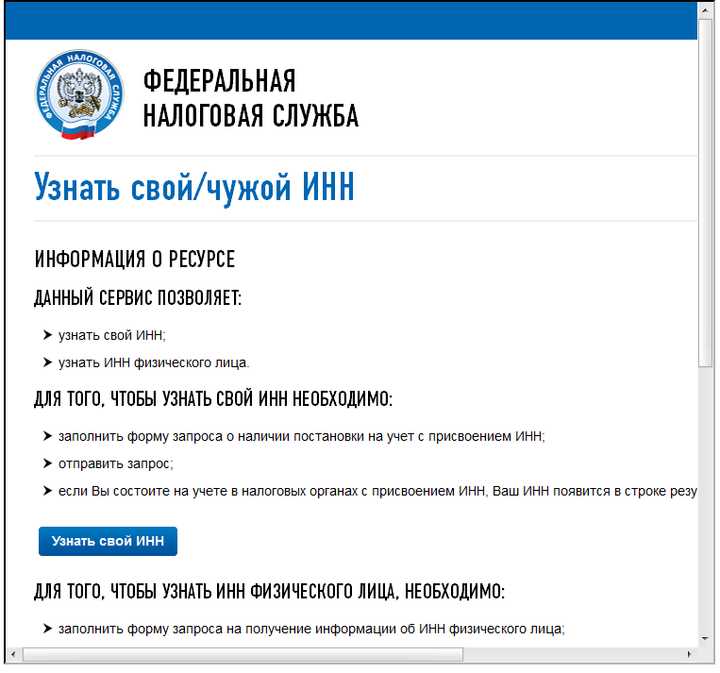 Казань, ул. К.Насыри, д.28
Казань, ул. К.Насыри, д.28 Магадан, ул. Якутская, д.73/1, стр. 1
Магадан, ул. Якутская, д.73/1, стр. 1 , г. Екатеринбург, ул. Первомайская, д. 15 офис 1204
, г. Екатеринбург, ул. Первомайская, д. 15 офис 1204 5.стр. 2
5.стр. 2 Москва, Рублевское ш., д.28, комн. 21
Москва, Рублевское ш., д.28, комн. 21 13
13