Получение аммиака в промышленности и в лаборатории из азота
4.2
Средняя оценка: 4.2
Всего получено оценок: 266.
4.2
Средняя оценка: 4.2
Всего получено оценок: 266.
Аммиак (NH3) – соединение азота и водорода. Это лёгкий газ с резким запахом. Получение аммиака в промышленности и лабораториях необходимо для производства удобрений, полимеров, азотной кислоты и других веществ.
В промышленности
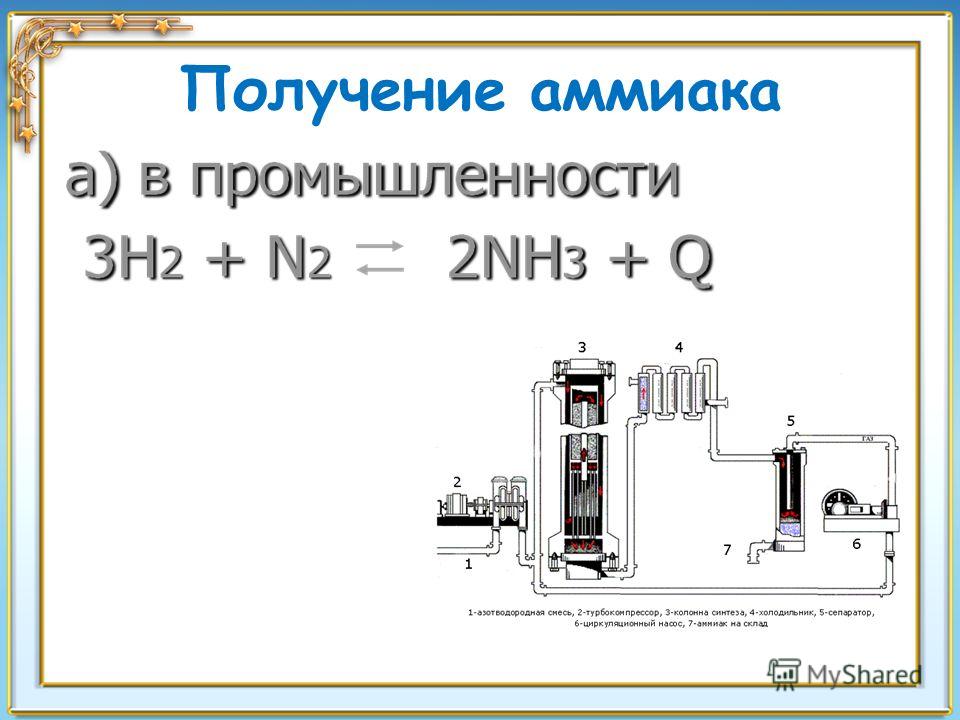
Аммиак промышленным путём получают из азота, соединяя его с водородом. Азот берут из воздуха, водород – из воды. Впервые метод разработал немецкий химик Фриц Габер. Промышленный способ получения аммиака стали называть процессом Габера.
Реакция проходит с уменьшением объёма и выделением энергии в виде тепла:
3H2 + N2 → 2NH3 + Q.
Реакция обратима, поэтому необходимо соблюсти несколько условий. При высоком давлении и низких температурах объём полученного аммиака увеличивается. Однако низкие температуры замедляют скорость реакции, а повышение температуры способствует увеличению скорости обратной реакции.
Однако низкие температуры замедляют скорость реакции, а повышение температуры способствует увеличению скорости обратной реакции.
Опытным путём были найдены необходимые условия для проведения реакции:
- температура – 500°C;
- давление – 350 атм;
- катализатор – оксид железа Fe3O4 (магнетит) с примесями оксидов серебра, калия, кальция и других веществ.
При таких условиях получившийся газ содержит 30 % аммиака. Чтобы избежать обратной реакции, вещество быстро охлаждают. При низких температурах получившийся газ превращается в жидкость. Неизрасходованные газы – азот и водород – возвращаются обратно в колонну для синтеза. Такой способ помогает быстро получить большие объёмы аммиака, максимально используя сырьё.
Рис. 1. Получение аммиака промышленным путём.Чтобы найти нужный катализатор, было испробовано 20 тысяч разных веществ.
В лаборатории
Для получения аммиака в лаборатории используется реакция щелочей на соли аммония:
NH4Cl + NaOH → NH3↑ + NaCl + H2O
Также аммиак лабораторным путём можно получить из хлорида аммония, нагретого вместе с гашёной известью, или разложением гидроксида аммония:
- 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O;
- NH4OH ↔ NH3↑ + H2O.

Полностью осушить аммиак можно с помощью смеси извести с едким натрием, через которую пропускают полученный газ. Для этой же цели жидкий аммиак смешивают с металлическим натрием и подвергают дистилляции.
Аммиак легче воздуха, поэтому для его сбора пробирку держат вверх дном.
Применение
Аммиак используется в разных отраслях:
- в сельском хозяйстве – для производства азотсодержащих удобрений;
- в промышленности – для производства полимеров, взрывчатых веществ, искусственного льда;
- в химии – для изготовления азотной кислоты, соды;
- в медицине – в качестве нашатырного спирта.
Что мы узнали?
Аммиак получают промышленным и лабораторным путём. Для получения в промышленных масштабах используется азот и водород. Смешиваясь под высокой температурой, давлением и под действием катализатора, простые вещества образуют аммиак. Чтобы реакция при высокой температуре не пошла в обратную сторону, газ охлаждают. В лаборатории аммиак получают при реакции солей аммония со щелочами, гашёной известью или путём разложения гидроксида аммония. Аммиак применяется в химической промышленности, сельском хозяйстве, медицине, химии.
В лаборатории аммиак получают при реакции солей аммония со щелочами, гашёной известью или путём разложения гидроксида аммония. Аммиак применяется в химической промышленности, сельском хозяйстве, медицине, химии.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.Максим Гордеев
4/5
Оценка доклада
4.2
Средняя оценка: 4.2
Всего получено оценок: 266.
А какая ваша оценка?
Аммиак: способы получения и химические свойства
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3о:
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара.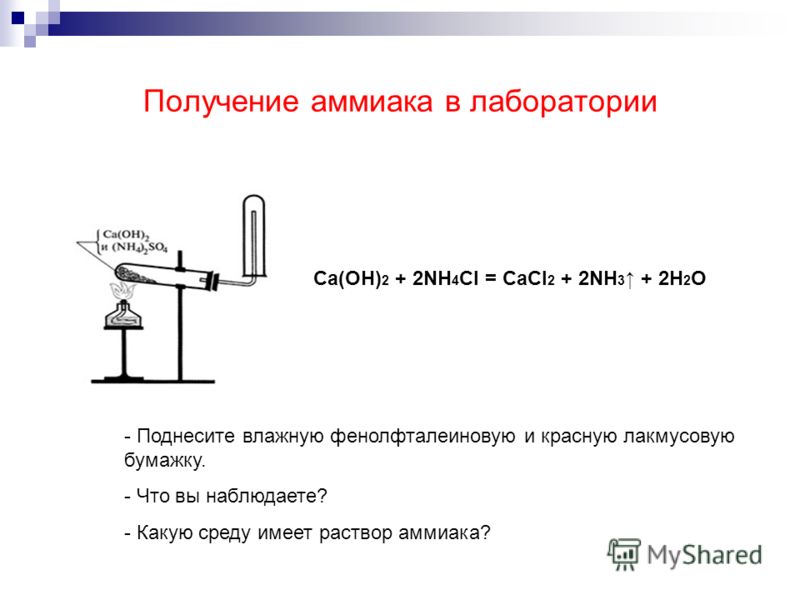 Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поскольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например, аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
2NH4Cl + Са(OH)2 → CaCl2 + 2NH3 + 2Н2O
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например, гидролиз нитрида кальция:
Ca3N2 + 6H2O → ЗСа(OH)2 + 2NH3
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
N2 + 3Н2 ⇄ 2NH3
Процесс проводят при температуре 500-550оС и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H+), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
:NH3 + H2O ⇄ NH4+ + OH–
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание. При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например, аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
Еще один пример: аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
NH3 + H2O + CO2 → NH4HCO3
2NH3 + H2O + CO2 → (NH4)2CO3
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов, образуя нерастворимые гидроксиды.
Например, водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
FeSO4 + 2NH3 + 2H2O → Fe(OH)2 + (NH4)2SO4
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например, хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
4NH3 + CuCl2 → [Cu(NH3)4]Cl2
Гидроксид меди (II) растворяется в избытке аммиака:
4NH3 + Cu(OH)2 → [Cu(NH3)4](OH)2
5. Аммиак горит на воздухе, образуя азот и воду:
4NH3 + 3O2 → 2N2 + 6H2O
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
4NH3 + 5O2 → 4NO + 6H2O
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя, например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием. С металлами реагирует только жидкий аммиак.
За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя, например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием. С металлами реагирует только жидкий аммиак.
Например, жидкий аммиак реагирует с натрием с образованием амида натрия:
2NH3 + 2Na → 2NaNH2 + H2
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
При этом азот окисляется, как правило, до простого вещества.
Например, аммиак окисляется хлором до молекулярного азота:
2NH3 + 3Cl2 → N2 + 6HCl
Пероксид водорода также окисляет аммиак до азота:
2NH3 + 3H2O2 → N2 + 6H2O
Оксиды металлов, которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например, оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Понравилось это:
Нравится Загрузка…
аммиак | Определение и использование
аммиак
Посмотреть все СМИ
- Ключевые люди:
- Джозеф Пристли Фриц Хабер Герхард Эртль
- Похожие темы:
- Процесс Габера-Боша нитрат аммония биогенный газ гидроксид аммония безводный аммиак
Просмотреть весь связанный контент →
Сводка
Прочтите краткий обзор этой темы
аммиак (NH 3 ) , бесцветный едкий газ, состоящий из азота и водорода.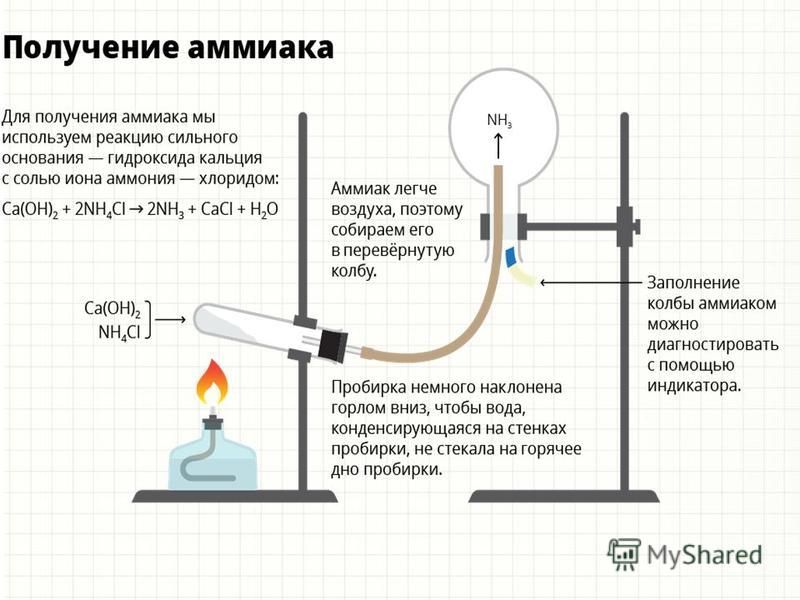 Это простейшее стабильное соединение этих элементов, которое служит исходным материалом для производства многих важных с коммерческой точки зрения соединений азота.
Это простейшее стабильное соединение этих элементов, которое служит исходным материалом для производства многих важных с коммерческой точки зрения соединений азота.
Использование аммиака
В основном аммиак используется в качестве удобрения. В Соединенных Штатах его обычно вносят прямо в почву из резервуаров, содержащих сжиженный газ. Аммиак также может быть в форме солей аммония, таких как нитрат аммония, NH 4 NO 3 , сульфат аммония, (NH 4 ) 2 SO 4 и различные фосфаты аммония. Мочевина, (H 2 N) 2 C=O, является наиболее часто используемым источником азота для удобрений во всем мире. Аммиак также используется в производстве коммерческих взрывчатых веществ (например, тринитротолуола [ТНТ], нитроглицерина и нитроцеллюлозы).
В текстильной промышленности аммиак используется при производстве синтетических волокон, таких как нейлон и вискоза. Кроме того, он используется при окрашивании и чистке хлопка, шерсти и шелка.
Аммиак используется в различных металлургических процессах, включая азотирование листов сплава для упрочнения их поверхности. Поскольку аммиак легко разлагается с образованием водорода, он является удобным портативным источником атомарного водорода для сварки. Кроме того, аммиак может поглощать значительное количество тепла из окружающей среды (например, один грамм аммиака поглощает 327 калорий тепла), что делает его полезным в качестве хладагента в холодильном оборудовании и оборудовании для кондиционирования воздуха.
Получение аммиака
Чистый аммиак был впервые получен английским ученым-физиком Джозефом Пристли в 1774 году, а его точный состав определил французский химик Клод-Луи Бертолле в 1785 году. Аммиак постоянно входит в пятерку основных химических веществ, производимых в Соединенных Штатах. Основным коммерческим методом производства аммиака является процесс Габера-Боша, который включает прямую реакцию элементарного водорода и элементарного азота. N 2 + 3H 2 → 2NH 3
Эта реакция требует использования катализатора, высокого давления (100–1000 атмосфер) и повышенной температуры (400–550 °C [750–1020 °F]). Действительно, равновесие между элементами и аммиаком способствует образованию аммиака при низкой температуре, но для достижения удовлетворительной скорости образования аммиака требуется высокая температура. Можно использовать несколько различных катализаторов.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подписаться сейчас
Физические свойства аммиака
Аммиак — бесцветный газ с резким резким запахом. Его температура кипения составляет -33,35 ° C (-28,03 ° F), а температура замерзания составляет -77,7 ° C (-107,8 ° F). Он имеет высокую теплоту испарения (23,3 кДж на моль при температуре кипения), и с ним можно обращаться как с жидкостью в термоизолированных контейнерах в лаборатории. (Теплота испарения вещества – это количество килоджоулей, необходимое для испарения одного моля вещества без изменения температуры.
Химическая активность аммиака
Сгорание аммиака протекает с трудом, но дает газообразный азот и воду.
4НХ 3 + 3O 2 + тепло → 2N 2 + 6H 2 O
Однако при использовании катализатора и при правильных температурных условиях аммиак реагирует с кислородом с образованием оксида азота NO, который окисляется до диоксида азота NO 2 и используется в промышленном синтезе азотной кислоты.
Аммиак легко растворяется в воде с выделением тепла.
NH 3 + H 2 O ⇌ NH 4 + + OH − Эти водные растворы аммиака являются основными и иногда называются растворами гидроксида аммония (NH 4 OH). Однако равновесие таково, что 1,0-молярный раствор NH
Жидкий аммиак широко используется в качестве неводного растворителя. Щелочные металлы, а также более тяжелые щелочноземельные металлы и даже некоторые внутренние переходные металлы растворяются в жидком аммиаке, образуя растворы синего цвета. Физические измерения, в том числе исследования электропроводности, свидетельствуют о том, что этот синий цвет и электрический ток обусловлены сольватированным электроном.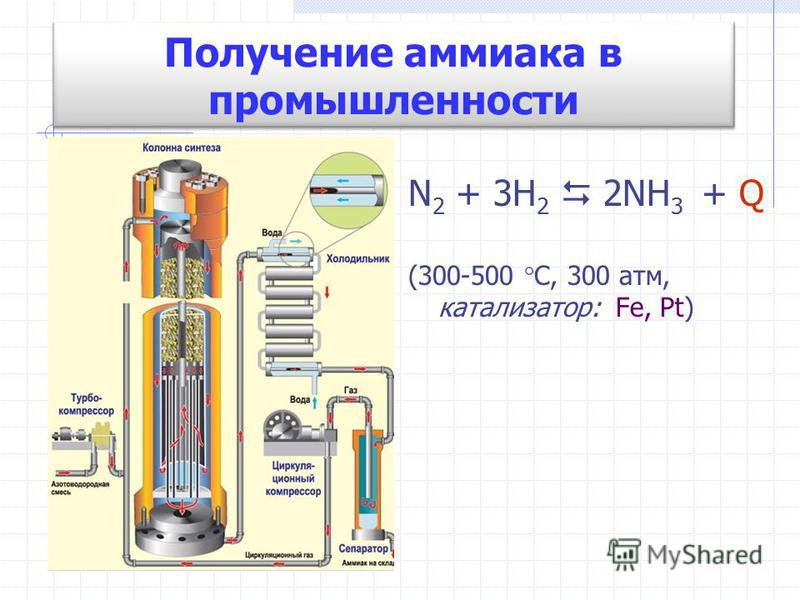 металл (дисперсный) ⇌ металл(NH 3 ) x ⇌ M + (NH 3 ) x + e − (NH 3 ) y Эти растворы являются отличными источниками электронов для восстановления других химических веществ. По мере увеличения концентрации растворенного металла раствор приобретает темно-синий цвет и, наконец, превращается в раствор медного цвета с металлическим блеском. Электропроводность уменьшается, и есть свидетельства того, что сольватированные электроны связываются с образованием электронных пар.
2 е − (NH 3 ) у ⇌ e 2 (NH 3 ) 7 у 7
Большинство солей аммония также легко растворяются в жидком аммиаке.
металл (дисперсный) ⇌ металл(NH 3 ) x ⇌ M + (NH 3 ) x + e − (NH 3 ) y Эти растворы являются отличными источниками электронов для восстановления других химических веществ. По мере увеличения концентрации растворенного металла раствор приобретает темно-синий цвет и, наконец, превращается в раствор медного цвета с металлическим блеском. Электропроводность уменьшается, и есть свидетельства того, что сольватированные электроны связываются с образованием электронных пар.
2 е − (NH 3 ) у ⇌ e 2 (NH 3 ) 7 у 7
Большинство солей аммония также легко растворяются в жидком аммиаке.
Формула аммиака. Структура, свойства, применение, примерные вопросы
Аммиак представляет собой газообразное химическое соединение, представляющее собой ядовитый газ с резким запахом. Как правило, аммиак образуется в результате анаэробного распада растительных и животных веществ. Аммиак хорошо растворяется в воде. Растворимость аммиака зависит от его температуры. Аммиак в воде известен как гидроксид аммония. Аммиак состоит из атомов азота и водорода. В зависимости от количества атомов водорода название соединения будет зависеть от того, если 2 атома водорода связаны с азотом, то это амин или амино (NH 2 ). Если 3 атома водорода связаны с азотом, то это аммиак (NH 3 ). Если 4 атома водорода связаны с азотом, то он называется аммонием (NH 4 ).
Как правило, аммиак образуется в результате анаэробного распада растительных и животных веществ. Аммиак хорошо растворяется в воде. Растворимость аммиака зависит от его температуры. Аммиак в воде известен как гидроксид аммония. Аммиак состоит из атомов азота и водорода. В зависимости от количества атомов водорода название соединения будет зависеть от того, если 2 атома водорода связаны с азотом, то это амин или амино (NH 2 ). Если 3 атома водорода связаны с азотом, то это аммиак (NH 3 ). Если 4 атома водорода связаны с азотом, то он называется аммонием (NH 4 ).
Формула аммиака
Химическая формула аммиака: NH 3 . Это химическое соединение, представляющее собой ядовитый газ с резким запахом. Аммиак состоит из 1 атома азота и 3 атомов водорода. 3 Водороды напрямую связаны с азотом. Аммиак сам вступает в некоторые реакции. Это молекулярная автоионизация, сжигание и т. д. Аммиак используется в качестве удобрения, используется в качестве топлива для стандартных двигателей и используется в качестве строительного материала для синтеза фармацевтических продуктов.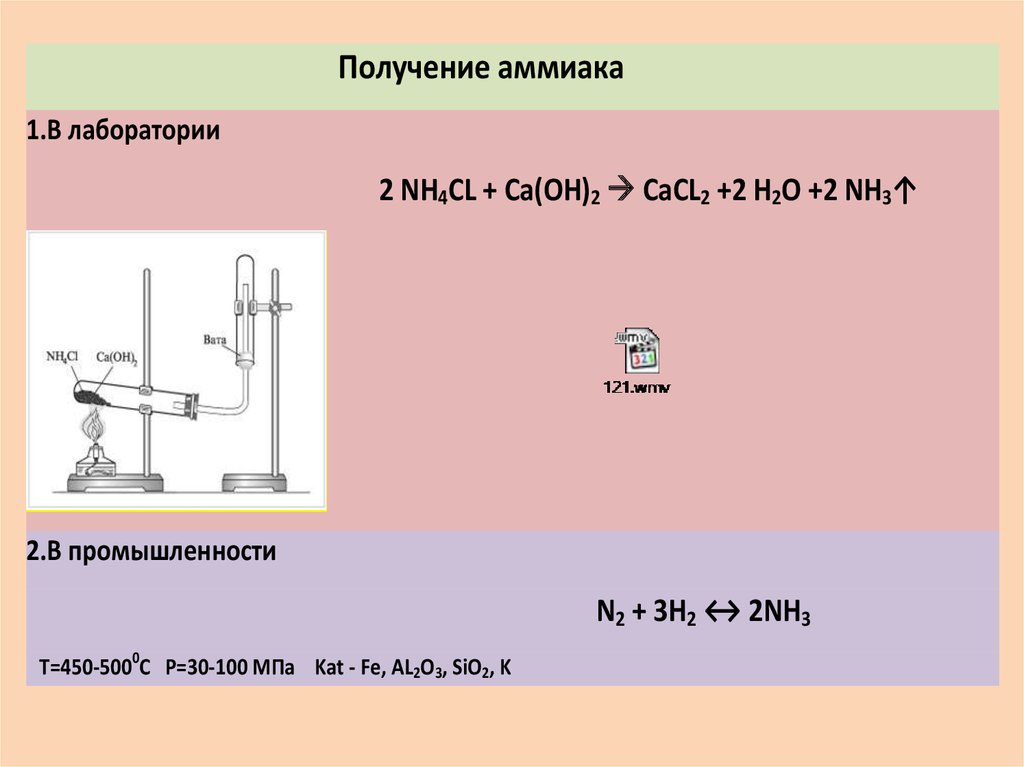 Другое название аммиака – азане.
Другое название аммиака – азане.
Структура аммиака
Аммиак представляет собой химическое соединение, состоящее из 1 атома азота и 3 атомов водорода. Химическая формула аммиака: NH 3 . Атом водорода непосредственно связан с азотом.
Физические свойства аммиака
- Аммиак представляет собой бесцветный газ с сильным и резким запахом.
- Плотность аммиака 0,86 кг/м 3 .
- Температура плавления аммиака -77,73°C (или) -107,91°F.
- Температура кипения аммиака составляет -33,34°C (или) -28,01°F.
- Растворимость аммиака в воде составляет 47% по массе при 0°C.
- Аммиак легко растворим в хлороформе, этаноле, метаноле и эфире.
- Молярная масса аммиака составляет 17,031 г/моль.
Химические свойства аммиака
- Аммиак подвергается молекулярной автоионизации с образованием основания и конъюгата.
2NH 3 ⇢ NH 4 + + NH 2 –
- Аммиак сгорает и образует азот и воду.

4 NH 3 + 3 O 2 ⇢ 2 N 2 + 6 H 2 O
4 NH 3 + 5 O 2 4. 400266 2 2 4. 400266 2 4. 40026 6. 40026 2 4. 400266 2 . 2 O
2 NO + O 2 ⇢ 2 NO 2
- Концентрированный аммиак реагирует с концентрированной соляной кислотой и образует облака хлорида аммония
NH 3 + HCl ⇢ NH 4 Cl
- Жидкий аммиак реагирует с литием и образует амид лития.
2 NH 3 + 2 li ⇢ 2 Linh 2 + H 2
Использование Ammomy
- Ammonia IS. Ascaise .
- Аммиак используется в качестве удобрения.
- Аммиак используется в качестве топлива в стандартных двигателях.

- Аммиак используется в качестве строительного материала для синтеза фармацевтических продуктов.
- Аммиак используется во многих коммерческих чистящих средствах.
- Аммиак используется в бытовых товарах.
- Аммиак используется для обработки металлов
- Аммиак используется в качестве нефти.
Примеры вопросов
Вопрос 1: Как получить аммиак?
Ответ:
Производство аммиака очень простой и легкий процесс. Производится из воздуха и воды. Аммиак является частью круговорота азота, образующегося естественным образом в результате разложения растений и органических веществ животных. Типичным современным методом производства аммиака является преобразование природного газа, жидкой нефти или жидкой нафты в газообразный водород. При этом отделяют водород паром от углеводородов. Затем соедините этот водород с азотом. Этот процесс называется Процесс Хабера-Боша .
Вопрос 2: Является ли аммиак кислотным или щелочным?
Ответ:
Аммиак является слабым основанием. Аммиак сам по себе не содержит ионов гидроксида, но он реагирует с водой с образованием ионов аммония и ионов гидроксида. Итак, аммиак является слабым основанием.
Вопрос 3: Как проверить наличие аммиака в смеси?
Ответ:
Аммоний можно определить, добавляя разбавленный раствор гидроксида натрия при слабом нагревании. Если присутствует аммиак, он будет выделять газы с резким запахом. этот газ — газообразный аммиак. это было подтверждено испытанием с красной лакмусовой бумагой. Красная лакмусовая бумажка превращается в синюю, если в этом газе присутствует аммиак.
Вопрос 4: Что происходит, когда аммиак пузырится в воде?
Ответ:
Аммиак действует как основание, реагирует с водой и образует ионы аммония и гидроксид-ионы.