Оборудование + Технология изготовления 2021
Аммиак (нитрид водорода, формула NH3) при нормальных условиях — это бесцветный газ с резким характерным запахом. Он относится к числу важнейших продуктов химической промышленности. Его ежегодное мировое производство достигает 150 млн. тонн. В основном он используется для изготовлении азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя.
В холодильной технике используется в качестве холодильного агента (R717).
В медицине 10% раствор аммиака, чаще называемый нашатырным спиртом, используется при обморочных состояниях (для возбуждения дыхания), для стимуляции рвоты, а также наружно — при невралгии, миозитах, укусах насекомых, для обработки рук хирурга. При неправильном использовании может вызвать ожоги пищевода и желудка (в случае приёма неразведённого раствора), рефлекторную остановку дыхания (при вдыхании в высокой концентрации).
Технология производства аммиака + видео как получают
В рамках этого направления сегодня многие компании стали заниматься разработкой и проектированием следующих технологий:
- Перевод избыточного количества аммиака на изготовление метанола.
- Разработка производства на основе современных технологий для подмены активных агрегатов.
- Создание интегрированного производства и модернизация.
На производство одной тонны аммиака в России расходуется в среднем 1200 нм³ природного газа, в Европе — 900 нм³. Белорусский «Гродно Азот» расходует 1200 нм³, после модернизации ожидается снижение расхода до 876 нм³. Украинские производители потребляют от 750 нм³ до 1170 нм³. По технологии UHDE заявляется потребление 6,7 — 7,4 Гкал энергоресурсов на тонну.
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
N2 + 3H2 ⇄ 2NH3+ + 91,84 кДж
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).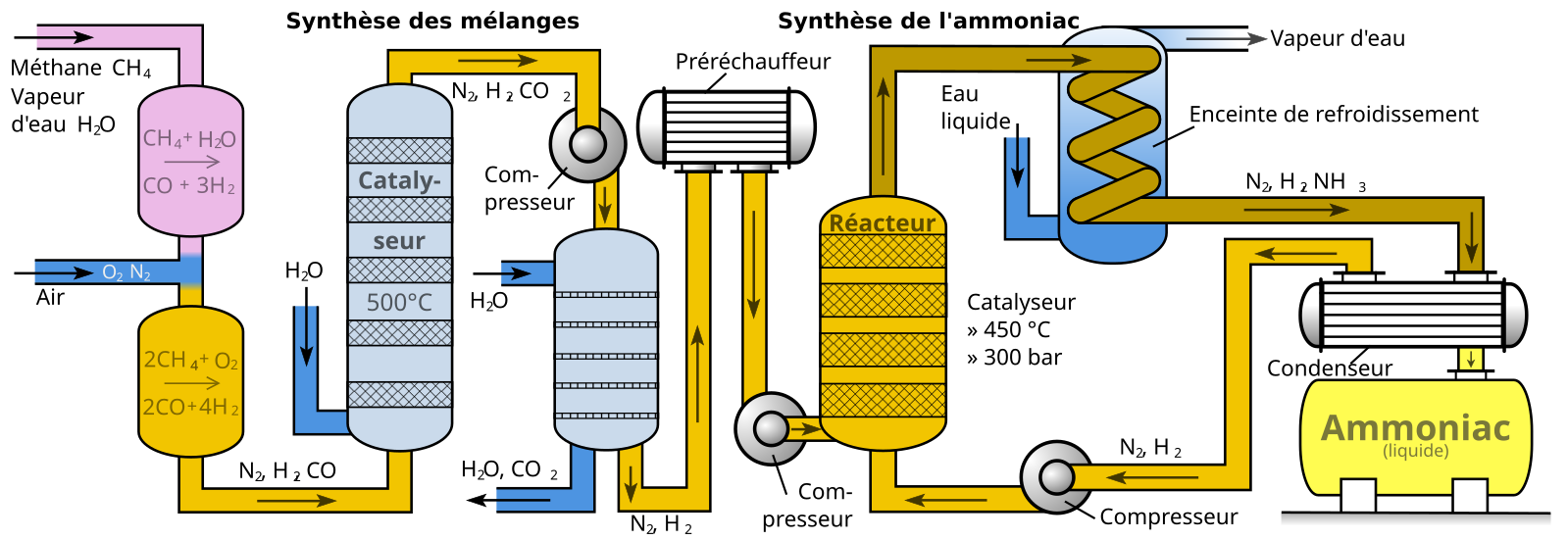 Реакция происходит с выделением тепла и понижением объёма. Следовательно, исходя из принципа Ле-Шателье, реакцию следует проводить при возможно низких температурах и при высоких давлениях — тогда равновесие будет смещено вправо. Однако скорость реакции при низких температурах ничтожно мала, а при высоких увеличивается скорость обратной реакции. Проведение реакции при очень высоких давлениях требует создания специального, выдерживающего высокое давление оборудования, а значит, и больших капиталовложений. Кроме того, равновесие реакции даже при 700°C устанавливается слишком медленно для практического её использования. Выход аммиака (в объёмных процентах) в процессе Габера при различных температурах и давлении имеет следующие значения:
Реакция происходит с выделением тепла и понижением объёма. Следовательно, исходя из принципа Ле-Шателье, реакцию следует проводить при возможно низких температурах и при высоких давлениях — тогда равновесие будет смещено вправо. Однако скорость реакции при низких температурах ничтожно мала, а при высоких увеличивается скорость обратной реакции. Проведение реакции при очень высоких давлениях требует создания специального, выдерживающего высокое давление оборудования, а значит, и больших капиталовложений. Кроме того, равновесие реакции даже при 700°C устанавливается слишком медленно для практического её использования. Выход аммиака (в объёмных процентах) в процессе Габера при различных температурах и давлении имеет следующие значения:
| 100 ат | 300 ат | 1000 ат | 1500 ат | 2000 ат | 3500 ат | |
|---|---|---|---|---|---|---|
| 400 °C | 25,12 | 47,00 | 79,82 | 88,54 | 93,07 | 97,73 |
| 450 °C | 16,43 | 35,82 | 69,69 | 84,07 | 89,83 | 97,18 |
| 500 °C | 10,61 | 26,44 | 57,47 | Нет данных | ||
| 550 °C | 6,82 | 19,13 | 41,16 | |||
Применение катализатора (пористое железо с примесями Al2O3 и K2O) позволило ускорить достижение равновесного состояния.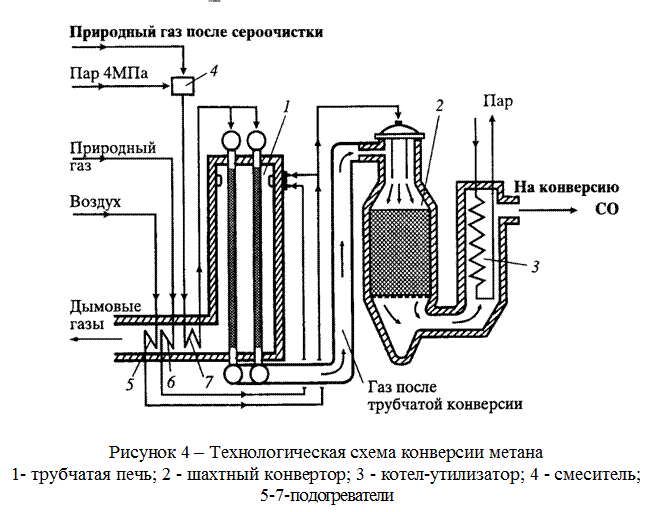 Интересно, что при поиске катализатора на эту роль пробовали более 20 тысяч различных веществ.
Интересно, что при поиске катализатора на эту роль пробовали более 20 тысяч различных веществ.
Учитывая все вышеприведённые факторы, процесс получения проводят при следующих условиях:
- температура 500 °C;
- давление 350 атмосфер;
- катализатор.
Выход аммиака при таких условиях составляет около 30%. В промышленных условиях использован принцип циркуляции — аммиак удаляют охлаждением, а непрореагировавшие азот и водород возвращают в колонну синтеза. Это оказывается более экономичным, чем достижение более высокого выхода реакции за счёт повышения давления. Для его получения в лаборатории используют действие сильных щелочей на соли аммония:
NH4Cl + NaOH → NH3↑ + NaCl + H2O
Обычно лабораторным способом аммиак получают слабым нагреванием смеси хлорида аммония с гашеной известью.
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O
Для осушения аммиака его пропускают через смесь извести с едким натром. Очень сухой можно получить, растворяя в нём металлический натрий и впоследствии перегоняя. Это лучше делать в системе, изготовленной из металла под вакуумом. Система должна выдерживать высокое давление (при комнатной температуре давление насыщенных паров около 10 атмосфер). На промышленном производстве обычно для сушки используют абсорбционные колонны.
Очень сухой можно получить, растворяя в нём металлический натрий и впоследствии перегоняя. Это лучше делать в системе, изготовленной из металла под вакуумом. Система должна выдерживать высокое давление (при комнатной температуре давление насыщенных паров около 10 атмосфер). На промышленном производстве обычно для сушки используют абсорбционные колонны.
Видео как делают:
Производство аммиака не должно обходить стороной технический прогресс. В основном это касается энергосбережения. В ходе разработки современных технологий большое значение отводится программному обеспечению, необходимому для моделирования химических и технологических процессов.
Синтез аммиака станет гораздо менее энергоемким
В мире производят почти 200 млн тонн аммиака в год, из него получают азотные удобрения, различные пластики, взрывчатые вещества и многое другое. Но синтез аммиака остается почти неизменным с начала XX века: на него расходуется колоссально много электричества. Один из самых энергозатратных этапов синтеза — выделение аммиака из реакционной смеси. Российские ученые из РХТУ, НГТУ и ННГУ предложили проводить ее с помощью гибридной технологии, сочетающей возможности мембранной очистки и современных абсорбентов, и показали, что так можно получать аммиак чистотой до 99%, затрачивая гораздо меньше энергии. Исследование поддержано Российским научным фондом.
Но синтез аммиака остается почти неизменным с начала XX века: на него расходуется колоссально много электричества. Один из самых энергозатратных этапов синтеза — выделение аммиака из реакционной смеси. Российские ученые из РХТУ, НГТУ и ННГУ предложили проводить ее с помощью гибридной технологии, сочетающей возможности мембранной очистки и современных абсорбентов, и показали, что так можно получать аммиак чистотой до 99%, затрачивая гораздо меньше энергии. Исследование поддержано Российским научным фондом.
Азот необходим всем живым организмам, поскольку входит в состав белков и аминокислот. И хотя атмосфера Земли почти на 80% состоит из молекулярного азота, в такой форме он практически не усваивается организмами. Поэтому человечество производит так много удобрений, которые содержат азот уже в связанной форме, то есть в виде разных химических соединений азота с другими атомами, из которых организмам уже гораздо проще вытащить азот под свои нужды.А большинство азотных удобрений, в свою очередь, получают из аммиака, который к тому же используют для синтеза различных охлаждающих агентов (рефрижерантов), пластиков, полимеров, взрывчатых веществ и даже в микроэлектронике.
Почти весь аммиак получают в процессе Габера—Боша, предложенном еще в начале XX века и уже через несколько лет принесшем одному из своих разработчиков, Фрицу Габеру, Нобелевскую премию по химии. В нем водород и азот пропускают при высоком давлении через катализатор, и на выходе получается газообразная смесь исходных реагентов и аммиака, из которой потом нужно выделить чистый аммиак. Сейчас для этого смесь охлаждают с применением большого количества хладагентов, и процесс очистки потребляет очень много энергии — более 3 МВт•ч на каждую тонну аммиака, это средний расход электричества в квартире примерно за два года. Поэтому, хотя синтез аммиака и отработан вековым опытом и гигантским производством, ученые постоянно ищут новые более экономичные способы разделения продуктов процесса Габера—Боша.
Исследователи из РХТУ им.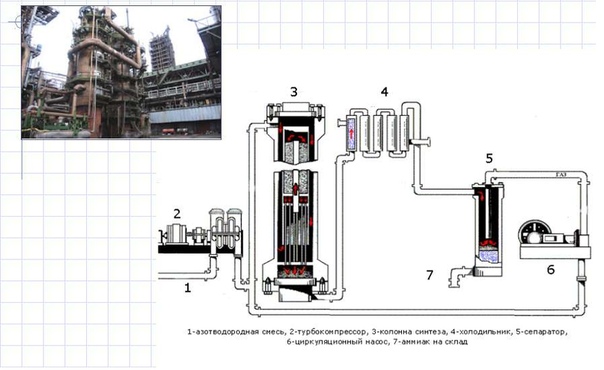 Д. И. Менделеева, а также нижегородских вузов НГТУ им. Р. Е. Алексееваи ННГУ им. Н. И. Лобачевского уже предлагали использовать для этого гибридный способ очистки газов, в котором сочетаются технические возможности мембран и абсорбентов. Теперь у них опубликована новая работа, в которой с применением новых абсорбентов исследователи получили аммиак с чистотой, сопоставимой с промышленной.
Д. И. Менделеева, а также нижегородских вузов НГТУ им. Р. Е. Алексееваи ННГУ им. Н. И. Лобачевского уже предлагали использовать для этого гибридный способ очистки газов, в котором сочетаются технические возможности мембран и абсорбентов. Теперь у них опубликована новая работа, в которой с применением новых абсорбентов исследователи получили аммиак с чистотой, сопоставимой с промышленной.
Схематическое изображение установки для очистки газообразной смеси продуктов синтеза аммиака
«Однажды я выступал с пленарным докладом на научной конференции в Португалии, а после ко мне подошел очень известный ученый в области мембран, профессор Эдвард Касслер: он взял меня за руки и показал, сложив ладоши, принцип действия мембраны, а потом рассказал, что заниматься в науке о мембранах нужно только тремя направлениями. Одним из них был аммиак,— рассказывает один из авторов работы, заведующий лабораторией SMARTполимерных материалов и технологий РХТУ им.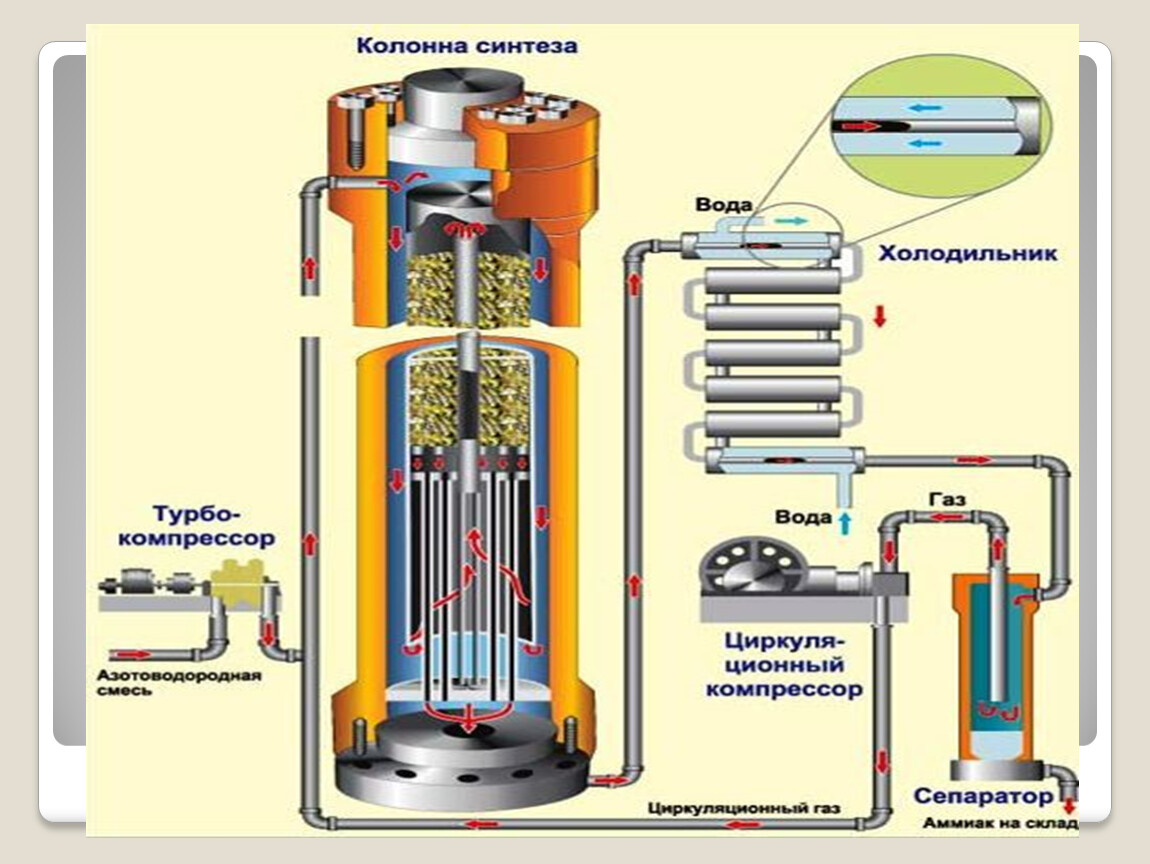 Д.И. Менделеева профессор Илья Воротынцев.— Мы уже применяли наш гибридный процесс для синтеза хлористого водорода, организовывали по заданию нобелевского лауреата Жореса Алферова производство высокочистого аммиака для микроэлектроники (для производства светодиодов), а теперь наши интересы сместились в область более массового производства, в том числе получения аммиака».
Д.И. Менделеева профессор Илья Воротынцев.— Мы уже применяли наш гибридный процесс для синтеза хлористого водорода, организовывали по заданию нобелевского лауреата Жореса Алферова производство высокочистого аммиака для микроэлектроники (для производства светодиодов), а теперь наши интересы сместились в область более массового производства, в том числе получения аммиака».
Гибридная технология очистки газов разработана российскими учеными и протекает в аппарате их собственной конструкции. Он разделен мембраной на две части: в верхнюю поступает смесь газов— в данном случае это аммиак, азот и водород,— которая пропускается через абсорбент, нанесенный на мембрану.Он накапливает большие количества аммиака и, наоборот, почти не абсорбирует азот и водород, которые выходят обратно из абсорбента в ту же самую полость над мембраной. Молекулы же аммиака выводятся из абсорбента через мембрану в другую часть аппарата: между полостями над и под мембраной создают большой перепад давления, под действием которого аммиак диффундирует через мембрану в нижнюю часть аппарата, из которой уже отводят поток очищенного газа.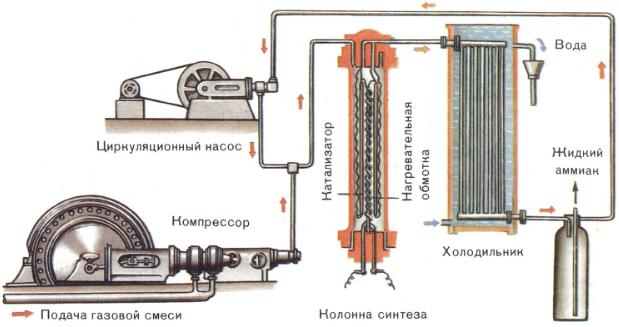
В качестве абсорбента ученые использовали четыре разных вещества, которые, по предварительным данным, выглядели перспективными для очистки аммиака. Все они были глубокими эвтектическими растворителями (ГЭР) — так называют смесь двух веществ, температура плавления которой ниже температуры плавления отдельных компонентов. ГЭР получают из доступных реагентов с помощью простого синтеза, а поскольку они остаются жидкими в широком диапазоне температур, сейчас их считают перспективными классом зеленых растворителей. Исследователи работали с тремя уже испытанными ГЭР на основе тиоцианата аммония, которые, по данным литературы, могут абсорбировать большие количества аммиака, и одним уникальным составом на основе метансульфоната 1-бутил-3-метилимидазолия, который был перспективен уже по данным предварительных экспериментов самих российских ученых.
Исходная газообразная трехкомпонентная смесь состояла из аммиака, азота и водорода в объемных отношениях 15,5/62,8/21,7.Лучший результат показал абсорбент на основе ГЭР из тиоцианата аммония, смешанного с глицеролом: с ним чистота аммиака на выходе составляла почти 99%.
Не только российские ученые пытаются применить мембранный подход к очистке аммиака. Однако большинство других исследований в этой области, по словам авторов работы, носят материаловедческий характер и пока далеки от практической реализации. В новом же исследовании российских химиков не только подобран наиболее перспективный состав абсорбента, но и проведены проточные эксперименты в реальном аппарате со смесью газов, предельно приближенной к составу продуктов процесса Габера—Боша. Степень очистки аммиака достигала 99%, что близко к современному промышленному способу, дающему чистоту аммиака до 99,8%, но сопряженному с огромными энергопотерями из-за использования криогенных технологий.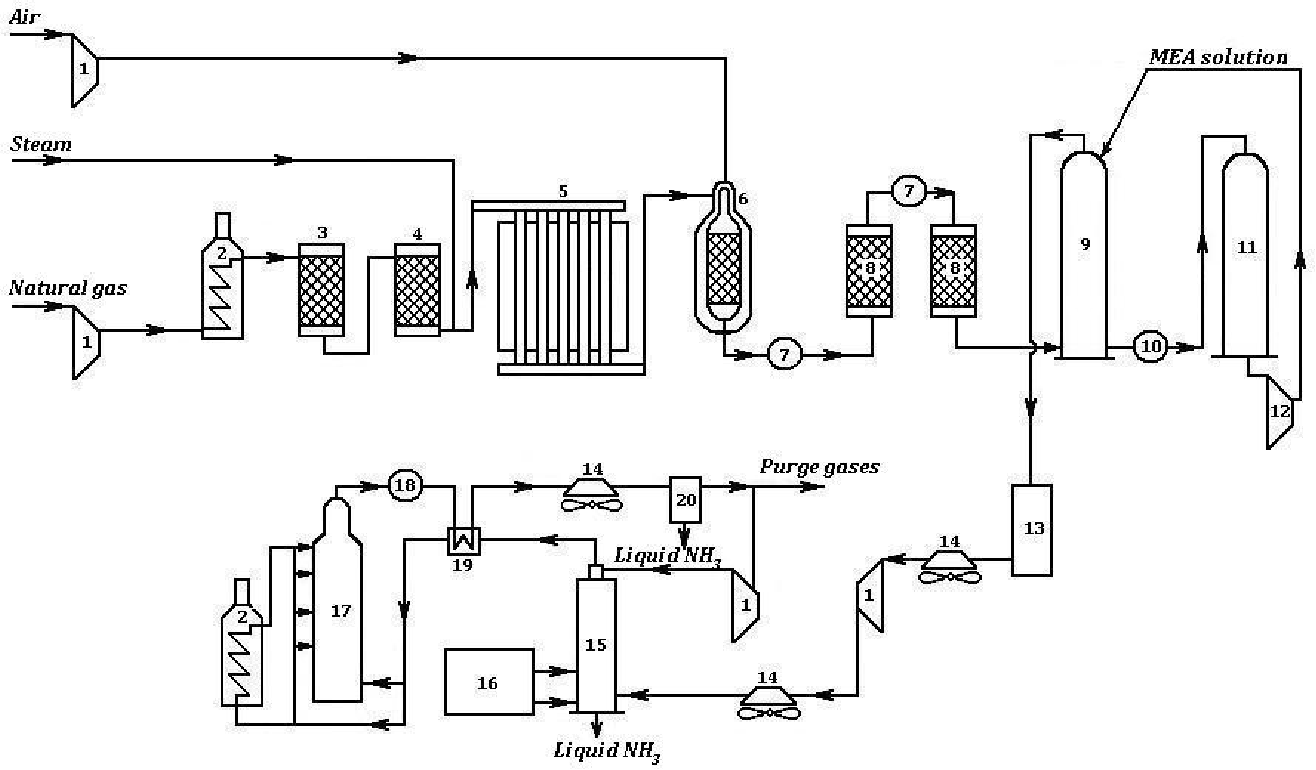
«В этой работе мы определили наиболее перспективные абсорбирующие материалы, а теперь продолжаем изучать процесс и разрабатываем новую конструкцию мембранного модуля, которую будет возможно масштабировать для задач промышленности,— рассказывает Илья Воротынцев.— Конечно, процесс синтеза аммиака остается практически неизменным на протяжении 100 лет, но он сопряжен с такими большими затратами энергии и проводится в таких колоссальных объемах, что снижение энергопотребления не то что на порядок, а даже на проценты может принести колоссальную прибыль, а в нашем методе как раз не требуется никаких хладагентов, и поэтому он гораздо доступнее. Да, смена производственной парадигмы — это процесс не мгновенный, но бизнес быстро считает прибыль и убытки, и если будет пример экономически удачной реализации нашего процесса, то это станет мощным толчком к изменениям у всех производителей аммиака».
РХТУ им. Д.И. Менделеева — опорный университет химической отрасли России, работа которого направлена не только на получение новых знаний, но и на внедрение их в промышленность. Исследование проведено сотрудниками лаборатории SMARTполимерных материалов и технологий РХТУ им. Д.И. Менделеева, а также НГТУ им. Р.Е. Алексеева и ННГУ им. Н.И. Лобачевского при финансовой поддержке грантов РНФ (№17-79-20286), а также Министерства науки и высшего образования.
Исследование проведено сотрудниками лаборатории SMARTполимерных материалов и технологий РХТУ им. Д.И. Менделеева, а также НГТУ им. Р.Е. Алексеева и ННГУ им. Н.И. Лобачевского при финансовой поддержке грантов РНФ (№17-79-20286), а также Министерства науки и высшего образования.
Использованы материалы статьи: Anton. N. Petukhov, «A Highly-efficient Hybrid Technique — Membrane-assisted Gas Absorption for Ammonia Recovery after the Haber-Bosch Process», Chemical Engineering Journal (Q1), 2020. DOI: 10.1016/j.seppur.2020.117835. DOI: 10.1016/j.cej.2020.127726
Допустима ли для словаря свободная маркировка. (0 = недопустима, 1 = допустима)
Заводы по производству аммиака и удобрений сталкиваются со многими трудностями, от обеспечения сырьем по приемлемым ценам до снижения себестоимости продукции. KBR предоставляет технологии, которые необходимы им для сохранения конкурентоспособности.
Мы являемся основным партнером предприятий по производству аммиака и удобрений уже более 50 лет, обеспечивая превосходные технологии и решения для оптимизации производства, снижения капитальных затрат и обеспечения надежной, эффективной и гибкой эксплуатации. От стандартных аммиака и азотной кислоты до карбамидо-аммиачной селитры — мы совместно с вами выработаем решение, которое будет соответствовать вашим потребностям и потребностям рынка.
От стандартных аммиака и азотной кислоты до карбамидо-аммиачной селитры — мы совместно с вами выработаем решение, которое будет соответствовать вашим потребностям и потребностям рынка.
«От аммиака и азотной кислоты до карбамидо-аммиачных смесей — мы совместно с вами выработаем решение, которое будет соответствовать вашим нуждам и потребностям рынка.»
Благодаря нашему значительному опыту проектирования, строительства и обслуживания предприятий по производству аммиака и удобрений всех типов мы как отраслевые эксперты используем компетентный подход для решения любой задачи. Мы помогаем производителям максимально увеличить выработку с помощью наших патентованных и лицензированных решений, в том числе следующие.
PURIFIER™ & PURIFIERplus™
Наши оптимизированные криогенные технологии производства синтетического газа, которые одновременно удаляют загрязняющие примеси, такие как метан и аргон, с получением синтетического газа без инертного компонента, обеспечивают улучшенную энергоэффективность и рассчитаны для использования воздуха вместо чистого кислорода в секции реформинга установки, избавляя от необходимости дополнительного дорогостоящего оборудования.
AMMONIA 6000™
Завершенное решение однопоточной установки для производства аммиака, основанное на нашей патентованной технологии PURIFIER™, которая расширяет производственную мощность до 6000 тонн в год с использованием проверенных и надежных конструкций, а также снижает капитальные и эксплуатационные затраты и выбросы CO2 и оксидов азота.
Традиционный процесс синтеза аммиака с магнетитовым катализатором
Проверенная технология производства аммиака, сочетающая технологию первичного риформинга с верхним пламенем с синтезом аммиака и обеспечивающая оптимизированное энергопотребление, основанное на нашем уникальном и значительном опыте работы с данными решениями.
Азотная кислота
Наше проверенное решение для производства аммиачной селитры с прекрасной статистикой безопасности, которое обеспечивает низкую общую стоимость с учетом затрат на монтаж и точный контроль pH в нейтрализаторе, секция упаковки аммиачной селитры и вентиляционный скруббер, работающий в режиме конденсации и фильтры для улавливания сверхтонкого тумана аммиачной селитры для обеспечения высокой степени очистки выбросов.
Аммиачная селитра
Технология с единым высоким давлением и патентованная технология с двойным давлением, разработанные для обеспечения энергетической и экономической эффективности с одновременным обеспечением высокой конверсии аммиака для предприятий с широким диапазоном плановых производственных показателей.
Карбамидо-аммиачная селитра
Полностью интегрированная конструкция установки, в которой комбинируются мочевина, аммиачная селитра, азотная кислота и карбамидо-аммиачная селитра и обеспечивается эффективное и малозатратное производство раствора карбамидо-аммиачной селитры. Запатентованный процесс частичной вторичной переработки мочевины, который приводит к более высокому общему выходу сырьевого материала по сравнению с неинтегрированными процессами.
Водород
Портфолио фирменных технологий и оборудования для гидропроцессов, которые используются для производства водорода из природного газа, тяжелого лигроина и другого исходного сырья. Технология включает наши установки парового риформинга метана с верхним пламенем, систему обменника риформинга KRES™ и автотермический риформер.
Производство аммиака водного | Аммиак водный (Аммиачная вода)
АММИАК ВОДНЫЙ ТЕХНИЧЕСКИЙ NH
3H2OГОСТ 9-92
Аммиак водный технический является раствором технического аммиака.
Аммиак водный выпускается двух марок: марка А, марка Б.
Применение
Марка А — для промышленности. Применяется в производстве красителей, кальцинированной соды, в электрическом производстве марганца, ферросплавов, пищевой и медицинской промышленности.
Марка Б — для сельского хозяйства (растениеводство, животноводство). В качестве жидкого удобрения с содержанием аммонийного азота 20,5%. Наивысший эффект от применения аммиачной воды достигается при осеннем внесении в почву, т.к. не вымывается атмосферными осадками, или в предпосевный период весной. Водный аммиак при внесении в почву можно использовать под все хозяйственные культуры. Азот аммиака лучше удерживается почвой, чем аммонийный азот твердых удобрений. Аммиачная вода — хорошее удобрение для картофеля, свеклы, зерновых и овощных культур, многолетних трав.
Технические характеристики
| Наименование показателя | Марки | |
|---|---|---|
| А | Б | |
| Внешний вид | прозрачная бесцветная жидкость | прозрачная бесцветная или желтоватая жидкость |
|
Массовая доля аммиака, % не менее в пересчете на азот, % не менее |
25 не нормируется |
25 20,5 |
| Массовая концентрация нелетучего остатка, г/дм3, не более | 0,07 | не нормируется |
| Массовая концентрация диоксида углерода, г/дм3, не более | не нормируется | 8 |
Безопасность
Негорюч, невзрывоопасен.
Хранение
В герметической таре в крытых вентилируемых помещениях или в специально предназначенных для хранения емкостях. Держать вдали от прямых солнечных лучей и источников тепла.
Транспортировка
Доставка осуществляется наливом железнодорожным, автомобильным и водным транспортом в герметичных транспортных средствах в соответствии с правилами перевозки опасных грузов, действующими на данном виде транспорта.
Срок хранения
3 месяца с даты изготовления.
Современный процесс производства аммиака.
Современный процесс получения аммиака основан на его синтезе из азота и водорода при температурах 380 — 450 0C и давлении 250 атм с использованием железного катализатора:
N2 (г.) + 3h3 (г.) = 2Nh4 (г.)
Азот получают из воздуха. Водород получают восстановлением воды (пара) с помощью метана из природного газа либо из лигроина. Лигроин (нафта) представляет собой жидкую смесь алифатических углеводородов, которая получается при переработке сырой нефти (см. гл. 18).
Лигроин (нафта) представляет собой жидкую смесь алифатических углеводородов, которая получается при переработке сырой нефти (см. гл. 18).
Работа современного аммиачного завода очень сложна. На рис. 7.2 показана упрощенная схема действия аммиачного завода, работающего на природном газе. Эта схема действия включает восемь стадий.
1-я стадия. Удаление серы из природного газа. Это необходимо, поскольку сера представляет собой каталитический яд (см. разд. 9.2).
2-я стадия. Получение водорода восстановлением пара при 750 0C и давлении 30 атм с помощью никелевого катализатора:
Ch5 (г.) + h3O (г.) = СО (г.) + ЗН 2 (г.)
3-я стадия. Впуск воздуха и сгорание части водорода в кислороде вводимого воздуха:
2h3 (г.) + O2 (г.) = 2h3O (г.) В результате получается смесь водяного пара, моноксида углерода и азота. Водяной пар восстанавливается с образованием водорода, как на 2-й стадии.
4-я стадия. Окисление моноксида углерода, образующегося на стадиях 2 и 3, до диоксида углерода по следующей реакции «сдвига»: СО (г. ) + h3O (г.) = CO2 (г.) + h3 (г.)
) + h3O (г.) = CO2 (г.) + h3 (г.)
Этот процесс проводится в двух «реакторах сдвига». В первом из них используется катализатор из оксида железа и процесс проводится при температуре порядка 400 0C Во втором используется медный катализатор и процесс проводится при температуре 220°С.
5-я стадия. Вымывание диоксида углерода из газовой смеси при помощи буферного щелочного раствора карбоната калия или раствора какого-либо амина, например этаноламина Nh3Ch3Ch3OH. Диоксид углерода в конце концов сжижают и используют для производства мочевины, либо выпускают в атмосферу.
6-я стадия. После 4-й стадии в газовой смеси остается еще около 0,3% моноксида углерода. Поскольку он может отравлять железный катализатор во время синтеза аммиака (на 8-й стадии), моноксид углерода удаляют путем конверсии водородом в метан на никелевом катализаторе при температуре 325°С.
7-я стадия. Газовую смесь, которая теперь содержит приблизительно 74% водорода и 25% азота, подвергают сжатию; при этом ее давление возрастает от 25-30 атм до 200 атм.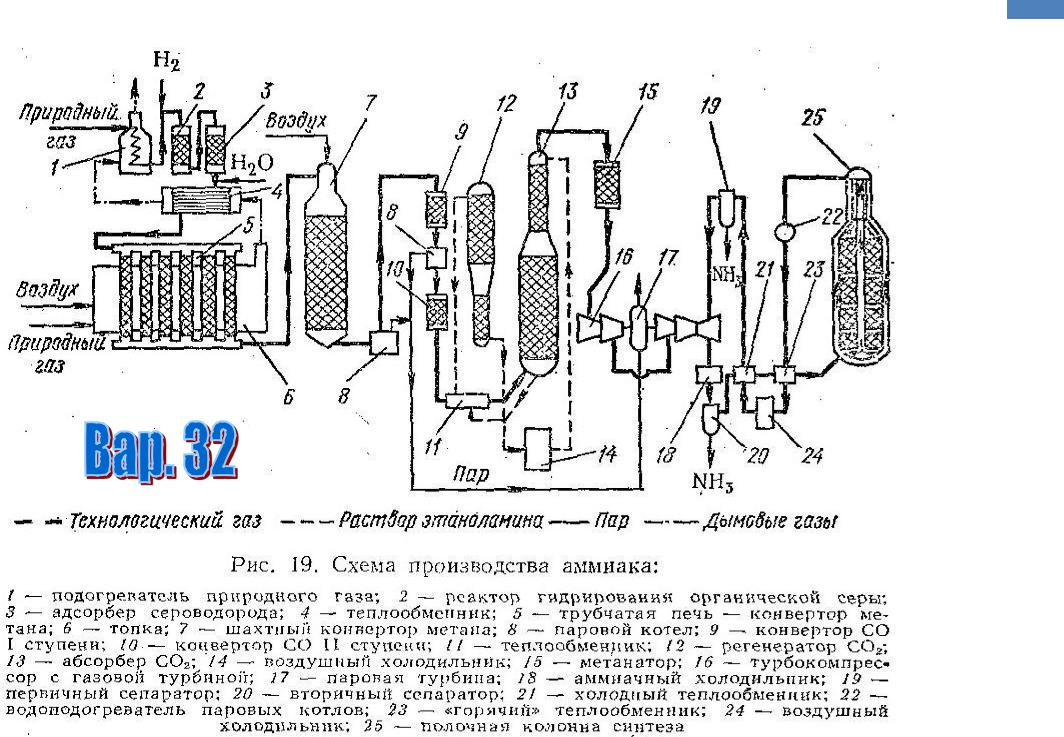 Поскольку это приводит к повышению температуры смеси, ее сразу же после сжатия охлаждают.
Поскольку это приводит к повышению температуры смеси, ее сразу же после сжатия охлаждают.
8-я стадия. Газ из компрессора поступает теперь в «цикл синтеза аммиака». Схема, приведенная на рис. 7.2, дает упрощенное представление об этой стадии. Сначала газовая смесь попадает в каталитический конвертер, в котором используется железный катализатор и поддерживается температура 380-450°С. Газовая смесь, выходящая из этого конвертера, содержит не более 15% аммиака. Затем аммиак сжижают и направляют в приемный бункер, а непрореагировавшие газы возвращают в конвертер.
Оглавление:
Производство аммиака в ЕГЭ по химии
Тема кодификатора ЕГЭ по химии: Общие научные принципы химического производства на примере промышленного получения аммиака, серной кислоты, метанола.
В этой статье мы рассмотрим принципы химического производства на примере получения аммиака в объеме, достаточном для решения заданий по этой теме в ЕГЭ по химии.
В промышленности аммиак получают по методу Габера – прямым взаимодействием азота и водорода в реакционной колонне:
N2 + 3Н2 ⇄ 2NH3
Реакция азота с водородом обратимая, экзотермическая, гомогенная (газофазная). Для увеличения выхода аммиака необходимо смещать равновесие в сторону продукта. Согласно принципу Ле-Шателье, для смещения равновесия вправо в данной реакции необходимо повышать давление и понижать температуру. Однако низкая температура уменьшит скорость реакции.
Поэтому для повышения скорости реакции температура в процессе поддерживается все-таки высокой, 500-550оС и в присутствии катализатора.
А для смещения равновесия применяют очень высокие давления 15-30 МПа.
В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Рассмотрим процессы, протекающие на разных участках производства аммиака:
1 этап. Трубопровод. В трубопровод подается предварительно подготовленная азотно-водородная смесь (N2:Н2=1:3) в соотношении 1 к 3.
2 этап. Турбокомпрессор. Турбокомпрессор используется для сжатия исходной смеси газов с целью повышения давления. Синтез аммиака проводится при очень высоком давлении (15-30 МПа, или 150-300 атм).
3 этап. Колонна синтеза. В колонне синтеза (контактном аппарате) производится синтез аммиака. Азотно-водородная смесь продавливается через полки с катализатором. Процесс синтеза протекает обратимо (т.е. частично) и является сильно экзотермическим, протекает с большим выделением тепла. Часть выделяющегося тепла расходуется на нагревание поступающей азотоводородной смеси с помощью теплообменников. Смесь, выходящая из колонны синтеза в холодильник, состоит из аммиака (20-30%) и не прорегировавших азота и водорода.
4 этап. Холодильник. В холодильнике реакционная смесь, которая выходит из колонны синтеза, охлаждается и направляется на дальнейшее разделение в сепаратор.
5 этап. Сепаратор. После прохождения холодильника температура реакционной смеси значительно снижается, и аммиак переходит в жидкую фазу. В сепараторе происходит разделение реакционной смеси, жидкий аммиак отделяют от азота и водорода и отправляют на склад.
6 этап. Циркуляционный насос. Циркуляционный насос возвращает не прореагировавшую смесь азота и водорода в контактный аппарат. Благодаря циркуляции удаѐтся довести использование азотводородной смеси (конверсию) до 95%.
Крупнейший в мире проект «зеленого» водорода будет использовать технологию аммиака компании Хальдор Топсе
- Завод по производству «зеленого» водорода стоимостью 5 миллиардов долларов США планируется построить в городе Неом, Саудовская Аравия. На этом заводе также будет использоваться хорошо зарекомендовавшая себя технология производства аммиака, разработанная компанией Топсе.
- Планируемый цикл синтеза «зеленого» аммиака станет крупнейшим в мире наряду с заводом по производству аммиака на побережье Мексиканского залива, который будет построен в Техасе, США, где также будет использоваться технология производства аммиака компании Топсе.
- Проект NEOM нацелен на производство 650 тонн в сутки водорода с нулевым выбросом углерода для использования в качестве топлива для автобусов и грузовых автомобилей по всему миру. Проект в равных долях принадлежит партнерам Air Products, ACWA Power и NEOM. Весь производимый «зеленый» аммиак будет покупать компания Air Products для последующей транспортировки по всему миру и дальнейшей диссоциации в водород без углеродного следа для местных рынков транспортных услуг.
В рамках проекта NEOM около 4 ГВт энергии от возобновляемых источников (солнца и ветра и накопленной энергии) будут направлены на производство 650 тонн в сутки водорода. С помощью хорошо зарекомендовавшей себя технологии Топсе водород будет конвертироваться в 3500 тонн в сутки — или 1,2 миллиона тонн в год — «зеленого» аммиака.
Конверсия водорода в аммиак является инновационным подходом для безопасной и надежной транспортировки и хранения «зеленого» топлива с использованием существующей проверенной инфраструктуры.
Компания Air Products будет эксклюзивным покупателем «зеленого» аммиака. Она намеревается транспортировать его в различные страны и затем проводить его обратную конверсию в водород для заправочных станций как топливо для автотранспорта с нулевым выбросом углерода. Основная задача Air Products — обеспечить к 2025 году снабжение водородом автобусов и грузовиков, работающих на водородных топливных элементах. Air Products дополнительно инвестирует два миллиарда долларов в инфраструктуру для конечных пользователей.
Реализация данного проекта обеспечит сокращение выбросов эквивалентное выбросам от 700 000 автомобилей, в том числе выбросы сократятся на более чем три миллиона тонн CO2 в год.
«Для нас большая честь участвовать в этом инновационном проекте мирового масштаба, нацеленном на сокращение выбросов углекислого газа. Топсе активно занимается повышением энергоэффективности современных технологий и в то же время разработкой решений будущего. Это большой шаг вперед», — заявила Эми Хеберт, заместитель генерального директора и вице-президент департамента газохимии и нефтехимии компании Хальдор Топсе.
15 мая 2020 года компании Хальдор Топсе и Air Products объявили, что подписалисоглашение о глобальном партнерстве для совместной реализации крупных проектов по производству аммиака, метанола и (или) диметилового эфира в разных странах мира.
Компания Хальдор Топсе обладает 80-летним опытом работы в сфере производства аммиака и предлагает отрасли ведущие решения, которые обеспечивают надежную и безопасную работу с минимально возможным энергопотреблением и минимально возможными выбросами вредных веществ. Как в случае строительства новых установок, так и при реконструкции старых агрегатов, решения Топсе обеспечивают оптимальную работу за счет увеличения производительности, эффективности и гибкости по сырью. Дополнительная информация о решениях Топсе в сфере производства аммиака приведена на сайте.
Дополнительная информация
Свенд Равн, менеджер по связям со СМИ, Haldor Topsoe A/S
Телефон: +45 22 75 43 58
О компании Air Products
Air Products (NYSE:APD) — ведущая мировая компания по производству промышленных газов с 80-летним опытом работы. Уделяя основное внимание рынку энергоносителей, рынку товаров и услуг, связанных с охраной окружающей среды, и развивающимся рынкам, компания занимается поставкой основных промышленных газов, сопутствующего оборудования и консультационных услуг заказчикам в десятках отраслей промышленности, включая перерабатывающую, химическую, металлургическую, электронную, обрабатывающую и пищевую. Помимо этого, Air Products является мировым лидером по обеспечению технологий и оборудования для производства сжиженного природного газа. Компания разрабатывает, строит, владеет и эксплуатирует ряд крупнейших в мире объектов по производству промышленных газов, включая объекты газификации, которые обеспечивают рациональное преобразование природных богатств в синтетический газ для производства высокоценной энергии, топлива и химикатов.
В 2019 финансовом году продажи компании составили 8,9 млрд. долларов США от деятельности в 50 странах, а текущая рыночная капитализация – 50 млрд. долларов США. Более 17 000 увлечённых, талантливых и преданных сотрудников с разнообразным опытом воодушевлены благородной целью Air Products по созданию инновационных решений, которые приносят пользу окружающей среде, способствуют устойчивому развитию и устраняют проблемы, стоящие перед клиентами, сообществами и миром. Дополнительную информацию можно узнать на сайте airproducts.com и в LinkedIn, Twitter, Facebook или Instagram.
границ | Процессы устойчивого производства аммиака
Введение
По данным Организации Объединенных Наций (ООН), население мира увеличится до более чем 9 миллиардов человек в следующие 35 лет (FAO, 2009). Такой рост населения ложится бременем на природные ресурсы Земли, например, истощение запасов воды. Этот рост в то же время приведет к увеличению количества отходов. По данным Агентства по охране окружающей среды США (EPA), в Соединенных Штатах 30% производимого метана (CH 4 ) поступает из навоза домашнего скота, который вносит такой же вклад в выбросы метана, как и нефтегазовая промышленность.Неконтролируемое разложение отходов на свалках, если его не обрабатывать, приводит к выбросу метана, который является выбросом парниковых газов (ПГ) и примерно в 30 раз сильнее углекислого газа (CO 2 ) для удержания тепла в течение первых 10 лет. с момента разряда. На метан приходится 20% глобального потепления, которое наблюдается в настоящее время (IPCC, 2013; MIT News, 2017). Продовольственная и сельскохозяйственная организация (ФАО) ООН также заявляет, что мировое производство продуктов питания должно будет увеличиться на 70%, чтобы соответствовать растущему спросу из-за роста населения (ООН, 2015).Около 40–60% мирового производства продуктов питания связано с использованием коммерческих удобрений (Roberts, 2009). Ископаемое топливо является основным сырьем для процессов производства удобрений.
Согласно статистическим данным, мировое производство аммиака (NH 3 ) в 2019 году составило 235 миллионов тонн, что делает его вторым по величине производимым химическим товаром после серной кислоты (H 2 SO 4 ) (Soloveichik, 2017a ). Аммиак играет важную роль в сельском хозяйстве при производстве удобрений.Другие промышленные применения аммиака включают его использование в качестве энергоносителя для хранения и транспортировки энергии, его также можно использовать в производстве полиимидов, азотной кислоты, нейлона, фармацевтических препаратов, взрывчатых материалов, хладагентов, красителей, чистящих растворов и других промышленных химикатов. . (CICE, 2016).
Аммиак состоит из 17,6 мас.% Водорода, что свидетельствует о том, что аммиак является косвенным накопителем водорода (Michael et al., 2015). Плотность энергии аммиака составляет 4,32 кВтч / литр, что аналогично метанолу (CH 3 OH) и примерно вдвое больше, чем у жидкого водорода (Соловейчик, 2017b).Филибер (2018) указывает, что сжижение водорода сложнее по сравнению с аммиаком, поскольку аммиак сжижается при -33,4 ° C и при атмосферном давлении: водород необходимо сжижать путем охлаждения до температур ниже -253 ° C. Одной из основных проблем использования водорода в качестве энергоносителя является сложность его транспортировки и хранения без рассеивания и, следовательно, невозможности его использования по назначению. Другой проблемой, связанной с этим рассеиванием, является его безопасность при транспортировке и хранении.Еще одна проблема, связанная с водородом, используемым в качестве энергоносителя, — это низкая плотность энергии и сложность обращения (Nordvang, 2017). Это связано с объемной плотностью энергии водорода в жидком безводном аммиаке (10,1 МДж / л), которая примерно в 1,5 раза выше, чем в жидком водороде, как показано в таблице 1. С точки зрения безопасности газообразный аммиак почти не отличается от воздуха. , поэтому в случае утечки аммиак быстро улетучивается в атмосферу. Однако, в отличие от водорода, аммиак обычно не взрывоопасен.Это опасное химическое вещество, и с ним следует обращаться осторожно из-за его едкости и токсичности (Brown, 2016). Из-за вышеупомянутых факторов аммиак рассматривается как практический вектор энергии для водорода. В мире, где все больше и больше внедряется возобновляемая генерация с низким содержанием углерода, способная обеспечивать первичную электроэнергию для электролиза водорода, этот аммиак можно назвать зеленым аммиаком.
Согласно Соловейчику (2017a), аммиак считается не только удобрением, но и энергоносителем.Кроме того, с глобальным переходом от ископаемого топлива к переменным возобновляемым источникам энергии, таким как солнце и ветер, возрастает потребность в решениях по хранению энергии, которые могут охватывать различные временные рамки для хранения энергии. Особый интерес представляет возможность экономно хранить энергию в течение длительных периодов времени без значительного снижения энергии, транспортировать накопленную энергию на большие расстояния (также без значительного снижения энергии) и иметь возможность хранить энергию в тераваттном режиме. часов (ТВт-ч) экономично масштабируется, возможно, потребуется только заряжать и разряжать небольшое количество раз в течение года (Wilson and Styring, 2017).Это общие характеристики ископаемого топлива, которые помогают объяснить, почему оно так широко распространено. Кажется очевидным, что топливо (газообразное, жидкое или твердое) особенно полезно для удовлетворения этих характеристик и, следовательно, по-прежнему будет необходимо в будущих энергетических системах из-за постоянной необходимости обеспечивать межсезонное хранение (Wilson and Styring, 2017) и продавать энергию по всему миру. каналы поставок. Поэтому в будущих низкоуглеродных энергетических системах их следует рассматривать как низкоуглеродные виды топлива, а аммиак — как синтетическое топливо, способное удовлетворить эти требования.
Широко применяемые технологии производства аммиака
Технологии производства аммиака, которые используются в настоящее время, требуют либо стабильной подачи дистиллированной воды в больших объемах, либо приводят к высокому производству диоксида углерода. Наиболее часто используемым методом производства аммиака является процесс Хабера-Боша, который имеет недостатки, заключающиеся в высоких выбросах парниковых газов и большом потреблении энергии, в основном из-за высокого рабочего давления и температуры. Для устойчивого производства аммиака наиболее широко применяемой технологией является электролиз воды в сочетании с такими возобновляемыми технологиями, как энергия ветра и солнца для производства водорода.Как правило, для работы водного электролизера требуется непрерывный поток предварительно обработанной воды высокой степени чистоты. Причем для производства 1 тонны водорода требуется 9 тонн воды. В 2016 году объем произведенного аммиака во всем мире составил 146 миллионов тонн (Cong et al., 2019). Исходя из этих данных, для производства того же количества аммиака путем электролиза воды требуется 233,6 миллиона тонн (233,6 миллиарда литров) воды.
Аммиак производится на крупных заводах (от 1000 до 1500 т / сутки) по технологии Габера-Боша (Соловейчик, 2017a).Во всем мире более 90% аммиака производится из ископаемого топлива с помощью этого метода (Hughes et al., 2015; Guerra et al., 2020). Процесс Хабера-Боша обычно основан на ископаемом топливе, которое функционирует при температурах в диапазоне 400–500 ° C и давлении в диапазоне 150–300 бар, обычно в присутствии катализатора на основе железа (Fe) (Garagounis et al. др., 2014; Wang et al., 2018). Около 96% водорода (H 2 ), необходимого для производства аммиака с помощью процесса Габера-Боша, получают из ископаемого топлива (Parkinson et al., 2018). Остальные 4% вырабатываются за счет электроэнергии, которая будет включать косвенное использование ископаемого топлива из угля или природного газа для выработки электроэнергии (Michael et al., 2015). Типичный процесс парового риформинга метана (SMR) дает примерно 9–10 тонн эквивалента диоксида углерода (CO 2 экв. ) на каждую тонну произведенного водорода (Parkinson et al., 2018). Во всем мире 72% водорода, производимого для производства аммиака, получают в процессе SMR, а 26% — из угля (IEA, 2012; Kevin Breen, 2012).В 2016 году аммиак из угля составлял более 82% производства аммиака в Китае (Heffer and Prud’homme, 2016).
Недостатком процесса Haber-Bosch являются высокие выбросы парниковых газов, превышающие 2,16 тонны CO 2 на тонну NH 3 , и высокое потребление энергии, превышающее 30 ГДж / тонну NH 3 , в основном из-за высокого давления. и температура (Yoo, et al., 2013). Примерно 3–5% добываемого в мире природного газа используется для производства аммиака с помощью процесса Габера-Боша (Wang et al., 2018). Этот показатель составляет около 1-2% мирового энергоснабжения (Hughes et al., 2015; Wang et al., 2018). Как правило, при производстве удобрений требуется много энергии. Примерно 1,2% мировой энергии используется для производства удобрений, 93% из которых основаны на азоте (IFA, 2009).
Это исследование направлено на ответ на вопрос, какие технологии могут решить основные проблемы, связанные с производством водорода, необходимого для синтеза аммиака, который используется в настоящее время, например, необходимость постоянной подачи деионизированной воды в больших объемах и / или или высокое производство двуокиси углерода.Чтобы ответить на вопрос исследования, был проведен систематический обзор литературы. Результаты, полученные в соответствующей литературе, были затем классифицированы и систематизированы с помощью контент-анализа. Таким образом, в данной статье представлен всесторонний обзор литературы по технологиям производства аммиака и различным процессам производства водорода, необходимым для синтеза аммиака.
В доступной литературе имеется пробел в исследованиях, посвященных устойчивым процессам производства водорода, таким как твердооксидный топливный электролизер с использованием CH 4 (SOFEC), паровой электролиз с использованием природного газа (NGASE) и темная ферментация в сочетании с другими биологическими технологиями, объединенными в исследование синтеза аммиака.Увеличение доступности отходов заставляет нас сосредоточиться на использовании темной ферментации, интегрированной с другими биологическими технологиями, которые могут использовать отходы в качестве сырья, или на процессе, который может использовать биогаз в качестве входного потока, например, CH 4 Assisted-SOFEC / NGASE. Биоконверсия отходов с помощью вышеупомянутых биологических технологий в важные химические соединения, такие как аммиак, может быть новым альтернативным путем восстановления ресурсов для химических веществ на основе ископаемых. Эти технологии будут описаны и рассмотрены в документе CH 4 Электролизная ячейка с твердым оксидным топливом и вспомогательным топливом и Процессы биологического производства водорода с точки зрения эффективности, экономики и по сравнению с другими процессами.В статье «Производство водорода с использованием солнечной энергии и фотоэлектрохимии» рассматривается устойчивое производство водорода с использованием солнечной энергии в и обсуждаются проблемы, связанные с его расширением. В A Review of Sustainable Technologies for Ammonia Production Критический обзор новых технологий для производства аммиака, состоящих из электрохимической, нетепловой плазмы, Университета Западной Вирджинии (WVU) и катализатора с пептидными функциональными группами, основанного на нитрогеназе, для электрохимического синтеза аммиака.Эти технологии, которые находятся на стадии исследований и разработок, не были расширены в коммерческом масштабе, чтобы конкурировать или заменять процесс Haber-Bosch.
Взаимосвязь между ценами на аммиак и природный газ
Доступ к доступным и богатым источникам производства аммиака критически важен для стабильных, экономически жизнеспособных поставок в мировой сельскохозяйственный сектор. Влияние волатильности цен на природный газ существенно влияет на конечную цену производства аммиака.При производстве аммиака 70–90% затрат связаны с ценами на природный газ (Dincer and Bicer, 2018). Следовательно, рыночная цена аммиака колеблется вместе с ценами на природный газ. Цена как на природный газ, так и на аммиак увеличивалась в большинстве лет, первая с примерно 0,141 доллара за м 3 в 1975 году до 0,53 доллара за м 3 в 2015 году, а вторая — с 290 долларов за тонну NH 3. в 1975 году до примерно 850 долларов за тонну NH 3 в 2015 году и достигла максимума в 2015 году.В период с 2012 по 2016 год цена на природный газ снизилась во всем мире из-за увеличения добычи природного газа, главным образом в США (Schnitkey, 2016).
Производство аммиака с использованием морского ветра
Morgan et al. (2017) также определили, что производство аммиака с использованием водорода с помощью морского ветра технически осуществимо при существующих технологиях, а его экономическая целесообразность основана на цене природного газа при использовании традиционных методов. Этот процесс включает: опреснение морской воды, производство газообразного водорода, отделение азота, синтез аммиака и хранение аммиака.Это исследование показывает, что предприятиям по производству аммиака, использующим современные технологии, работающие исключительно на электроэнергии, требуется значительная помощь со стороны сети в качестве резервной для работы. Результат анализа чувствительности, проведенного Морганом (2013), показал, что окончательная стоимость аммиака в значительной степени зависит от стоимости производства ветровой электроэнергии на море.
Методы
Целью данного исследования является обзор литературы по традиционным и новым методам устойчивого производства аммиака.Основываясь на тщательном обзоре литературы, ряд основных очевидных недостатков в устойчивых технологиях производства аммиака описан в Introduction и подробно описан в Решение проблем, связанных с текущими возобновляемыми технологиями производства аммиака . Более устойчивые и низкоуглеродные способы производства аммиака, описанные в этом исследовании, имеют решающее значение для обеспечения продовольственной безопасности и хранения энергии таким образом, чтобы это было совместимо с усилиями по глубокой декарбонизации.В этой работе был проведен систематический обзор на основе сформулированного исследовательского вопроса: «Как устойчиво производить аммиак?» Темы исследований были разделены на три основные категории: 1) Поиск наиболее устойчивых путей производства водорода, необходимого для синтеза аммиака 2) Поиск устойчивых новых появляющихся технологий производства аммиака 3) Проблемы, связанные с устойчивым производством водорода / аммиака. Производство зеленого аммиака, рассматриваемое в этой работе, ориентировано на использование водорода, полученного из возобновляемых источников.Различные технологии производства водорода, необходимые для синтеза аммиака, оцениваются в A Review of Hydrogen Production Technologies for Ammonia Synthesis . Поскольку водород является ключевым компонентом синтеза аммиака, мы должны сосредоточиться на экологически безопасных способах производства водорода. Мы оценили две наиболее часто используемые технологии для производства аммиака, а именно SMR и электролиз воды в сочетании с Haber-Bosch, с точки зрения выбросов парниковых газов, электроэнергии и потребления воды.Другие технологии устойчивого производства водорода, рассмотренные в этом исследовании, производятся электрохимическим способом (CH 4 assisted-SOFEC / NGASE) и биологическим (темная ферментация в сочетании с другими технологиями, такими как фотоферментация и анаэробное разложение). Обоснование выбора этих конкретных процессов состоит в том, что в доступной литературе имеется пробел в исследованиях, позволяющих консолидировать оценку этих технологий для устойчивого производства водорода, необходимого для синтеза аммиака.Стоимость производства водорода с использованием CH 4 Assisted-SOFEC сопоставима с SMR в дополнение к тому, что производство производится экологически рациональным способом. Сырьем для этой технологии может служить биогаз, полученный в результате биоконверсии отходов. Согласно статистическим данным, приведенным во введении и сообщенным EPA, переизбыток потоков отходов представляет большую угрозу для контроля выбросов парниковых газов. Следовательно, биоконверсия отходов посредством темной ферментации, фотоферментации и т. Д. В важные химические соединения, такие как аммиак, может быть новой альтернативой восстановления ресурсов для химических веществ на основе ископаемых.Различные новые устойчивые технологии производства аммиака представлены в A Review of Sustainable Technologies for Ammonia Production и, наконец, критический обзор различных технологий производства аммиака с использованием метода оценки жизненного цикла (LCA) описан в Влияние различных процессов производства аммиака на окружающую среду . Исходя из цели данной работы, были определены ключевые слова и количество найденных связанных статей: «зеленый» И «производство водорода» (23 825 статей), «производство зеленого аммиака» (83 059 статей), «энергоноситель» (15 887 статей). ), «Устойчивое производство аммиака» (37 539 статей) и «производство аммиака» И «Оценка жизненного цикла» (241 статья).Анализ статей проводился исходя из качества исследования и релевантности теме обзора. При выборе документов для оценки для этого обзора мы решили сосредоточиться исключительно на экологически чистых и / или устойчивых технологиях производства водорода, необходимого для синтеза аммиака и технологий производства аммиака. Особое внимание уделяется технической и экологической оценке и исключению экономических аспектов этих технологий, чтобы избежать тенденции ценить экономические факторы выше технических и экологических.Более того, оценка местоположения для определения пригодности площадки для производства аммиака не была включена в этот обзор. Хотя это исследование направлено на критический обзор устойчивых процессов производства водорода и аммиака, ископаемые технологии (например, традиционные производственные маршруты с использованием ископаемого топлива) также включены в документ для сравнения данных / результатов. Однако стратегия исследования заключалась в поиске соответствующих научных статей, опубликованных в научных журналах, с использованием одной из самых известных академических баз данных.Для целей обзора были выбраны базы данных Science Direct, Web of Science, Springer, Wiley и т. Д. Исследование проводилось с учетом периода публикации с 1992 г. по май 2020 г. После поиска в различных базах данных результаты были затем отфильтрованы. и рассматривается в три этапа: на основе заголовка, ключевых слов, аннотации и после прочтения всей статьи. Мы исключили статьи, которые не были связаны с вопросами нашего исследования или были дубликатами. Кроме того, метод снежного кома использовался для поиска дополнительных подходящих документов путем проверки ссылок на собранные документы и их оценки, как указано выше.В результате было выявлено 118 соответствующих публикаций, из которых 116 статей на английском языке и две на итальянском языке. Что касается типа публикации, то 43 исследования были опубликованы в виде журнальных статей, а остальные были опубликованы в виде диссертаций, материалов конференций, правительственных документов, отчетов и справочников. Данные были собраны из всех соответствующих статей, цитируемых в ссылках.
Обзор технологий производства водорода для синтеза аммиака
Аммиак является результатом экзотермической реакции между водородом и азотом, показанной равновесием в уравнении.1.
12N2 (г) + 32h3↔Nh4 (г) △ H = -93 (кДж / моль) (1)Основная задача производства аммиака — найти экономически жизнеспособный, энергоэффективный и более устойчивый путь производства. водорода. Более того, весьма желателен процесс, в котором равновесие сдвигается вправо. Обзор различных способов получения водорода, необходимого для синтеза аммиака, представлен на рисунке 1.
Рисунок 1 . Различные маршруты производства водорода.
Сравнение различных процессов производства водорода (термохимических, биохимических и электрохимических) вместе с кратким описанием их сырья и источника энергии показано в таблице 2.
Различные технологии производства водорода с их энергозатратами и состоянием коммерциализация описана в таблице 2. Эти технологии производят водород напрямую, без необходимости превращения его в чистый водород.
CH
4 Ячейка для электролиза твердого оксидного топлива с добавкой твердого оксидаТехнология SOFEC — это тип электролиза, целью которого является производство водорода с меньшими затратами по сравнению с другими доступными технологиями электролиза.В SOFEC метан добавляется к анодной стороне электролизера, потенциал разложения (напряжение) воды снижается, что приводит к более низкому потреблению энергии и более высокому коэффициенту преобразования электроэнергии для производства водорода. КПД системы до 70% по первичной энергии. Wijers (2011) также упоминает лабораторный тест на основе SOFEC, который показал снижение потребности в электроэнергии на 85% по сравнению с лучшими доступными альтернативными методами электролиза. Pham et al., (2000) было первым исследованием, предлагавшим добавлять топливо (метан) к аноду, тем самым снижая напряжение, необходимое для процесса электролиза. Конечная стоимость водорода через CH 4 Assisted-SOFEC является конкурентоспособной по сравнению с ценами на водород через метод SMR (Luo et al., 2014). Однако его высокие рабочие температуры и длительная нестабильность ограничивают его практическое применение. На рис. 2 показана схема CH 4 -SOFEC с участвующими химическими реакциями (рис. 2).
РИСУНОК 2 .Схема CH 4 Assisted-SOFEC.
Паровой электролизер с добавлением природного газа
Martinez-Frias et al. (2003) создали лабораторную модель, известную как NGASE, в которой рабочее напряжение этого электролизера может быть уменьшено на целых 1 В (примерно с 1,2 В – 0,2 В). Это снижение напряжения является результатом подачи природного газа на анодную сторону электролизера. В этой технологии природный газ заменяет воздух на анодной стороне, в то время как катодная сторона заполнена водой.Таким образом, этот подход работает аналогично топливному элементу, вырабатывая электричество с помощью электрохимической реакции (Gross, 2008). NGASE — это особый тип SOFEC CH 4 , в котором метан добавлен на анодную сторону электролизера для производства водорода. Первоначально NGASE был основан на теории, согласно которой добавление метана к аноду снижает напряжение электролиза.
Фотоэлектрохимическое производство водорода
Оба исследования, проведенные Wang et al.(2018) и Bicer (2017) сосредоточены на производственном процессе H 2 / NH 3 с использованием систем на основе солнечной энергии. Wang et al. (2018) утверждают, что если бы аммиак мог производиться непосредственно из азота и воды, питаясь солнечным светом, эффективным и рентабельным способом и с помощью технологически продвинутого процесса, этот так называемый процесс зеленого аммиака мог бы изменить мир. Байсер (2017) приходит к выводу, что использование фотоэлектрохимических и каталитических процессов производства водорода развивается, но необходимо провести технико-экономическое обоснование этих методов, чтобы изучить их жизнеспособность.В фотоэлектрохимических подходах требуется светочувствительный материал, такой как полупроводник, в котором в основном используется система электроосаждения. Существуют различные типы маршрутов осаждения, которые работают при разных температурах (некоторые превышают 100 ° C). Wang et al. (2018) представили различные процессы производства аммиака, такие как исследование, проведенное Али и др. (2016) с использованием солнечной энергии. Полученные результаты показывают, что выходы солнечного аммиака вместе с процессами восстановления азота под действием света в настоящее время находятся в нмоль г cat -1 h -1 до мкмоль g cat -1 h -1 и недостаточно для реализации в промышленных масштабах.
Биологические процессы производства водорода
Одна из основных проблем производства аммиака из биомассы с использованием процесса биологического производства водорода согласно Arora et al. (2016) заключается в том, что производство аммиака из биомассы возможно только в больших объемах (производство аммиака на мировом уровне). Из-за экономии на масштабе более мелкие предприятия находятся в невыгодном положении по сравнению с крупномасштабными предприятиями. Arora et al. (2016) также упомянули, что транспортировка биомассы на большие расстояния (> 100 км) экономически нецелесообразна, поскольку стоимость транспортировки будет превышать стоимость энергии биомассы.Это связано с тем, что биомасса имеет более низкую плотность энергии по сравнению с ископаемым топливом. При оценке процессов производства водорода для производства аммиака этот вопрос необходимо учитывать.
Темная ферментация
Темная ферментация — это ферментативное преобразование и универсальный биопроцесс для производства молекулярного биогидрогена из различного биоразлагаемого возобновляемого сырья с помощью широкого спектра различных типов бактерий (Kothari et al., 2017; Yaswanth, 2018).Этот процесс происходит в бескислородных и анаэробных условиях (в отсутствие кислорода), в которых во время этого процесса образуется широкий спектр анаэробных ферментативных бактерий, таких как Clostridium , факультативных анаэробов, таких как enterobacter , и аэробов, таких как палочка . участвуют в процессе ферментации (Ghimire et al., 2015). Основным механизмом этого процесса является разложение богатых углеводами субстратов с помощью таких микроорганизмов, как Clostridia Sp., Enterobacter Sp . к газам водорода и углекислого газа и другим промежуточным продуктам, таким как летучие жирные кислоты (ЛЖК) и спирты. Основными побочными продуктами процесса темного брожения являются летучие жирные кислоты, молочные кислоты, спирты и гидролизованные остатки. Эти побочные продукты могут использоваться в других биологических процессах для повышения ценности за счет рекуперации энергии или могут использоваться в качестве сырья для химического производства. Редди (2016) утверждает, что температура является одним из факторов, влияющих на процесс ферментации, который сдвигает метаболический путь к производству водорода.Эти температурные диапазоны следующие: мезофильный (работают при температурах в диапазоне 25–40 ° C), термофильный (работают при температурах в диапазоне 40–70 ° C), экстремально термофильные (работают при температурах в диапазоне 65–80 ° C). ° C), так и гипертермофильный (работают при температуре выше 80 ° C). Анаэробные бактерии, которые более активны при мезофильных и термофильных температурах, используются для преобразования широкого спектра отходов, таких как сахароза, целлюлоза, глюкоза и крахмалы, с чистыми штаммами и генетически улучшенными культурами, как показано в реакции в уравнении.2 (Арслан и др., 2015). Увеличение выхода водорода с 4 моль H 2 / моль глюкозы до 12 моль H 2 / моль глюкозы может дать выходы производства водорода, как показано в уравнении. 4 (Сен и др., 2008). Повышение выхода водорода связано с процессом ферментации и конечными продуктами (Ghimire et al., 2015). Если уксусная кислота (CH 3 COOH) является побочным продуктом реакции в уравнении 2, теоретический максимум 4 моль H 2 / моль глюкозы будет достигнут, как (Ghimire et al., 2015; Sen et al., 2008):
C6h22O6 + 2h3O → 4h3 + 2Ch4COOH + 2CO2 + .. △ G = -206 (кДж / моль) (2)Кроме того, когда бутират является единственным продуктом в процессе, согласно реакции в Уравнение 3 теоретический максимум 2 моль H 2 / моль глюкозы получается как:
C6h22O6 + 2h3O → 2h3 + 2Ch4Ch3Ch3COOH + 2CO2 (3)Для полного окисления глюкозы до водорода и диоксида углерода, как показано в реакции (4 ) теоретический максимум 12 моль H 2 / моль глюкозы получается как (Sen et al., 2008):
C6h22O6 + 6h3O → 12h3 + 6CO2 △ G = -3.2 (кДж / моль) (4)Реакция в уравнении. 4 предназначен для полного окисления и основан на теории и еще не применен экспериментально. Фактический выход водорода всегда будет ниже теоретического выхода. Основная проблема темного брожения, по мнению Sen et al. (2008) — низкая концентрация водорода, которая находится в диапазоне 40–60%. Увеличение выхода водорода до более чем 4 моль H 2 / моль глюкозы делает водород экономически выгодным. Еще один способ увеличения выхода водорода при темной ферментации — объединить его с другими процессами, такими как фото-ферментация, метаногенез, микробная электролизная ячейка (MEC) и микробная топливная ячейка (MFC) (Reddy, 2016; De Gioannis et al., 2013). Схема биохимических стадий разложения органических отходов для производства биогаза показана на рисунке 3. Эти стадии состоят из гидролиза, ацидогенеза и ацетогенеза.
РИСУНОК 3 . Биохимический процесс разложения отходов для производства биогаза (Apadted и модифицированный, Ghimire et al., 2015).
Темное брожение в сочетании с анаэробным сбраживанием
Согласно Liu et al. (2008) двухстадийный процесс, который сочетает в себе производство биоводорода и биометана, является одним из возможных решений для повышения эффективности процесса темной ферментации.Производство водорода исключительно из темной ферментации экономически нецелесообразно из-за низкого выхода водорода и сложных рабочих условий со многими переменными, такими как поддержание pH, температуры, скорости органической загрузки (OLR) и удельной скорости загрузки органических веществ на заданном уровне. Например, были проведены эксперименты с пищевыми отходами для двухэтапного анаэробного процесса разложения при различных рабочих условиях (pH, температура, скорость органической нагрузки и время гидравлического удерживания (HRT)), как показано в таблице 3 (Cavinato and Pavan, 2011). ; Bolzonellaa et al., 2018). Это показывает, что наивысшая скорость удельной добычи водорода (SHP) и удельной добычи газа (SGP) была достигнута при pH 5,5 и HRT 1,3, что является самым низким значением по сравнению с двумя другими упомянутыми исследованиями. Однако скорость рециркуляции самая высокая по сравнению с другими исследованиями. Ингибирование метаногенной активности может быть достигнуто путем мониторинга рабочих параметров, таких как pH, температура (тепловая обработка посевного материала может инактивировать гидрогентрофные метаногены, усилить водород-продуцирующие бактерии и выбрать анаэробы, которые образуют споры.), OLR или с использованием добавок (De Gioannis et al., 2013).
ТАБЛИЦА 3 . Влияние изменения скорости рециркуляции на двухступенчатую темную ферментацию в сочетании с анаэробным сбраживанием.
Анаэробное сбраживание — это непрерывный биохимический процесс, в котором сложные субстраты разлагаются и перевариваются под действием микробов и превращаются в биогаз (Pengyu et al., 2017). Процесс анаэробного пищеварения происходит в отсутствие кислорода и проходит через четыре основных этапа: гидролиз, ацидогенез, ацетогенез и метаногенез.Производство биогаза в результате процессов анаэробного сбраживания представляет собой сложный механизм, в котором происходят несколько химических и биохимических явлений. На этих этапах крупные органические материалы, из которых состоит биомасса, расщепляются на более мелкие молекулы с помощью микроорганизмов в отсутствие кислорода. Продукты реакции одной группы микроорганизмов являются субстратами для следующего набора реакций. В результате процесса анаэробного сбраживания биомасса превращается в биогаз, состоящий из: метана, диоксида углерода, а также соединений серы, таких как сероводород (H 2 S), и некоторых незначительных следов других газов, таких как аммиак, азот, метан. , пар и т. д.
В двухстадийном процессе получения водорода и биометана с твердыми бытовыми отходами в качестве субстрата, работающего при температуре 37 o C, выход водорода составил 43 мл / г VS (Liu et al., 2008). Кроме того, производство метана в двухстадийном процессе было на 21% выше, чем в обычном одностадийном процессе метаногенеза, поскольку он усиливал гидролиз бытовых отходов, что оказалось основным препятствием для анаэробного сбраживания твердых бытовых отходов. Micolucci et al.(2018) провели эксперимент по одностадийному анаэробному процессу разложения пищевых отходов в лабораторных масштабах и сообщили о выходе метана 0,45 м 3 CH 4 / кг VS, с достигнутой степенью удаления летучих твердых веществ 83%. Анаэробное сбраживание также проводилось в двухфазном процессе и показало существенное снижение выхода летучих твердых веществ с 1751 кг / день до 1233 кг / день по сравнению с одностадийным процессом. Полученный баланс энергии и массы демонстрирует, что однофазные процессы были на 33% лучше с точки зрения производства биогаза и выхода энергии (Micolucci et al.2018). Однако, сравнивая баланс энергии и массы с двухступенчатым реактором, окончательные результаты показывают, что средняя концентрация метана для двухфазного процесса составляла 68% с растворимыми микробными продуктами (SMP) 351 LCH 4 / кг VS . Для одноступенчатой стадии концентрация метана составила 55% с 404 LCH 4 / кг VS. В конце концов, автор отмечает, что двухэтапный процесс анаэробного сбраживания может увеличить восстановление энергии из биомассы по сравнению с одноступенчатым процессом. Micolucci et al.(2018) также провели эксперимент, чтобы определить, как анаэробное сбраживание органического сырья с химической потребностью в кислороде (ХПК) составляет почти 1 г / л пищевых отходов или органической фракции твердых бытовых отходов (OFMSW). расходуется как в одностадийных, так и в двухстадийных процессах. Путем сравнения обоих процессов анаэробного сбраживания было обнаружено, что двухэтапный процесс имеет эффективность удаления, которая на 17% выше, чем у одностадийного процесса. Кроме того, благодаря применению обезвоживания дигестатом после процесса двухступенчатая система показала на 33% меньше удаляемого ила.SGP на второй стадии был выше и составлял около 0,88 м 3 биогаза / кг VS по сравнению с однофазным реактором, который составлял 0,75 м 3 биогаза / кг VS. Общая эффективность двухступенчатой системы удаления была на 16% выше по сравнению с однофазным анаэробным процессом разложения. Это указывает на устойчивость и высокий выход биогаза при использовании двухэтапного, а не однофазного процесса конфигурации, который существенно повлияет на процесс метаногенеза. Ферментация играет роль предварительной обработки пищевых отходов, поскольку она увеличивает эффективность преобразования летучей фракции в производство биогаза (Micolucci et al.2018).
Сравнение различных процессов биологического производства водорода
Основными препятствиями для реализации крупномасштабной темной ферментации для производства водорода являются: 1) низкий выход водорода и 2) высокие производственные затраты из-за высокой стоимости исходного сырья. Эту проблему можно решить, выбрав дешевое сырье, такое как биомасса, включая сельскохозяйственные остатки и органические отходы, образующиеся в результате промышленных и муниципальных работ (Tapia-Venegas et al., 2015). Согласно Kapdan and Kargi (2006), Chong et al.(2009), а также Zilouie и Taherdanak (2015), это даст темной ферментации конкурентное экономическое преимущество по сравнению с другими методами, которые в настоящее время используются для производства водорода, такими как электролиз воды и газификация биомассы. Сравнение различных типов методов производства биоводорода показано в таблице 4.
ТАБЛИЦА 4 . Сравнение различных типов биологических методов получения водорода.
Темная ферментация превосходит другие процессы биологического производства водорода, упомянутые в этом исследовании, поскольку для ее работы не требуется свет.В результате его можно применять даже в местах, где отсутствует доступ к интенсивному источнику света и отсутствуют высокие затраты, связанные с галогенными лампами. Скорость производства водорода увеличивается, когда интенсивность света увеличивается и достигает точки насыщения, в зависимости от сырья и микроорганизмов. Недостаток инфракрасного света с длинами волн 750–950 нм снизит производство водорода на 39%. Согласно Argun и Kargi (2010), как источник, так и интенсивность света влияют на выход и скорость образования газообразного водорода при фотоферментации.Лю и др. (2009) провели исследование для оценки влияния интенсивности света и цикла свет / темнота на производство биогидрогена с помощью комбинации clostridium butyricum и R. faecalis RLD-53. В процессе комбинирования самый высокий выход составил 5,374 моль-H 2 / моль-глюкоза.
Аргун и Карги (2010) также провели исследование того же цикла (темная ферментация / фотоферментация) для производства биогидрогена R. sphaeroides -RV. Галогенные лампы оказались наиболее подходящими источниками света с интенсивностью света 5 клюкс.Производство водорода было минимальным, когда доступность света была ниже 5 клюкс, в то время как при интенсивности света выше 5 клюкс производство не происходило. Таким образом, оптимальное производство водорода достигается при уровне 5 клк. Было установлено, что общий выход водорода для цикла темнота / свет составляет 4,55 моль H 2 / моль глюкозы. И темновая ферментация, и фотоферментация могут использовать широкий спектр органических субстратов в качестве исходного сырья для работы. Другие методы био-водорода, такие как прямой и непрямой био-фотолиз, требуют воды для производства водорода и кислорода.Скорость производства водорода для темной ферментации выше по сравнению с технологиями, указанными в таблице 4. Продукты, полученные в результате темной ферментации в соответствии с химическими реакциями в уравнениях. 2, 3 — водород, диоксид углерода и летучие жирные кислоты, которые можно использовать в качестве субстрата для анаэробного сбраживания с целью получения биометана. Смесь водорода, полученного в результате темного брожения, вместе с метаном, образующимся в процессе анаэробного сбраживания, может производить биогитан, смесь водорода и метана (Bolzonella et al., 2018). Согласно таблице 4, цитируемой Tenca (2011), Valdez-Vazquez и Poggi-Varaldo (2009), Hawkes et al. (2007) и Akroum-Amrouche et al. (2013), можно сделать вывод, что среди методов производства биогидрогена темная ферментация является наиболее эффективной биологической технологией в сочетании с упомянутыми методами производства водорода, необходимого для синтеза аммиака.
Обзор устойчивых технологий производства аммиака
В связи с важной ролью аммиака в качестве удобрения в сельскохозяйственной отрасли и его многообещающими перспективами в качестве энергоносителя, в последнее время во многих исследованиях была предпринята попытка найти наиболее экологически безвредный, энергоэффективный, и экономически выгодный производственный процесс для синтеза аммиака.Существует ряд устойчивых технологий для производства аммиака, таких как электрохимическое производство аммиака, нетепловой плазменный (NTP) синтез для производства аммиака и катализатор с пептидами, функционализированный нитрогеназой, для электрохимического производства аммиака. Эти технологии будут оцениваться в «Электрохимическое производство аммиака», «Нетепловой плазменный синтез (NTP) для производства аммиака» и «Катализатор, функционализированный нитрогеназой и пептидами» для электрохимического производства аммиака соответственно.
Электрохимическое производство аммиака
Электрохимические технологии производства аммиака делятся на три категории в зависимости от диапазона рабочих температур электрохимической ячейки: низкие температуры, ниже 100 ° C, промежуточные температуры в диапазоне 100–400 ° C и высокие температуры в диапазоне 400–750 ° C (Amar et al., 2011). Согласно Soloveichk (2017), преимущества электрохимической технологии по сравнению с термохимической (Haber-Bosch) заключаются в четырех основных областях:
(1) Более высокий КПД, что позволяет экономить энергию.
(2) Более высокая селективность, означающая, что требуется меньшая очистка.
(3) Более низкие температуры и давления, что приводит к уменьшению капитальных затрат (CAPEX) за счет более низкой балансировки оборудования.
(4) Модульность, которая делает эти установки пригодными для использования в малых и средних масштабах.
Электрохимический синтез аммиака при низких температурах (
<100 ° C)Для температур ниже 100 ° C, ячейка с раствором гидроксида калия (КОН) в качестве электролита и нафион в качестве разделительной мембраны, платина (Pt) анод и катод из рутения (Ru) / C используются для синтеза аммиака (Kordali et al., 2000). Максимальная производительность для этого заявлена как ок. 2 × 10 -11 моль с −1 см −2 , работа при температуре 90 ° C, в результате пара и азота с фарадеевской эффективностью (FE) 0,2–1%, которая составляет определяется как доля протонов, которые превращаются в аммиак при миграции в электролите. Электролиты, которые используются для низкотемпературного электрохимического синтеза аммиака вместо полимерной электролитической мембраны, представляют собой мембраны из сульфированного полисульфона (SPSF), мембраны Nafion или NH 4 + вместо мембран Nafion (Lan et al., 2013). Xu et al. (2009) исследовали максимальную скорость производства аммиака 1,13 × 10 -8 моль с -1 см -2 , работая при низкой температуре 80 ° C с приложенным напряжением 2 В с помощью мембраны Nafion. (в качестве электролита), SDC, легированный никелем (Ni-SDC), NiO — Ce 0 . 8 Sm 0 . 2 O 2− δ анод и SmFe 0 . 7 Cu 0 . 3-x Ni x O 3 (x = 0–0.3) (SFCN) катод. В качестве реагентов в процессе, работающем при атмосферном давлении, использовали водород и азот. Достигнут высокий фарадеевский КПД, превышающий 90% (90,4%). Этот показатель выше, чем сообщалось в других исследованиях при тестировании низкотемпературных процессов синтеза аммиака. Как утверждают Lan et al. (2013), аммиак является слабым основанием, которое может реагировать с кислыми мембранами, такими как нафион, что приводит к снижению протонной проводимости. В результате было заявлено, что использование мембраны Nafion преобразуется из формы H + в форму NH 4 + в результате воздействия на ячейку потока, состоящего из раствора аммиака, с фарадеевской эффективностью ниже 1%.Lan et al. (2013) провели эксперимент по производству аммиака из воздуха и воды при температуре окружающей среды. Низкая фарадеевская эффективность этого эксперимента обусловлена типом используемого катализатора (Pt), который не является наиболее подходящим выбором для восстановления азота. Лапина и др. (2013) заявляет, что воздух можно использовать вместо чистого азота, хотя некоторые авторы утверждают, что кислород отравляет катализатор, используемый в процессе синтеза аммиака (Marrony, 2015). Лапина и др. (2013) указывает, что влияние использования чистого азота или воздуха (в качестве источника азота) на фарадеевскую эффективность не сообщалось ни в одном исследовании.Лапина и др. (2013) также утверждают, что при низких температурах производство аммиака из азота и водорода происходит самопроизвольно, и, как следствие, минимальное необходимое напряжение является отрицательным, что означает, что нет необходимости подавать напряжение. Хотя на самом деле требуется приложение напряжения для преодоления перенапряжения электрода и омических потерь в электролите, в то время как через элемент проходит ограниченный ток. Если вместо водорода используется вода, для запуска реакции необходимо приложенное напряжение (Лапина и др., 2013).
Электрохимический синтез аммиака при высоких температурах (> 400 ° C)
Для высоких температур в диапазоне 400–750 ° C твердотельный протонный проводник или оксидный ионный проводник используется в качестве электролита для электрохимического синтеза аммиака. . Было проведено несколько исследований по использованию как протонных ионных проводников, так и оксидных ионных проводников, таких как Marnellos et al. (2000) и Skodra и Stoukides (2009). Skodra и Stoukides производили аммиак с помощью пара и азота при температурах в диапазоне 450–700 ° C, используя рутений в качестве катализатора, нанесенного на серебро (Ag) или палладий (Pd) в качестве катода.В их исследовании SrCe 0 . 95 Юб 0 . 05 O 3 − δ в качестве протонного проводника или ZrY 0 . 92 Да 0 . В качестве электролитов использовались 08 O 2 − δ в качестве оксидно-ионного проводника. Для обоих коэффициентов производства соответственно: 10 –12 и 10 –11 моль с –1 см –2 с фарадеевской эффективностью 0,01%. Фарадеевская эффективность, заявленная Marnellos и Stoukides (1998) и Marnellos et al.(2000) составила 90%, что было достигнуто за счет использования водорода и азота в ячейке с SrCe 0 . 95 Юб 0 . 05 O 3-δ электролит и электроды из палладия (Лапина и др., 2013). Во всех упомянутых исследованиях ионные токи, то есть скорости миграции ионов в электролите, были в одном масштабе. Скорость производства аммиака была примерно на три порядка ниже в эксперименте, проведенном Skodra и Stoukides (2009).Одним из основных недостатков высокотемпературного синтеза аммиака является то, что он может термически разлагаться после производства. Лю и др. (2006) сообщили о скоростях производства аммиака в диапазоне 7,2–8,2 × 10 –9 моль с –1 см –2 при работе в диапазоне температур 400–800 ° C с помощью Ce 0 . 8 М 0 . 2 O 2 − δ (M = La, Y, Gd, Sm) в качестве электролита и Ag-Pd в качестве электродов. Эти авторы утверждали, что был достигнут 100% фарадеевский КПД.Есть и другие исследования, такие как Wang et al. (2011) с использованием того же типа электрода (Ag-Pd), легированного барием, работающего в диапазоне температур 400–600 ° C со скоростью производства аммиака, как сообщается, в диапазоне 1–5 × 10 –9 моль с. −1 см −2 и с фарадеевской эффективностью 40–50%. Amar et al. (2011) также использовали карбонатно-оксидные композитные электролиты, работающие в диапазоне температур 400–450 ° C, при этом наивысший уровень производства аммиака, как сообщается, составляет 5.39 × 10 −9 моль с −1 см −2 , работа при температуре 450 o C с La 0 . 6 Sr 0 . 4 Fe 0 . 8 Cu 0 . 2 O 3 − δ — Ce 0 . 8 Sm 0 . 2 O 2 − δ композитный катод, NiO-Ce 0 . 8 Sm 0,2 O 2 − δ анод и композит Ce 0,8 Sm 0.2 O 2 − δ Li 2 CO 3 — Na 2 CO 3 -K 2 CO 3 в качестве электролита.
Различные типы полиэлектролитов, используемых для электрохимического синтеза аммиака
Существует четыре основных классификации электролитов, используемых для электрохимического синтеза аммиака, а именно: 1) жидкий электролит, работающий при температуре, близкой к комнатной; 2) расплавы солей, работающие при промежуточных температурах 180–500–– ° С; 3) композитные мембраны, состоящие из обычного твердого электролита, смешанного с легкоплавкой солью, работающие в диапазоне температур 300–700–– ° С; 4) твердотельные электролиты с широким диапазоном рабочих температур от приблизительно температуры окружающей среды до 700-800-— ° C, что зависит от типа используемой электролитной мембраны (Hughes et al., 2015; Байсер и Дайсер, 2018). Эти маршруты производства электролитического аммиака представлены на Рисунке 4 с кратким описанием.
РИСУНОК 4 . Различные способы электролиза для производства аммиака.
Есть несколько проблем, связанных с каталитическим процессом синтеза аммиака, такие как низкая конверсия, сильное загрязнение окружающей среды и высокое потребление энергии. Эти проблемы решаются путем использования технологий электролитического синтеза аммиака (Amar et al., 2011).Существует ряд проблем, связанных с электролитическим синтезом аммиака, таких как низкая производительность (обычно в диапазоне 10 –13 –10 –8 моль с –1 см –2 ), за исключением мембран из полимерного электролита. которые имеют производительность 10 –8 моль с –1 см –2 и проблемы нестабильности кислой электролитической мембраны.
Текущие исследования показывают, что электролитическое восстановление азота с использованием гетерогенных катализаторов оказалось зеленым и устойчивым путем производства аммиака.В этом процессе аммиак синтезируется из воды и азота с использованием возобновляемых источников энергии, таких как солнце / ветер, в условиях окружающей среды. Наиболее важными элементами для производства аммиака с помощью системы электрохимической реакции восстановления азота (NRR), работающей от возобновляемых источников энергии, являются электрокатализаторы. Электрокатализаторы должны быть разработаны для оптимизации массопереноса, физической адсорбции, хемосорбции и переноса электронов и протонов для достижения высокой селективности и каталитических характеристик.Хотя производство аммиака с помощью NRR является многообещающей устойчивой технологией, многие электрокатализаторы для этой системы имеют низкую фарадеевскую эффективность и выход аммиака по сравнению с обычным процессом Габера-Боша (Guo et al., 2019).
Нетепловой плазменный синтез для производства аммиака
Неустойчивость цен на ископаемое топливо, которое является основным сырьем для процесса Габера-Боша, потребность в больших объемах ископаемого топлива для обеспечения процесса и связанные с этим высокие эксплуатационные расходы Благодаря высокому рабочему давлению (150–300 бар) и температуре (400–500 o C) эта технология энергоемкая (Peng et al., 2018). Согласно Peng et al. (2018), все указанные факторы делают текущий процесс производства аммиака непригодным для реализации в небольших и децентрализованных масштабах. Они провели исследование плазменного синтеза аммиака с использованием NTP, который работает при низких температурах (примерно 50 ° C) и давлении примерно 1 атм. Эта технология способна решить некоторые проблемы, связанные с процессом Габера-Боша, такие как высокие капитальные затраты, использование ископаемого топлива и т. Д.Две наиболее важные проблемы этой технологии, как заявили Peng et al. (2018): 1) фиксация газообразного азота и 2) обратные реакции. Кроме того, заявлено, что необходимо улучшить показатели конверсии и эффективности, поскольку эта технология все еще находится на стадии исследований и разработок (доступна в небольших масштабах). Однако преимущества этой системы согласно Peng et al. (2018) заключаются в том, что процесс NMP не требует использования ископаемого топлива, имеет низкие капитальные затраты и занимает мало места.Этот процесс более совместим с распределенным производством аммиака на местных фермах, и с помощью этого метода аммиак можно производить постоянно при атмосферном давлении. Исследовательская корпорация Университета Западной Вирджинии (WVURC) также разрабатывает технологию, известную как WVU. Эта технология превращает возобновляемую электроэнергию, воду и воздух в аммиак посредством возбуждения плазмы (WVU, 2016). В этом процессе цель состоит в том, чтобы снизить рабочие давления и температуры, которые приведут к производству аммиака, в пять раз превышающему степень конверсии процесса Габера-Боша.Согласно WVU (2016), этот метод отличается как от процессов электрохимического преобразования, таких как твердотельный синтез аммиака (SSAS), так и от каталитических процессов, таких как процесс Габера-Боша. В этой форме физической активации процесс СВЧ-плазмы способен активировать как азот, так и водород, а также производить ионы и свободные радикалы, которые реагируют на поверхности катализатора с образованием аммиака. Одно из преимуществ этого процесса состоит в том, что при соответствующих условиях микроволновый нагрев может избирательно нагревать катализатор до достижения требуемой температуры без необходимости проведения реакций и без нагрева окружающей среды.Такое расположение катализатора с высокой температурой в прохладной окружающей среде приводит к более низким общим температурам реакции и повышает энергоэффективность. Кроме того, как указано в WVU (2016), упрощенная конструкция этого процесса связана с его низким рабочим давлением. Низкое рабочее давление этого процесса позволяет ему лучше подходить к возобновляемым источникам энергии, поскольку, как сообщается, систему можно легко включать и выключать.
Нитрогеназный катализатор с пептидными функциональными группами для электрохимического производства аммиака
Аммиак в природе производится с помощью ферментов нитрогеназ с эффективностью примерно 75%.Поскольку эффективность производства аммиака в природе очень высока, электрохимики пытались использовать эти ферменты для промышленных применений синтеза аммиака, например, в исследовании, проведенном Loney et al. (2017). Согласно этому исследованию, электрохимический синтез аммиака является многообещающей технологией, но его низкие рабочие температуры и условия давления показали эффективность менее 1%, что потребовало бы катализатора для повышения эффективности производства аммиака. Кроме того, катализаторы, функционализированные пептидами, были разработаны и испытаны в системе на основе анионообменной мембраны (AEM).Материал, используемый в этом катализаторе, показывает многообещающие результаты по сравнению с традиционными подходами к катализаторам. Шимански и Геллетт (2017) также заявляют, что электрохимические процессы являются модульными и могут сочетаться с возобновляемыми источниками энергии, такими как солнце и ветер, а также могут работать при относительно более низких температурах и давлениях по сравнению с более крупномасштабным традиционным производством аммиака. процессы. Для того, чтобы эта реакция произошла, необходим катализатор, селективный по отношению к производству аммиака.Чтобы решить эту проблему, Шимански и Геллетт (2017) провели технико-экономическое обоснование с целью повышения селективности аммиака путем адаптации морфологии наночастиц катализатора и использования пептидов, полученных из нитрогеназы (естественного фермента, расщепляющего азот), чтобы направить желаемую реакцию. . Гринли и др. (2017) рассмотрели вопросы селективности электрохимического восстановления азота, разработав катализаторы с наночастицами, такие как катализаторы на основе неблагородных металлов, состоящие из железа и никеля, которые являются биметаллическими материалами и, как теоретически прогнозируется, приведут к созданию оптимальных поверхностей для восстановления азота.Гринли и др. (2017) также сообщили, что они могут контролировать локальное поверхностное окружение катализатора с помощью специально структурированного ряда короткоцепочечных пептидов, которые были вдохновлены структурой фермента нитрогеназы.
Воздействие различных процессов производства аммиака на окружающую среду
Оценка жизненного цикла (ОЖЦ) — это основной метод, используемый для поддержки принятия решений в целях устойчивого развития производства. Был проведен ряд исследований по сравнительной оценке жизнеспособности устойчивых путей производства аммиака.Эти исследования включают Bicer et al. (2016) о сравнительной оценке жизненного цикла различных методов производства аммиака и Frattini et al. (2016) о системном подходе к энергетической оценке различных возобновляемых источников энергии, интегрированных в заводы по производству аммиака. Тот же подход (создание LCA) был использован Tallaksen и Reese (2013) и Arora et al. (2018), оба выбрали функциональную единицу из 1 кг аммиака для его производства с использованием ископаемого топлива и возобновляемых источников. Таллаксен и Риз (2013) сравнили оба подхода с точки зрения использования энергии и выбросов углерода.Однако Arora et al. (2018) определили выбросы углерода и затраты, связанные с производством аммиака. Граница системы, проведенная Таллаксеном и Ризом в их исследовании производства аммиака с помощью ветра, включала ветроэнергетику, водный электролизер, сжатие водорода, отделение / сжатие азота, производство аммиака и хранение аммиака (Matzen et al., 2015). Однако граница системы, выбранная Arora et al. поподробнее в сравнении. Arora et al. оценили выбросы в результате добычи угля, сбора биомассы, транспортировки, производства электроэнергии и коммунальных услуг в своем исследовании, а также провели оценку жизненного цикла производства аммиака.Сделан вывод о том, что потенциал глобального потепления (GWP) газификации угля с 4,22 кг CO 2экв. / кг NH 3 является самым высоким по сравнению с газификацией биомассы с 1,2 кг CO 2eq / кг NH 3 , тогда как SMR природный газ находится между ними с ПГП 2,81 кг CO 2eq / кг NH 3 . Однако в этом исследовании газификация угля для производства аммиака была оценена ниже, чем другие обсуждаемые процессы, из-за более низкого энергопотребления, стоимости сырья и отсутствия значительного количества энергии, связанной со сжатием потока диоксида углерода.Махлуф и др. (2015) также провели LCA и представили результаты производства 1 тонны аммиака с помощью SMR природного газа в Алжире. Результаты показали, что GWP является высоким, что связано с объемом выбросов парниковых газов 1,44 т CO 2eq / т NH 3 . Хотя этот показатель (t CO 2eq / т NH 3 ) ниже по сравнению с результатами, представленными Arora et al. (2018) для производства аммиака из природного газа, который, как утверждается, составляет 2,81 т CO 2экв. / т NH 3 ) выбросов парниковых газов.Граница системы для ОЖЦ различается в двух исследованиях. Согласно Makhlouf et al., Граница системы состоит из стадии обогащения и процесса SMR для синтеза аммиака. Кроме того, Махлуф заявил, что при расчете баланса парниковых газов учитывалось только количество природного газа, используемого в качестве топлива, а количество технологического газа не принималось во внимание. Результаты исследования показывают, что потребность в энергии для производства аммиака с помощью SMR природного газа в Алжире была на 25,16% выше, чем в других регионах мира.Сообщается, что эта цифра составляет 51,9 × 10 3 МДж / т аммиака, в то время как глобальные потребности в энергии для производства аммиака, как сообщается, составляют 41,5 × 10 3 МДж / т (IEA, 2007). Арора и др. провели LCA, чтобы сравнить GWP биомассы с процессами производства аммиака в трех различных конфигурациях: SMR, автотермический риформинг (ATR) и риформинг диоксида углерода. Все три конфигурации были смоделированы и сравнены для использования трех различных типов сырья биомассы: соломы, жмыха и древесины, чтобы понять влияние их состава на цепочку поставок, экономику и факторы окружающей среды для производства аммиака.В их исследовании подчеркивается, что ПГП будет снижен, если биомасса будет использоваться в качестве сырья для синтеза аммиака. Среди трех типов биомассы, используемых для синтеза аммиака в исследовании, жмых имеет самый низкий ПГП, за ним следуют древесные и соломенные гранулы. Однако Arora et al. (2017) пришли к выводу, что ПГП соломы, используемой в качестве биомассы для производства аммиака, аналогичен ПГП природного газа для синтеза аммиака при отсутствии когенерации электроэнергии. Среди трех различных типов биомассы древесина имеет самый высокий уровень производства аммиака.Arora et al. (2017) провели многоцелевую оптимизацию (MOO), показав, что одним из способов снижения ПГП биомассы до процесса аммиака может быть использование части синтез-газа, полученного в результате газификации биомассы, который также может быть использован для производства электроэнергии. Благодаря этому решению выбросы парниковых газов при использовании электроэнергии будут снижены. Однако эта стратегия снизит количество производимого аммиака, что приведет к увеличению цены на выпускаемый продукт.Arora et al. сравнили компромисс между производством аммиака и выработкой электроэнергии для трех различных типов сырья, и были получены разные результаты. Все переменные, такие как конкретный тип биомассы, экономика и экологический профиль, коррелируют с конкретным местом. Как сообщалось для производства определенного количества аммиака с использованием того же производственного процесса, количество истощения воды при использовании жмыха выше по сравнению с использованием древесины в качестве сырья. Например, при использовании процесса SMR для производства аммиака количество воды, истощенной посредством жмыха, считается равным 2.95 × 10 –2 м 3 , в то время как древесина составляла 3,3 × 10 –3 м 3 .
Таллаксен и Риз (2013) пришли к выводу, что для производства водорода путем электролиза воды с помощью ветра требуется примерно 60 ГДж электроэнергии на тонну NH 3 . Эта общая энергия значительно выше по сравнению с традиционным производством аммиака на основе ископаемого топлива, которое составляет 36,6 ГДж энергии для производства 1 тонны аммиака. Согласно Таллаксену и Ризу (2013) для этого процесса требуется меньше ископаемой энергии, поскольку система работает с использованием энергии ветра, что приводит к более низким выбросам парниковых газов по сравнению с работой системы от сети, которая, как сообщается, составляет 58.7 ГДж / тонна. Принимая во внимание, что Frattini et al. (2016) пришли к выводу, что производство аммиака из возобновляемых источников энергии повышает надежность поставок. Оба исследования согласны с тем, что производство аммиака из возобновляемых источников энергии приводит к снижению выбросов углекислого газа.
Bicer et al. (2016) провели это исследование четырех различных методов производства аммиака по процессу Габера-Боша с использованием в качестве исходного материала электролитического водорода. Они пришли к выводу: 1) производство аммиака из водного электролизера, работающего на биомассе и бытовых отходах, представляет собой надежную альтернативу распределенным предприятиям по производству аммиака и может увеличить производство удобрений; 2) производство аммиака из городских отходов можно рассматривать как один из наиболее экологически безопасных методов среди предлагаемых процессов, поскольку он имеет самые низкие значения абиотического истощения, глобального потепления и токсичности для человека 3) возобновляемые источники с их повышенной эффективностью способны снизить общее воздействие на окружающую среду и заменить существующие централизованные предприятия по производству аммиака, работающие на ископаемом топливе.Frattini et al. (2016), с другой стороны, сравнили эффективность потоков энергии и выбросов парниковых газов для процесса производства аммиака Haber-Bosch с помощью различных способов производства водорода. В рамках этого исследования они оценили три сценария производства возобновляемого водорода: 1) газификация биомассы, 2) электролиз воды и 3) риформинг биогаза. Они сравнили эти технологии с обычным SMR природного газа. Они пришли к выводу, что аммиак может производиться эффективным способом с использованием возобновляемых источников энергии, что приводит к альтернативному методу распределенного, эффективного и устойчивого процесса производства аммиака.Это приводит к снижению выбросов углекислого газа и затрат, а также к увеличению объемов производства. Более того, этот процесс позволяет хранить возобновляемую энергию в виде сезонного вектора энергии, который имеет высокую плотность энергии с низкими выбросами.
Frattini et al. (2016) четко обосновали преимущества электролитического производства водорода по сравнению с газификацией биомассы / реформированием биогаза в отношении потока энергии каждой системы. Что касается потоков энергии, они пришли к выводу, что все предложенные процессы, включая традиционные методы SMR, имеют одинаковое потребление первичной энергии в диапазоне 14–15 кВтч / кг NH 3 .Новые конфигурации не влияют на количество первичной энергии, используемой для синтеза аммиака. Это демонстрирует, что использование возобновляемых источников энергии не ограничивает эффективность процесса. Они четко обосновали преимущества электролитического производства водорода по сравнению с газификацией биомассы или реформированием биогаза. Оба исследования нацелены на количественную оценку затрат и преимуществ интеграции процесса Хабера-Боша с возобновляемым водородным сырьем, получаемым в результате газификации биомассы, электролиза воды, работающей на солнечной, ветровой, гидроэнергетике, ядерной энергии и биомассе.Таким образом, оба проекта исследовали углеродоемкость производства аммиака. Однако Bicer et al. (2016) расширяет область своих исследований до полного LCA, включая GWP, человеческую токсичность и абиотическое истощение, в то время как исследование, проведенное Frattini et al. (2016) сделали упор в первую очередь на энергоэффективности. С другой стороны, исследование LCA, проведенное Таллаксеном и Ризом (2013), было больше сосредоточено на экологических проблемах, чем на истощении запасов сырья. Другое исследование, проведенное Bicer and Dincer (2018), подчеркивает преимущества использования аммиака в транспорте (легковые автомобили) и на электростанциях, оценивая различные воздействия на окружающую среду, включая: ПГП, подкисление, абиотическое разрушение и разрушение озонового слоя.В этом исследовании аммиак производится с помощью электролиза воды в электрохимическом реакторе с использованием расплавленного солевого электролита, работающего от энергии ветра. Согласно Bicer and Dincer (2018) выбросы парниковых газов для автомобилей, использующих вышеупомянутый аммиак, примерно на 37% ниже по сравнению с автомобилями с бензиновым двигателем. Это также относится к производству около 0,27 кВтч электроэнергии на электростанциях, работающих на аммиаке, по сравнению с электростанциями, работающими на природном газе, что дает примерно на 64% меньше кг CO 2экв. .И Frattini et al. (2016) и Bicer and Dincer (2018) заключают, что производство электролитического водорода для синтеза аммиака выгодно с экологической точки зрения из-за потенциального отсутствия выбросов парниковых газов. Байсер и Динсер (2018) также приводят четкие аргументы в пользу замены обычных видов топлива на безуглеродный аммиак, тем самым значительно сокращая выбросы парниковых газов, связанные с транспортным сектором и производством электроэнергии.
Решение проблем, связанных с существующими возобновляемыми технологиями для производства аммиака
В данном разделе недостаточно исследований по экологическим и экономическим последствиям использования воды при производстве аммиака.
Water Intensity
Было проведено множество исследований по устойчивому производству аммиака и в основном сосредоточено на водных электролизерах, работающих на возобновляемых технологиях, таких как солнечная и ветровая энергия. Эти исследования включают исследование, проведенное Соловейчком (2017), и серию различных процессов, собранную Ван и др. (2018), Service (2018) и Hughes et al. (2015). При оценке потребления воды при производстве аммиака в этих обзорах существует серьезный пробел в исследованиях экологических и экономических аспектов устойчивости.Для работы эти процессы требуют постоянного водоснабжения с учетом последствий все более серьезного мирового водного кризиса. Важнейшими исходными материалами для электролиза являются электричество и деионизированная вода. Как правило, для работы водного электролизера требуется предварительно обработанная вода высокой чистоты (Mehmeti et al., 2018). Причем для производства 1 тонны водорода требуется 9 тонн воды. Основные последствия потребления воды в различных процессах производства водорода и воздействие, связанное с водой на окружающую среду, являются важными факторами, которые были оценены в исследовании, проведенном Mehmeti et al.(2018) с помощью LCA. Исследования, проведенные Alcamo et al. (2007), Distefano и Kelly (2017), Ercin and Hoekstra (2014) и Hoekstra et al. (2011) показали, что в следующие несколько десятилетий произойдет значительный рост нехватки воды, что приведет к проблемам для продовольственной безопасности, экологической устойчивости и экономики. Однако следует отметить, что нехватка воды зависит от наличия на местах. По данным Mehmeti et al. (2018), SMR и электролиз воды наносят наибольший ущерб окружающей среде, поскольку в этих процессах для работы используется вода высокого качества (с низкой концентрацией растворенных твердых веществ / деионизированная вода).Морган (2013) также провел технико-экономическое обоснование установки по производству аммиака, работающей от морского ветра. В исследовании сообщается, что для производства 300 тонн аммиака требуется 476 тонн дистиллированной воды. Соотношение количества очищенной воды на тонну аммиака (без учета воды, необходимой для градирни) составляет примерно 1,6. Этот показатель также сообщается Уиллом и Лукасом (2018) при оценке завода по производству аммиака с использованием электролиза воды, работающего на возобновляемых источниках энергии (солнечной, ветровой и гидроэнергетике).Для установки по производству аммиака производительностью 50 т / сутки требуется мощность 20 МВт, а для установки по производству аммиака мощностью 300 т / сутки требуется 120 МВт. На основании исследования Уилла и Лукаса, потери воды из градирен находятся в диапазоне примерно 1–1,5% от общего количества поступающей воды. Это показывает, что для производства приблизительно 1 тонны аммиака требуется 2,45 тонны воды с учетом количества потерь воды в градирнях. В то время как Уилл и Лукас (2018) сообщают, что часть входящей воды теряется через градирни, при использовании метода оценки воздействия AWARE в LCA вода, используемая для градирен, считается потерей 100%.Согласно исследованию, проведенному Morgan (2013), система опреснения воды включена в его процесс для производства очищенной воды, необходимой для синтеза аммиака. Использование систем опреснения является энергоемким и наносит ущерб биоразнообразию океана и морской жизни (Peterson, 2017). В 2016 году в мире было произведено 146 миллионов тонн аммиака. Исходя из этих данных, для производства того же количества аммиака путем электролиза воды требуется 233,6 миллиона тонн воды.В то время как водный электролизер в сочетании с возобновляемыми технологиями, как обсуждалось выше, требует больших объемов воды для своей работы, обычный процесс производства аммиака, который представляет собой SMR в сочетании с процессами Габера-Боша, также является относительно водоемким, требуя приблизительно 0,656 кг воды для производства 1. т аммиака. Однако эта цифра ниже, чем у вышеупомянутых способов производства аммиака. Таблица 5 показывает, что SMR в сочетании с процессом Haber-Bosch является наиболее углеродоемкой технологией с 1.8 кг CO 2 / т NH 3 по сравнению с другой технологией. Электролиз воды является наиболее водоемким (около 1,588 кг H 2 O / т NH 3 ) и энергоемким (около 12 000 кВт · ч / т NH 3 ) среди рассматриваемых процессов.
ТАБЛИЦА 5 . Основное потребление и выбросы парниковых газов для возобновляемых и традиционных технологий производства аммиака для производства 1 тонны аммиака.
Заключение
Аммиак может играть роль топлива для хранения энергии, а также в качестве основного ингредиента для удобрений, транспортного топлива и многих других применений.Однако необходимы устойчивые маршруты его производства. Поскольку водород является основным сырьем для синтеза аммиака, был проведен обзор различных устойчивых процессов производства водорода и аммиака. Кроме того, была проведена оценка различных исследований экологических показателей производства аммиака с помощью LCA.
Обзор технологий производства аммиака показывает, что существующие процессы являются либо многоступенчатыми, энерго- или углеродоемкими, либо требуют значительных водных ресурсов для работы.Выявление более экологичных путей (с низким содержанием углерода, низким содержанием воды и низким энергопотреблением) для производства аммиака важно для обеспечения продовольственной безопасности и его применения в хранении энергии. После обзора нескольких исследований, кажется, не уделяется должного внимания процессам, направленным на сокращение количества воды, необходимой для устойчивого производства аммиака. Однако существует ряд исследований, в которых оценивается влияние использования воды в различных процессах производства аммиака (SMR и электролиз воды), уделяя особое внимание продовольственной безопасности, экологической устойчивости и экономике посредством проведения LCA.В этом исследовании сравниваются две зрелые технологии, SMR и электролиз воды, обе в сочетании с Haber-Bosch и использующие возобновляемые источники энергии. Первые потребляют меньше воды при более высоких выбросах парниковых газов, а вторые выделяют меньше парниковых газов при более высоком потреблении воды. Конечно, у каждой технологии производства водорода есть свои плюсы и минусы, выбор которых требует различных критериев, которые будут специфичными для конкретного проекта и контекста. Эти критерии включают воздействие на окружающую среду, эффективность, рентабельность, ресурсы и их использование, коммерческую доступность и жизнеспособность, а также варианты интеграции системы (например,g., темное брожение в сочетании с анаэробным сбраживанием), которые необходимо учитывать. Необходимы дополнительные исследования в нескольких ключевых областях исследований производства аммиака путем утилизации отходов, воздействия на окружающую среду использования воды для производства аммиака и мест, где необходимо разместить завод по производству аммиака, как с точки зрения наличия сырья, так и с точки зрения устойчивости (доступность к возобновляемым источникам энергии, таким как солнечная фотоэлектрическая и ветровая энергия, расстояние от центра отходов до производственного предприятия и т. д.). Чтобы четко решить проблему, связанную с уменьшением количества воды в процессах производства аммиака, необходим метаанализ различных технологий и стадий производства аммиака. Эти факторы необходимо учитывать в будущих исследованиях.
Вклад авторов
SG является ведущим автором и MV рецензировал и редактировал рукопись IW рецензировал и редактировал рукопись PS был научным руководителем PhD, рецензировал и редактировал рукопись.
Финансирование
Мы хотим поблагодарить UKRI-BBSRC за финансирование PS по гранту BB / M011917 / 1, Производство возобновляемых удобрений для повышения эффективности сельского хозяйства и предотвращения вреда для окружающей среды.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Глоссарий
AEM Анионообменная мембрана
ATR Автотермический риформинг
CAPEX Капитальные затраты
COD Химическая потребность в кислороде
Агентство по защите окружающей среды EPA Сельскохозяйственная организацияGHG Green House Gas
GWP Потенциал глобального потепления
HHV Высокая теплотворная способность
HTE Высокотемпературный электролиз
LCA Жизненный цикл
Оценка жизненного циклаMOO Оптимизация для нескольких целей
NGASE Паровой электролизер с добавлением природного газа
NTP Нетепловая плазма
OFMSW Органическая фракция твердых бытовых отходов
0004 PEC Фотоэлектрохимические элементы
SGP Производство удельного газа
SHP Производство удельного водорода
SMP Растворимый микробный продукт
SMR Паровой твердый топливный элемент SOFEC4 для реформирования метана
SOFC Твердооксидный топливный элемент
SSAS Твердотельный синтез аммиака
VFA Летучая жирная кислота
Реакция MEC Микробная электролизная ячейка
Микробный электролизный элемент
MFC Микробный топливный элемент NR
ООН Организация Объединенных Наций
WVU Университет Западной Вирджинии
WVURC Исследовательская корпорация Университета Западной Вирджинии
CO 2eq Эквивалент углекислого газа в% (эквивалент углекислого газа Fc) y (%)
люкс Освещенность
VS Летучие твердые вещества
Ссылки
Acar, C., и Динсер, I. (2018). «3.1. Производство водорода »в Комплексные энергетические системы . Редактор И. Динсер (Oshawa: Elsevier), 3–39.
Google Scholar
Акрум-Амруш, Д., Абди, Н., Луничи, Х. и Мамери, Н. (2013). «Производство биоводорода с помощью процессов темноты и фото-ферментации», Международная конференция по возобновляемым и устойчивым источникам энергии (IRSEC), 2013 г., Уарзазат, Марокко, 7–9 марта 2013 г. (IEEE), 499–503.
Google Scholar
Alcamo, J., Flörke, M.и М. Меркер (2007). Будущие долгосрочные изменения мировых водных ресурсов, вызванные социально-экономическими и климатическими изменениями. Hydrological Sci. J. 52 (2), 247–275. doi: 10.1623 / hysj.52.2.247
CrossRef Полный текст | Google Scholar
Али, М., Чжоу, Ф., Чен, К., Коцур, К., Сяо, К., Буржуа, Л. и др. (2016). Наноструктурированный фотоэлектрохимический солнечный элемент для восстановления азота с использованием черного кремния, усиленного плазмонами. Nat. Commun. 7 (11335), 1–5. DOI: 10.1038 / ncomms11335
CrossRef Полный текст | Google Scholar
Amar, I. A., Lan, R., Petit, C. T. G., and Tao, S. (2011). Твердотельный электрохимический синтез аммиака: обзор. J. Solid State Electrochem. 15 (9), 1845–1860. doi: 10.1007 / s10008-011-1376-x
CrossRef Полный текст | Google Scholar
Аргун, Х., Карги Ф. (2010). Производство фотоферментативного газообразного водорода из сточных вод темного брожения измельченного раствора пшеницы: влияние источника света и интенсивности света. Внутр. J. Hydrogen Energ. 35 (4), 1595–1603. doi: 10.1016 / j.ijhydene.2009.12.040
CrossRef Полный текст | Google Scholar
Арора П., Ходли А. Ф., Махаджани С. М. и Ганеш А. (2016). Мелкомасштабное производство аммиака из биомассы: техно-экологическая перспектива. Ind. Eng. Chem. Res. 55, 6422–6434. doi: 10.1016 / j.jclepro.2017.01.148
CrossRef Полный текст | Google Scholar
Арора, П., Ходли, А. Ф. А., Махаджани, С. М., и Ганеш, А.(2017). Многоцелевая оптимизация производства аммиака на основе биомассы — потенциал и перспективы в разных странах. J. Clean. Prod. 148, 363–374. doi: 10.1016 / j.jclepro.2017.01.148
CrossRef Полный текст | Google Scholar
Arora, P., Sharma, I., Hoadley, A., Mahajani, S., and Ganesh, A. (2018). Удаленные, мелкие, «более зеленые» маршруты производства аммиака. J. Clean. Prod. 199, 177–192. doi: 10.1016 / j.jclepro.2018.06.130
CrossRef Полный текст | Google Scholar
Арслан, К., Саттар, А., Чангиинг, Дж., Насир, А., Мари, И. А., и Бахт, М. З. (2015). Влияние интервала регулирования pH на производство биоводорода из органической фракции твердых бытовых отходов путем мезофильного термофильного анаэробного совместного переваривания . Хиндави: BioMed Research International, 1–9.
CrossRef Полный текст
Байсер, Й., и Динсер, И. (2018). Оценка жизненного цикла использования аммиака в городском транспорте и производстве электроэнергии. J. Clean. Prod. 170, 1594–1601.doi: 10.1016 / j.jclepro.2017.09.243
CrossRef Полный текст | Google Scholar
Bicer, Y., Dincer, I., Zamfirescu, C., Vezina, G., and Raso, F. (2016). Сравнительная оценка жизненного цикла различных методов производства аммиака. J. Clean. Prod. 135, 1379–1395. doi: 10.1016 / j.jclepro.2016.07.023
CrossRef Полный текст | Google Scholar
Bicer, Y. (2017). Исследование новых вариантов производства аммиака с использованием фотоэлектрохимического водорода. Кандидатская диссертация. Ошава: Технологический факультет Технологического института Онтарио, факультет инженерии и прикладных наук.
Google Scholar
Bolzonella, D., Battista, F., Cavinato, C., Gottardo, M., Micolucci, F., Lyberatos, G., et al. (2018). Последние разработки в области производства биогитана из бытовых пищевых отходов: обзор. Биоресурсы. Technol. 257, 311–319. doi: 10.1016 / j.biortech.2018.02.092
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Chong, M.-L., Sabaratnam, V., Shirai, Y., and Hassan, M.A. (2009). Производство биоводорода из биомассы и промышленных отходов путем темного брожения. Внутр. J. Hydrogen Energ. 34, 3277–3287. doi: 10.1016 / j.ijhydene.2009.02.010
CrossRef Полный текст | Google Scholar
Chu, C.F., Li, Y.Y., Xu, K.Q., Ebie, Y., Inamori, Y., и Kong, H.N. (2008). Двухступенчатый процесс получения водорода и метана из пищевых отходов с изменением температуры и pH. Внутр. J. Hydrog. Энергия. 33, 4739–4746.
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ciranna, A. (2014). Производство биоводорода в экстремальных условиях: комплексное исследование ферментативного метаболизма полиэстремофильных бактерий диссертация .Тампере: Технологический университет Тампере, 220.
Cong, L., Yu, Z., Liu, F., and Huang, W. (2019). Электрохимический синтез аммиака из N2 и h3O с использованием типичного катализатора на основе углерода неблагородного металла в условиях окружающей среды. Catal. Sci. Technol. 9, 1208–1214. doi: 10.1039 / c8cy02316f
CrossRef Полный текст | Google Scholar
De Gioannis, G., Muntoni, A., Polettini, A., and Pomi, R. (2013). Обзор производства темного ферментативного водорода из биоразлагаемых фракций городских отходов. Управление отходами. 33, 1345–1361. doi: 10.1016 / j.wasman.2013.02.019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Динсер, И. и Байсер, Ю. (2018). «3.2 Производство аммиака» в Комплексные энергетические системы . Редактор И. Динсер (Oshawa: Elsevier), 42–82.
Google Scholar
Дистефано, Т., и Келли, С. (2017). Мы на глубине? Нехватка воды и ее пределы для экономического роста. Ecol. Экон. 142, 130–147. DOI: 10.1016 / j.ecolecon.2017.06.019
CrossRef Полный текст | Google Scholar
Elgowainy, A. (2015). Анализ жизненного цикла потребления воды для производства водорода. Арлингтон: Ежегодный обзор достоинств и отчет коллегиальной оценки, 8–12.
Google Scholar
Frattini, D., Cinti, G., Bidini, G., Desideri, U., Cioffi, R., and Jannelli, E. (2016). Системный подход в энергетической оценке интеграции различных возобновляемых источников энергии на предприятиях по производству аммиака. Обновить.Energ. 99, 472–482. doi: 10.1016 / j.renene.2016.07.040
CrossRef Полный текст | Google Scholar
Garagounis, I., Kyriakou, V., Skodra, A., Vasileiou, E., and Stoukides, M. (2014). Электрохимический синтез аммиака в ячейках с твердым электролитом. Фронт. Energ. Res. 2, 1–10. doi: 10.3389 / fenrg.2014.00001
CrossRef Полный текст | Google Scholar
Ghimire, A., Frunzo, L., Pirozzi, F., Trably, E., Escudie, R., Lens, P. N. L., et al. (2015). Обзор производства темного ферментативного биоводорода из органической биомассы: параметры процесса и использование побочных продуктов. Заявл. Energ. 144, 73–95. doi: 10.1016 / j.apenergy.2015.01.045
CrossRef Полный текст | Google Scholar
Гидди, С., Бадвал, С. П. С. и Кулкарни, А. (2013). Обзор технологий и материалов электрохимического производства аммиака. Внутр. J. Hydrogen Energ. 38 (34), 14576–14594. doi: 10.1016 / j.ijhydene.2013.09.054
CrossRef Полный текст | Google Scholar
Greenlee, L., Foster, S., Acharya, P., Suttmiller, D., Loney, C., Renner, J., et al.(2017). «Тематическая конференция: Nh4 Energy» на ежегодном собрании AIChE, Миннеаполис, 29 октября — 3 ноября 2017 г.
Google Scholar
Guerra, CF, Reyes-Bozo, L., Vyhmeister, E., Caparros, MJ, Salazar , JL, и Клементе-Джуль, C. (2020). Технико-экономический анализ завода по производству зеленого аммиака в Чили и его последующая транспортировка в Японию. Обновить. Energ. 157, 404–414. doi: 10.1016 / j.renene.2020.05.041
CrossRef Полный текст | Google Scholar
Guo, X., Ду, Х., Ку, Ф., и Ли, Дж. (2019). Недавний прогресс в электрокаталитическом восстановлении азота. J. Mater. Chem. А. 7, 3531–3543. doi: 10.1039 / c8ta11201k
CrossRef Полный текст | Google Scholar
Hawkes, F., Hussy, I., Kyazze, G., Dinsdale, R., and Hawkes, D. (2007). Непрерывное темное ферментативное производство водорода мезофильной микрофлорой: принципы и прогресс. Внутр. J. Hydrogen Energ. 32, 172–184. doi: 10.1016 / j.ijhydene.2006.08.014
CrossRef Полный текст | Google Scholar
Hoekstra, A.Ю., Чапагейн, А. К., Алдая, М. М., и Меконнен, М. М. (2011). Руководство по оценке водного следа, устанавливающее международный стандарт . Лондон, Великобритания: Earthscan.
Hughes, T., Wilkinson, I., Tsang, E., McPherson, I., Sudmeier, T., Fellowes, J., et al. (2015). Зеленый аммиак. Кардифф: СИМЕНС. Доступно по адресу: http://businessdocbox.com/73271609-Green_Solutions/Green-ammonia-september-2015.html (по состоянию на 20 июня 2020 г.).
Google Scholar
Капдан, И. К., и Карги, Ф.(2006). Производство био-водорода из отходов. Enzyme Microb. Technol. 38, 569–582. doi: 10.1016 / j.enzmictec.2005.09.015
CrossRef Полный текст | Google Scholar
Kataoka, N., Ayame, S., Miya, A., Ueno, Y., Oshita, N., Tsukahara, K., et al. (2005). «Исследования процесса водородно-метановой ферментации для обработки мусора и макулатуры», ADSW 2005 Conference Proceedings. (Копенгаген, Дания: Технологический инжиниринг), 2.
CrossRef Полный текст | Google Scholar
Кордали, В., Kyriacou, G., и Lambrou, C. (2000). Электрохимический синтез аммиака при атмосферном давлении и низкой температуре в ячейке с твердым полимерным электролитом. Chem. Commun. 17, 1673–1674. doi: 10.1039 / b004885m
CrossRef Полный текст | Google Scholar
Котари Р., Кумар В., Патак В. В., Ахмад С., Аойи О. и Тьяги В. В. (2017). Критический обзор факторов, влияющих на производство ферментативного водорода. Фронт. Biosci. 22, 1195–1220. doi: 10.2741 / 4542
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Lan, R., Ирвин, Дж. Т., и Тао, С. (2013). Синтез аммиака непосредственно из воздуха и воды при температуре и давлении окружающей среды. Scientific Rep. 3 (1145), 1–7. doi: 10.1038 / srep01145
CrossRef Полный текст | Google Scholar
Lapina, A., Holtappels, P., and Mogensen, M. B. (2013). Электролиты и электроды для электрохимического синтеза аммиака. Кандидатская диссертация. Kongens Lyngby: Департамент преобразования и хранения энергии, Технический университет Дании.
Google Scholar
Ли, З.-K., Li, S.-L., Kuo, P.-C., Chen, I.-C, Tien, Y.-M., Huang, Y.-J., et al. (2010). Исследование термофильного биоэнергетического процесса водородного брожения с овощными кухонными отходами. Внутр. J. Hydrog. Энергия. 35 (24), 13458–13466.
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Liu, B.-F., Ren, N.-Q., Xing, D.-F., Ding, J., Zheng, G.-X., Guo, W.-Q., et. al. (2009). Производство водорода иммобилизованным R. faecalis RLD-53 с использованием растворимых метаболитов из бактерий, ферментирующих этанол E.harbinense B49. Биоресурсы. Technol. 100, 2719–2723. doi: 10.1016 / j.biortech.2008.12.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю Д., Ангелидаки И., Цзэн Р. Дж. И Мин Б. (2008). Производство био-водорода путем темного брожения из органических отходов и остатков. Кандидатская диссертация. Kongens Lyngby: Департамент преобразования и хранения энергии, Технический университет Дании.
Google Scholar
Лю, Р., Се, Ю., Ван, Дж., Ли, З.и Ван Б. (2006). Синтез аммиака при атмосферном давлении с Ce0.8M0.2O2 − δ (M = La, Y, Gd, Sm) и их протонная проводимость при промежуточной температуре. Ионика твердого тела 177, 73–76. doi: 10.1016 / j.ssi.2005.07.018
CrossRef Полный текст | Google Scholar
Loney, C., Graybill, A., Xu, C., Renner, J., Acharya, P., Suttmiller, D., et al. (2017). «Nh4 Energy + Изучение пептидно-связанных катализаторов для электрохимического производства аммиака», на ежегодном собрании AIChE, тематической конференции, Миннеаполис, 29 октября — 3 ноября 2017 г.
Google Scholar
Луо, Й., Ши, Й., Ли, В., Ни, М., и Цай, Н. (2014). Моделирование элементарных реакций и экспериментальная характеристика паровых электролизеров на твердом оксидном топливе. Внутр. J. Hydrogen Energ. 39, 10359–10373. doi: 10.1016 / j.ijhydene.2014.05.018
CrossRef Полный текст | Google Scholar
Makhlouf, A., Serradj, T., and Cheniti, H. (2015). Оценка воздействия жизненного цикла производства аммиака в Алжире: сравнение с предыдущими исследованиями. Environ. Оценка воздействия. Ред. 50, 35–41. doi: 10.1016 / j.eiar.2014.08.003
CrossRef Полный текст | Google Scholar
Марнеллос, Г., Зисекас, С., и Стоукидес, М. (2000). Синтез аммиака при атмосферном давлении с использованием твердотельных протонных проводников. J. Catal. 193, 80–87. doi: 10.1006 / jcat.2000.2877
CrossRef Полный текст | Google Scholar
Маррони, М. (2015). Протонопроводящая керамика: от основ к прикладным исследованиям .Сингапур: Pan Stanford Publishing Pte. Ltd.
CrossRef Полный текст
Мартинес-Фриас, Дж., Фам, А. К., и Асевес, М. (2003). Паровой электролизер на природном газе для высокоэффективного производства водорода. Внутр. J. Hydrogen Energ. 28, 483–490. doi: 10.1016 / s0360-3199 (02) 00135-0
CrossRef Полный текст | Google Scholar
Мацен, М. Дж., Альхаджи, М. Х. и Демирель, Ю. (2015). Техникоэкономика и устойчивость производства метанола и аммиака из возобновляемых источников с использованием водорода на основе энергии ветра. Adv. Chem. Англ. 5 (3), 1–12. doi: 10.4172 / 2090-4568.1000128
CrossRef Полный текст | Google Scholar
Mehmeti, A., Dimakis, A. A., Arampatzis, G., McPhail, S.J., and Ulgiati, S. (2018). Оценка жизненного цикла и водный след методов производства водорода: от традиционных к новейшим технологиям. Окружающая среда 5, 1–19. doi: 10.3390 / environment5020024
CrossRef Полный текст | Google Scholar
Michael, M., Alhajji, M., and Demirel, Y.(2015). Техникоэкономика и устойчивость производства возобновляемого метанола и аммиака с использованием водорода на основе ветроэнергетики. Adv. Chem. Англ. 5 (3), 1–12. doi: 10.4172 / 2090-4568.1000128
CrossRef Полный текст | Google Scholar
Micolucci, F., Gottardo, M., Pavan, P., Cavinato, C., and Bolzonella, D. (2018). Сравнение пилотного масштаба одно- и двухступенчатого термофильного анаэробного сбраживания пищевых отходов. J. Clean. Prod. 171, 1376–1385. DOI: 10.1016 / j.jclepro.2017.10.080
CrossRef Полный текст | Google Scholar
Morgan, E. R., Manwell, J. F., and McGowan, J. G. (2017). Устойчивое производство аммиака на оффшорных ветряных электростанциях США: технико-экономический обзор. ACS Sustain. Chem. Англ. 5, 9554–9567. doi: 10.1021 / acssuschemeng.7b02070
CrossRef Полный текст | Google Scholar
Морган, Э. Р. (2013). Технико-экономическое обоснование аммиачных заводов с использованием морского ветра. Кандидатская диссертация. Амхерст: Массачусетский университет в Амхерсте.
Google Scholar
Parkinson, B., Tabatabaei, M., Upham, D. C., Ballinger, B., Greig, C., Smart, S., et al. (2018). Производство водорода с использованием метана: технико-экономические аспекты обезуглероживания топлива и химикатов. Внутр. J. Hydrogen Energ. 43, 2540–2555. doi: 10.1016 / j.ijhydene.2017.12.081
CrossRef Полный текст | Google Scholar
Peng, P., Chen, P., Schiappacasse, C., Zhou, N., Anderson, E., Chen, D., et al. (2018). Обзор нетепловых плазменных технологий синтеза аммиака. J. Clean. Prod. 177, 597–609. doi: 10.1016 / j.jclepro.2017.12.229
CrossRef Полный текст | Google Scholar
Pengyu, D., Lianhua, L., Feng, Z., Xiaoying, K., Yongming, S., and Yi, Z. (2017). Сравнение методов предварительной обработки сухого и мокрого помола для улучшения анаэробного переваривания гибрида Pennisetum. R. Soc. Chem. (Rsc) 7, 12610–12619. doi: 10.1039 / C6RA27822A
CrossRef Полный текст | Google Scholar
Pfromm, P.H.(2017). На пути к устойчивому сельскому хозяйству: аммиак без ископаемых. J. Renew. Поддерживать. Energ. 9, 1–20. doi: 10.1063 / 1.4985090
CrossRef Полный текст | Google Scholar
Pham, A. Q., Wallman, H., and Glass, R. S. (2000). Электролизер с паром на природном газе . Патент США 6051125.
CrossRef Полный текст
Редди, К. (2016). Оценка потенциала производства биогидрогена из жома сахарного тростника с использованием активного ила в процессе темной ферментации.Магистерская диссертация. Дурбан: Технологический университет Дурбана (DUT).
Google Scholar
Сен, У., Шакдвипи, М., и Банерджи, Р. (2008). Состояние производства биоводорода. J. Scientific Ind. Res. 67 (11), 980–993.
Google Scholar
Сингх А., Севда С., Абу Риш И., Ванброекховен К., Ратор Д. и Пант Д. (2015). Производство биоводорода из лигноцеллюлозной биомассы: технология и устойчивость. Энергия 8, 13062–13080. DOI: 10.3390 / en81112357
CrossRef Полный текст | Google Scholar
Skodra, A., and Stoukides, M. (2009). Электрокаталитический синтез аммиака из пара и азота при атмосферном давлении. Ионика твердого тела 180 (23-25), 1332–1336. doi: 10.1016 / j.ssi.2009.08.001
CrossRef Полный текст | Google Scholar
Соловейчик, Г. (2017a). «Nh4 Energy Будущее производства аммиака: усовершенствование процесса Хабер-Бош или электрохимический синтез?» В Тематической конференции: ежегодное собрание AIChE, Миннеаполис, 29 октября — 3 ноября 2017 г.
Google Scholar
Шимански, С., и Геллетт, В. (2017). «Катализатор с пептидами, функционализированный нитрогеназой, для эффективного производства аммиака без выбросов», на 14-й ежегодной конференции по топливу Nh4, ежегодное собрание AIChe. Тематическая конференция: Nh4 Energy, Миннеаполис, 1 ноября 2017 г. (Nh4 Fuel Association).
Google Scholar
Таллаксен, Дж. И Риз, М. (2013). «Производство аммиака с использованием энергии ветра: ранний расчет выбросов углерода в течение жизненного цикла и потребления ископаемой энергии», в 10-й ежегодной конференции по топливу Nh4 Ежегодная конференция по топливу Nh4.Сакраменто, 23 сентября 2013 г. (Топливная ассоциация Nh4).
Google Scholar
Tapia-Venegas, E., Ramirez-Morales, J. E., Silva-Illanes, F., Toledo-Alarcón, J., Paillet, F., Escudie, R., et al. (2015). Производство биоводорода путем темного брожения: масштабирование и интеграция технологий для создания устойчивой системы. Rev. Environ. Sci. Biotechnol. 14, 761–785. doi: 10.1007 / s11157-015-9383-5
CrossRef Полный текст | Google Scholar
Valdez-Vazquez, I., and Poggi-Varaldo, H.М. (2009). Производство водорода ферментативными консорциумами. Обновить. Поддерживать. Energ. Ред. 13, 1000–1013. doi: 10.1016 / j.rser.2008.03.003
CrossRef Полный текст | Google Scholar
Wang, L., Xia, M., Wang, H., Huang, K., Qian, C., and Maravelias, C. T. (2018). Экологизация аммиака в сторону солнечного аммиачного завода. Джоуль 2 (6), 1–20. doi: 10.1016 / j.joule.2018.04.017
CrossRef Полный текст | Google Scholar
Wang, X., Yin, J., Xu, J., Wang, H., и Ма, Г. (2011). Химическая стабильность, ионная проводимость BaCe0.9 − xZrxSm0.10O3 − α и его применение для синтеза аммиака при атмосферном давлении. Подбородок. J. Chem. 29, 1114–1118. doi: 10.1002 / cjoc.2011
CrossRef Полный текст | Google Scholar
Уилл М. и Лукас Л. (2018). Представление возобновляемого аммиака от Thyssenkrupp . Роттердам, Нидерланды: NH 3 Event, 17–18.
Уилсон, И.А.Г., и Стайринг, П. (2017). Почему синтетическое топливо необходимо в энергетических системах будущего. Фронт. Energ. Res. 5, 1–10.doi: 10.3389 / fenrg.2017.00019
CrossRef Полный текст | Google Scholar
Xu, G., Liu, R., and Wang, J. (2009). Электрохимический синтез аммиака с использованием ячейки с мембраной Nafion и катодом SmFe0,7Cu0,3 − x Ni x O3 (x = 0−0,3) при атмосферном давлении и более низкой температуре. Sci. China Ser. B-Chem. 52, 1171–1175. doi: 10.1007 / s11426-009-0135-7
CrossRef Полный текст | Google Scholar
Yoo, C.Y., Joo, J.H., Jang, S.Y., Yu, J.H., Jeong, H.N., Hyeong, C.H. и др. (2013). Электрохимический синтез аммиака из воды и азота с использованием твердотельных ионных проводников . Sacramento: Ammonia Energy Association .
Зилуйе, Х., Тахерданак, М. (2015). «Биоводород из лигноцеллюлозных отходов» в Технологии биотоплива и биопереработки .Редактор К. Карими (Швейцария: Springer), 253–288.
Google Scholar
Введение в производство аммиака | AIChE
Аммиак имеет решающее значение при производстве удобрений и является одним из крупнейших синтетических химикатов, производимых в мире. В этой статье исследуется эволюция производства аммиака и описываются современные производственные технологии.
У большинства людей резкий запах аммиака (NH 3 ) ассоциируется с чистящими средствами или нюхательными солями.Однако использование аммиака в этих двух продуктах составляет лишь небольшую долю от общего мирового производства аммиака, которое в 2014 году составляло около 176 миллионов метрических тонн (1) . Чтобы оценить, где сегодня находятся промышленность и технологии, давайте сначала посмотрим, как мы к этому пришли.
Аммиак известен более 200 лет. Джозеф Пристли, английский химик, впервые выделил газообразный аммиак в 1774 году. Его состав был установлен французским химиком Клодом Луи Бертолле в 1785 году.В 1898 году Адольф Франк и Никодем Каро обнаружили, что N 2 может быть закреплен карбидом кальция с образованием цианамида кальция, который затем может быть гидролизован водой с образованием аммиака (2) :
CaO + 3C ↔ CaC 2 + CO
CaC 2 + N 2 ↔ CaCN 2 + C
CaCN 2 + 3H 2 O ↔ CaCO 3 + 2NH 3
Производство значительных объемов аммиака с использованием цианамидного процесса не происходило до начала 20-го века.Поскольку этот процесс требовал большого количества энергии, ученые сосредоточили свои усилия на сокращении потребности в энергии.Немецкий химик Фриц Габер выполнил некоторые из важнейших работ в развитии современной аммиачной промышленности. Работа со студентом в Univ. Карлсруэ, он синтезировал аммиак в лаборатории из N 2 и H 2 .
Тем временем Вальтер Нернст, профессор физической химии Univ. of Berlin, разработала процесс получения аммиака путем пропускания смеси N 2 и H 2 через железный катализатор при 1000 ° C и давлении 75 бар изб.Он смог произвести большее количество аммиака при этом давлении, чем более ранние эксперименты Габера и других при атмосферном давлении. Однако Нернст пришел к выводу, что этот процесс неосуществим, потому что было трудно или почти невозможно (в то время) производить большое оборудование, способное работать при таком давлении.
Тем не менее, и Хабер, и Нернст использовали путь высокого давления для производства аммиака на катализаторе. Наконец, Габер разработал способ производства аммиака в промышленных количествах, и в 1906 году ему удалось достичь концентрации аммиака 6% в реакторе, загруженном осмиевым катализатором.Это общепризнано как поворотный момент в разработке практического процесса производства аммиака в промышленных количествах.
Хабер понял, что количество аммиака, образующегося за один проход через конвертер, слишком мало, чтобы представлять коммерческий интерес. Чтобы производить больше аммиака из подпиточного газа, он предложил систему рециркуляции и получил патент на эту концепцию. Идея рециркуляции Хабера изменила восприятие технологического процесса как статичного в пользу более динамичного подхода.Помимо равновесия химической реакции, Габер признал, что определяющим фактором была скорость реакции. Вместо простого выхода в прямоточном процессе он сосредоточился на пространственно-временном выходе в системе с рециркуляцией.
Компания BASF приобрела патенты Хабера и начала разработку коммерческого процесса. После испытаний более 2500 различных катализаторов Карл Бош, Элвин Митташ и другие химики BASF в 1910 году разработали катализатор с активированным железом для производства аммиака. Разработка оборудования, способного выдерживать необходимые высокие температуры и давление, была еще более сложной задачей.Первый реактор из мягкой стали проработал всего 80 часов до отказа из-за декарбонизации. Футеровка реакторов из мягкой стали мягким чугуном (которое не было подвержено обезуглероживанию) и добавление канавок между двумя вкладышами для выпуска водорода, который диффундировал через гильзу из мягкого железа, решило эту проблему. Другие основные проблемы включали разработку теплообменника для доведения входящего газа до температуры реакции и охлаждения выходящего газа, а также разработку метода доведения катализатора до температуры реакции.
Первая промышленная установка по производству аммиака, основанная на процессе Габера-Боша, была построена BASF в Оппау, Германия. Завод был введен в эксплуатацию 9 сентября 1913 года, его производственная мощность составляла 30 тонн в сутки.
▲ Рис. 1. Это упрощенная технологическая схема первого промышленного аммиачного завода BASF.
На рис. 1 представлена технологическая схема первого завода по производству аммиака. Реактор содержал внутренний теплообменник в дополнение к теплообменникам, показанным на схеме.
Мировые темпы производства
▲ Рисунок 2. Мировое производство аммиака неуклонно росло с 1946 по 2014 год.
Производство аммиака стало одной из самых важных отраслей в мире. Без аммиачных удобрений и химикатов урожайность сельскохозяйственных культур была бы по крайней мере на два-три миллиарда меньше, чем сегодня. Производство аммиака неуклонно росло с 1946 года (рис. 2), и, по оценкам, годовое производство аммиака составляет более 100 миллиардов долларов, при этом некоторые заводы производят более 3000 кубометров.т. / сут. NH 3 .
В 1983 году по случаю 75-летия основания AIChE группа выдающихся инженеров-химиков с голубой лентой назвала то, что они считали десятью величайшими достижениями химической инженерии в мире: (4) . Цитата, охватывающая такие подвиги, как чудодейственные лекарства, синтетические волокна и атомная энергия, также включала прорыв, который позволил производить большие количества аммиака на компактных, единичных установках.
За последние десятилетия инженерам-химикам удалось создать процессы, позволяющие производить огромное количество аммиака при относительно низких затратах.Еще 80 лет назад общее годовое производство синтезированного аммиака составляло чуть более 300 000 мт. Благодаря достижениям химического машиностроения один современный завод по производству аммиака может производить более 750 000 тонн в год.
Примерно 88% аммиака, производимого ежегодно, расходуется на производство удобрений. Большая часть остатка идет на производство формальдегида. В 2014 году Китай произвел около 32,6% мирового производства, в то время как Россия, Индия и США произвели 8,1%, 7,6% и 6%.4%, соответственно (1) . В то время как большая часть мирового производства аммиака основана на паровой конверсии природного газа, значительные его объемы производятся путем газификации угля; большинство заводов по газификации расположены в Китае.
Современные производственные процессы
Колоссальный рост спроса на аммиак с 1950 по 1980 год потребовал более крупных и более энергоэффективных заводов. В те десятилетия также произошли изменения в философии дизайна. До этого аммиачный завод рассматривался как совокупность не связанных между собой единиц, таких как подготовка газа, очистка газа, сжатие газа и синтез аммиака.Новые инновации и единый дизайн связали технологические единицы вместе наиболее эффективным и действенным образом.
▲ Рис. 3. KBR спроектировал один из первых однопоточных крупнотоннажных аммиачных заводов.
В середине 1960-х годов компания American Oil Co. установила аммиачную установку с одним конвертером, спроектированную М. В. Келлогом (MWK) в Техас-Сити, штат Техас, производительностью 544 метрических тонн в день. Концепция дизайна с одним поездом (рис.3) была настолько революционной, что в 1967 году получила награду Kirkpatrick Chemical Engineering Achievement Award.
На заводе использовался четырехкамерный центробежный компрессор для сжатия синтез-газа до давления 152 бар, а окончательное сжатие до рабочего давления 324 бар происходило в поршневом компрессоре. Были также внедрены центробежные компрессоры для контура синтеза и холодоснабжения, что обеспечило значительную экономию средств.
Ключевые различия между процессом MWK и процессами, использовавшимися на предыдущих заводах по производству аммиака, включали:
- с использованием центробежного компрессора как части сжатия синтез-газа
- максимальное использование отработанного тепла процесса
- производство пара из отходящее тепло для использования в приводах паровых турбин
- с использованием холодильного компрессора для останова и атмосферного охлаждения.
Интегрированная схема, которая сбалансировала потребление энергии, производство энергии, размер оборудования и объемы катализатора, была внедрена по всему предприятию.
Большинство заводов, построенных в период с 1963 по 1993 год, имели крупногабаритную однорядную конструкцию с производством синтез-газа при 25–35 бар и синтезом аммиака при 150–200 бар. Другой вариант от Braun (ныне KBR) предлагал небольшие модификации базовой конструкции. В технологических установках очистителя Braun используется установка первичного или трубчатого риформинга с низкой выходной температурой и высокой утечкой метана, чтобы уменьшить размер и стоимость установки риформинга.Избыточный воздух был добавлен в установку вторичного риформинга, чтобы снизить содержание метана в выходящем потоке установки первичного риформинга до 1-2%. Избыточный азот и другие примеси удаляли после метанатора. Поскольку синтез-газ практически не содержал примесей, для достижения высокой конверсии аммиака использовались два конвертера аммиака с осевым потоком.
Некоторые недавно построенные заводы имеют систему производства синтез-газа только с одной установкой риформинга (без вторичной установки риформинга), систему адсорбции при переменном давлении (PSA) для извлечения H 2 и установку разделения воздуха в качестве источника N 2 .Усовершенствования конструкции конвертера, такие как радиальные и горизонтальные слои катализатора, внутренние теплообменники и обработка синтез-газа, помогли увеличить концентрацию аммиака на выходе из конвертера синтеза с примерно 12% до 19–21%. Более высокая конверсия за проход, а также более эффективные турбины и компрессоры еще больше снизили потребление энергии. Более эффективные растворы для удаления CO 2 , такие как карбонат калия и метилдиэтаноламин (MDEA), способствовали повышению энергоэффективности.Большинство современных заводов могут производить аммиак с потреблением энергии 28 ГДж / т.
В дополнение к конструктивным, механическим и металлургическим усовершенствованиям, сделанным за это время, было значительно снижено рабочее давление в контуре синтеза. Когда в 1960-х годах была построена первая однорядная установка, в ней был контур синтеза высокого давления. В 1962 году компания MWK получила запрос от Imperial Chemical Industries (ICI) с предложением построить завод производительностью 544 метра в сутки на их территории в Севернсайде.MWK предложила синтезирующую петлю из 152 тактов вместо 324-тактовой петли.
Поскольку разработка кинетических данных для реакции аммиака при давлении 152 бар потребует больше времени, чем у MWK, чтобы ответить на запрос ICI, они связались с Хальдором Топсе, чтобы поддержать свои планы. Топсе располагал данными, охватывающими весь диапазон давлений, интересующий MWK. Кроме того, у них была компьютерная программа для расчета количества катализатора, необходимого при более низком рабочем давлении. Несмотря на то, что ICI выбрала Bechtel для проектирования завода, MWK удалось разработать технологическую схему для 544-метровой установки.т. / день с центробежными компрессорами и контуром синтеза низкого давления, что некоторые люди считают самым важным событием в развитии однопоточной аммиачной установки.
При давлении 152 бар требовалось примерно вдвое больше катализатора, чем при 324 бар, что казалось экономически целесообразным. Хотя конвертеру потребуется вдвое больший объем, более низкое рабочее давление уменьшит требуемую толщину кожуха высокого давления. В результате масса металла, необходимого для конвертера, плюс катализатор, осталась примерно такой же.Контур синтеза низкого давления также позволил использовать центробежные компрессоры вместо поршневых компрессоров. Еще одним усовершенствованием была рекуперация тепла для производства пара высокого давления для приводов паровых турбин.
Проектирование заводов в 21 веке
В течение первых нескольких лет 21 века в технологии производства аммиака было внесено множество усовершенствований, которые позволяют существующим заводам увеличивать производительность и строить новые заводы с все большей и большей производительностью.Конкуренция между поставщиками технологий довольно жесткая. В настоящее время на рынке доминируют три лицензиара технологий — KBR (Kellogg Brown and Root), Haldor Topsøe и ThyssenKrupp Industrial Solutions (TKIS). Компания Ammonia Casale, предлагающая аксиально-радиальную конструкцию слоя катализатора, является лидером на рынке модернизации существующих заводов.
▲ Рис. 4. В современных установках по производству аммиака, спроектированных KBR, используются очистители собственной разработки.
В большинстве установок по производству аммиака, недавно спроектированных KBR, используется процесс очистки (рис. 4), который сочетает в себе риформинг с низкой степенью жесткости в установке первичного риформинга и промывной очиститель жидкого N 2 после метанатора для удаления примесей и регулирования H 2 : N 2 , собственная конструкция котла-утилизатора, блочный чиллер и горизонтальный конвертер синтеза аммиака.
В зависимости от конфигурации установки потребление энергии может составлять всего 28 ГДж / м.т. Поскольку установка вторичного риформинга использует избыточный воздух, установка первичного риформинга может быть меньше, чем в обычных конструкциях. Криогенный очиститель (показан на Рисунке 4 светло-зеленым на светло-оранжевом фоне), который состоит из расширителя, конденсатора, теплообменника подачи / отходящего потока и ректификационной колонны, удаляет примеси, такие как CO, CH 4 и аргон, из синтез-газ при доведении соотношения H 2 : N 2 подпиточного газа в аммиачном контуре до оптимального уровня.Концентрация аммиака на выходе из горизонтального конвертера с низким перепадом давления составляет 20–21%, что снижает потребность в энергии для рециркуляционного компрессора. KBR также предлагает аммиачный контур низкого давления, в котором используется комбинация магнетитового катализатора и запатентованного рутениевого катализатора.
▲ Рис. 5. Haldor Topsøe предлагает конструкцию аммиачной установки, которая имеет запатентованную установку риформинга с боковым сжиганием, в которой лучистые горелки подают тепло для реакции риформинга.
Секция производства синтез-газа (или передняя часть) установки, спроектированной Haldor Topsøe (рис. 5), довольно традиционна, за исключением ее собственной установки риформинга с боковым сжиганием, в которой для подачи тепла на реакцию риформинга используются лучистые горелки.Haldor Topsøe также предлагает запатентованный катализатор синтеза на основе железа, преобразователи радиального потока, состоящие из одного, двух или трех слоев, и запатентованный бойлер-утилизатор с байонетными трубами. Более поздние разработки включают конструкции преобразователя С-300 и С-350. Конвертер S-300 представляет собой трехслойную конфигурацию с радиальным потоком и внутренними теплообменниками, а конструкция S-350 сочетает преобразователь S-300 с однослойной конструкцией S-50 с рекуперацией отходящего тепла между конвертерами для максимального использования аммиака. конверсия.
▲ Рис. 6. Конструкция контура синтеза с двойным давлением ThyssenKrupp включает прямоточный реактор между компрессорами синтез-газа.
ThyssenKrupp предлагает традиционную установку (рис. 6) с уникальной конструкцией вторичного риформинга, запатентованный котел-утилизатор, радиальные преобразователи потока и контур синтеза аммиака двойного давления. Сегодня производительность 3300 т / сутки может быть достигнута с использованием процесса двойного давления TKIS.
▲ Рис. 7. Linde Ammonia Concept (LAC) включает установку адсорбции с переменным давлением для производства водорода высокой чистоты и установку разделения воздуха для производства азота высокой чистоты.
Linde Ammonia Concept (LAC) — это устоявшаяся технологическая схема процесса с более чем 25-летним опытом эксплуатации на заводах с производительностью от 200 до 1750 тонн в день. В технологической схеме LAC (рис. 7) дорогостоящая и сложная передняя часть обычной аммиачной установки заменяется двумя хорошо зарекомендовавшими себя и надежными технологическими установками:
- производство водорода сверхвысокой чистоты из установки парового риформинга метана с очисткой PSA.
- производство азота сверхвысокой чистоты с помощью криогенной установки для производства азота, также известной как установка разделения воздуха (ASU).
▲ Рис. 8. Аммиак В процессе Casale используется слой катализатора, использующий аксиально-радиальную технологию, которая имеет меньший перепад давления и более высокую эффективность, чем стандартные слои катализатора.
Завод по производству аммиака в Казале рассчитан на производительность 2 000 т / сутки. Одной из ключевых особенностей этой конструкции является аксиально-радиальная технология в слое катализатора (рис. 8). В аксиально-радиальном слое катализатора большая часть синтез-газа проходит через слой катализатора в радиальном направлении, создавая очень низкий перепад давления.Остальной газ проходит через верхний слой катализатора в осевом направлении, что устраняет необходимость в верхней крышке слоя катализатора. Осевая и радиальная технология слоя катализатора Casale используется как в высокотемпературных, так и в низкотемпературных конвертерах сдвига, а также в конвертере синтеза.
Другие технологии
Некоторые поставщики технологий предложили установки риформинга с подогревом газа (GHR) для производства аммиака на установках малой мощности или для увеличения мощности. В отличие от установок традиционной конструкции, которые используют установку первичного риформинга и установку вторичного риформинга, работающих последовательно, установки с GHR используют горячий технологический газ из установки вторичного риформинга для подачи тепла в установку первичного риформинга.Это уменьшает размер установки первичного риформинга и исключает выбросы CO 2 из дымовой трубы установки первичного риформинга, делая процесс более экологически чистым.
Несмотря на то, что некоторые производители аммиака выступают за распределенное производство аммиака на небольших заводах по производству аммиака, большинство компаний предпочитают строить крупные предприятия рядом с источниками дешевого сырья и транспортировать продукт морским, железнодорожным или трубопроводным транспортом к потребителям.
Аммиак из угля
▲ Рисунок 9. Китай производит большую часть аммиака из угля.
Китай производит больше аммиака, чем любая другая страна, и большую часть аммиака производит из угля (Рисунок 9).
Основными технологическими установками на угольном аммиачном заводе являются ВРУ для отделения O 2 и N 2 из воздуха, газификатор, установка сдвига кислого газа (SGS), установка удаления кислого газа ( AGRU), и установка синтеза аммиака. Кислород из ВРУ подается в газификатор для преобразования угля в синтез-газ (H 2 , CO, CO 2 ) и CH 4 .Существует множество конструкций газификаторов, но большинство современных газификаторов основаны на псевдоожиженных слоях, которые работают при давлении выше атмосферного и могут использовать различное угольное сырье. В зависимости от конструкции могут быть произведены уровни CO 30–60% по объему.
После газификации любые твердые частицы в синтез-газе удаляются, и пар добавляется в установку SGS. В процессе SGS обычно используется катализатор на основе кобальта и молибдена (CoMo), специально разработанный для работы в среде серы.
После снижения концентрации CO в синтез-газе до менее 1 об.% Синтез-газ подается в AGRU, где охлажденный раствор для очистки метанола (, например, Rectisol) удаляет CO 2 и серу из синтез-газа. . Верхний погон CO 2 либо сбрасывается, либо подается на установку по производству мочевины. Выходящий поток серы подается в установку для извлечения серы (SRU).
Синтез-газ, который проходит через AGRU, обычно очищается одним из двух методов:
- установка для промывки азотом для удаления остаточного CO и CH 4 из синтез-газа перед подачей в контур синтеза
- система PSA для Удаление CO и CH 4 .
Заключительные мысли
За последние 60 лет технология обработки аммиака значительно улучшилась. Компоновки заводов эволюционировали от конструкций с несколькими поездами, часто с разным количеством поездов во входной части и в контуре синтеза, до конструкций с одним составом. Подготовка синтез-газа в передней части установки увеличилась с атмосферного до 30–50 бар изб. Пропускная способность одного поезда увеличилась со 100 до 3300 тонн в сутки.
Энергетическая эффективность также повысилась — потребление значительно превышает 60 ГДж / м3.т. аммиака на коксохимических заводах до 40–50 ГДж / т. на первых заводах, работающих на природном газе, до 30–40 ГДж / мт. на первых одноколесных заводах. На современных установках добавлена рекуперация тепла путем производства пара при давлении до 125 бар как в секции подготовки синтез-газа, так и в контуре синтеза.
Что касается технологического оборудования, произошел переход от поршневых компрессоров к центробежным компрессорам. В конвертере синтеза был реализован внутренний теплообменник для увеличения конверсии H 2 и N 2 в NH 3 .Разработчики применили регенерацию водорода из продувочного газа (в таких установках, как системы PSA), чтобы увеличить производство или снизить энергопотребление завода. Разработчики также внедрили системы сероочистки горячего сырья. Были значительно усовершенствованы катализаторы, используемые при риформинге, конверсии сдвига, метанировании и синтезе аммиака.
Для улучшения управления технологическим процессом и безопасности, распределенные системы управления (DCS) для расширенного управления технологическим процессом, а также системы безопасности (SIS) теперь входят в стандартную комплектацию аммиачных заводов.Перед тем, как какой-либо процесс будет запущен в оперативный режим, выполняются исследования опасностей и работоспособности (HAZOP) и анализ уровня защиты (LOPA). Достижения в области учебных тренажеров и практики обучения гарантируют, что операторы и инженеры могут выполнять свои обязанности безопасно и эффективно.
Это лишь некоторые из тысяч усовершенствований в области технологий и безопасности, которые были внедрены, чтобы сделать аммиачную промышленность одной из самых производительных и безопасных отраслей в мире.
Цитированная литература
- U.S. Geological Survey, «Азот (фиксированный) — Статистика по аммиаку», Minerals.usgs.gov/minerals/pubs/historical-statistics/ds140-nitro.xlsx (последнее изменение: 28 января 2016 г.).
- Слэк, А. В. и Дж. Р. Джеймс (ред.), «Аммиак», части I, II и III, Марсель Деккер, Нью-Йорк, Нью-Йорк (1974).
- Смил В., «Обогащение Земли — Фриц Габер, Карл Бош и трансформация мирового производства продуктов питания», MIT Press, Кембридж, Массачусетс (декабрь 2000 г.).
- Уильямс, Г.и В. Паттабатула, «Сто лет производства аммиака — итоги значительного вклада в обеспечение мира», 58-й ежегодный симпозиум по безопасности на аммиачных заводах и связанных с ними объектах, Айше (25–29 августа 2013 г.).
Благодарности
Авторы выражают признательность KBR, ThyssenKrupp Industrial Solutions, Haldor Topsøe, Linde и Casale за помощь в предоставлении технической литературы по их соответствующим технологическим процессам.
Аммиак — возобновляемое топливо, получаемое из солнца, воздуха и воды — может обеспечить энергию земного шара без углерода | Наука
Автор Роберт Ф.Служба
СИДНЕЙ, БРИСБАН И МЕЛЬБУРН, АВСТРАЛИЯ — Древние засушливые ландшафты Австралии — плодородная почва для новых ростков, — говорит Дуглас Макфарлейн, химик из Университета Монаш в пригороде Мельбурна: обширные леса ветряных мельниц и солнечных батарей. На страну падает больше солнечного света на квадратный метр, чем на любую другую, а сильные ветры обрушиваются на ее южное и западное побережье. В целом Австралия может похвастаться потенциалом возобновляемых источников энергии в 25 000 гигаватт, что является одним из самых высоких показателей в мире и примерно в четыре раза превышает установленную мощность производства электроэнергии на планете.Тем не менее, при небольшом населении и ограниченном количестве способов хранения или экспорта энергии его возобновляемые источники энергии в значительной степени остаются неиспользованными.
Вот где появляется Макфарлейн. Последние 4 года он работал над топливным элементом, который может преобразовывать возобновляемую электроэнергию в безуглеродное топливо: аммиак. Топливные элементы обычно используют энергию, хранящуюся в химических связях, для производства электричества; MacFarlane’s действует наоборот. В своей лаборатории на третьем этаже он демонстрирует одно из устройств размером с хоккейную шайбу, покрытое нержавеющей сталью.Две пластиковые трубки на его задней стороне подают азот и воду, а шнур питания подает электричество. Через третью трубку в передней части он бесшумно выдыхает газообразный аммиак, и все это без тепла, давления и выбросов углерода, которые обычно необходимы для производства химического вещества. «Это вдыхание азота и выдыхание аммиака», — говорит Макфарлейн, сияя, как гордый отец.
Компании по всему миру уже производят аммиак на сумму 60 миллиардов долларов в год, в основном в качестве удобрений, и штуковина Макфарлейна может позволить им производить аммиак более эффективно и чисто.Но у него есть амбиции сделать гораздо больше, чем просто помочь фермерам. Преобразуя возобновляемую электроэнергию в богатый энергией газ, который можно легко охладить и сжать в жидкое топливо, топливный элемент MacFarlane эффективно сдерживает солнечный свет и ветер, превращая их в товар, который можно отправлять в любую точку мира и преобразовывать обратно в электричество или газообразный водород для питания транспортных средств на топливных элементах. Газ, выходящий из топливного элемента, бесцветен, но для окружающей среды, по словам Макфарлейна, аммиак настолько зеленый, насколько это возможно.«Жидкий аммиак — это жидкая энергия», — говорит он. «Нам нужны устойчивые технологии».
Аммиак — один атом азота, связанный с тремя атомами водорода — может показаться не идеальным топливом: химическое вещество, используемое в бытовых чистящих средствах, имеет неприятный запах и токсично. Но его удельная энергия по объему почти вдвое больше, чем у жидкого водорода — его основного конкурента в качестве экологически чистого альтернативного топлива — и его легче транспортировать и распространять. «Вы можете хранить его, отправлять, сжигать и преобразовывать обратно в водород и азот», — говорит Тим Хьюз, исследователь накопителей энергии из производственного гиганта Siemens в Оксфорде, США.К. «Во многом он идеален».
Исследователи по всему миру преследуют то же самое видение «аммиачной экономики», и Австралия позиционирует себя, чтобы возглавить ее. «Это только начало», — говорит Алан Финкель, главный ученый Австралии из Канберры. По словам Финкеля, федеральным политикам еще предстоит предложить какое-либо серьезное законодательство в поддержку возобновляемого аммиака, что, возможно, и понятно для страны, долгое время связанной с экспортом угля и природного газа. Но в прошлом году Австралийское агентство по возобновляемым источникам энергии заявило, что создание экспортной экономики для возобновляемых источников энергии является одним из его приоритетов.В этом году агентство объявило о выделении 20 миллионов австралийских долларов на поддержку экспортных технологий из возобновляемых источников, включая доставку аммиака.
Ветреные побережья Австралии предлагают изобилие энергии, которую она однажды может экспортировать в качестве безуглеродного топлива.
ЗАЩИТА ПОБЕРЕЖЬЯ, ЮЖНАЯ АВСТРАЛИЯВ штатах Австралии политики рассматривают возобновляемый аммиак как потенциальный источник местных рабочих мест и налоговых поступлений, говорит Бретт Купер, председатель Renewable Hydrogen, консалтинговой фирмы по возобновляемым источникам топлива в Сиднее.В Квинсленде официальные лица обсуждают создание экспортного терминала аммиака в портовом городе Гладстон, который уже является центром отгрузки сжиженного природного газа в Азию. В феврале штат Южная Австралия выделил 12 миллионов австралийских долларов в виде грантов и займов для проекта по возобновляемым источникам аммиака. А в прошлом году международный консорциум объявил о планах строительства комбинированной ветро-солнечной электростанции стоимостью 10 миллиардов долларов США, известной как Азиатский центр возобновляемой энергии в штате Западная Австралия. Хотя большая часть из 9000 мегаватт электроэнергии проекта будет проходить по подводному кабелю для питания миллионов домов в Индонезии, часть этой энергии может быть использована для производства аммиака для экспорта на большие расстояния.«Аммиак — ключевой фактор для экспорта возобновляемых источников энергии», — говорит Дэвид Харрис, директор по исследованиям в области технологий с низким уровнем выбросов в Энергетической организации Австралийского Союза научных и промышленных исследований (CSIRO) в Пулленвейле. «Это мост в совершенно новый мир».
Однако сначала проповедники возобновляемого аммиака должны будут заменить один из крупнейших, самых грязных и проверенных временем промышленных процессов в мире: то, что называется Haber-Bosch.
Завод по производству аммиака, металлический мегаполис труб и резервуаров, находится там, где красные скалы пустыни Пилбара в Западной Австралии встречаются с океаном.Завод принадлежит Yara, крупнейшему производителю аммиака в мире, и был построен в 2006 году. Он находится в авангарде технологий и является одним из крупнейших в мире заводов по производству аммиака. Тем не менее, в его основе — стальные реакторы, в которых до сих пор используется вековой рецепт производства аммиака.
До 1909 года азотфиксирующие бактерии производили большую часть аммиака на планете. Но в том же году немецкий ученый Фриц Габер обнаружил реакцию, которая с помощью железных катализаторов может расщепить прочную химическую связь, удерживающую вместе молекулы азота, N 2 , и объединить атомы с водородом с образованием аммиака.Реакция требует грубой силы — давление до 250 атмосфер в высоких узких стальных реакторах — процесс, впервые внедренный немецким химиком Карлом Бошем. Процесс довольно эффективен; около 60% энергии, вложенной в растение, в конечном итоге хранится в связях аммиака. Этот процесс, масштабируемый до заводов размером с Yara, может производить огромное количество аммиака. Сегодня предприятие производит и отгружает 850 000 метрических тонн аммиака в год, что более чем вдвое превышает вес Эмпайр-стейт-билдинг.
Большинство используется как удобрение. Растения нуждаются в азоте, который используется для построения белков и ДНК, а аммиак доставляет его в биологически доступной форме. Реакторы Haber-Bosch могут производить аммиак намного быстрее, чем естественные процессы, и в последние десятилетия эта технология позволила фермерам прокормить быстро растущее население планеты. Подсчитано, что по крайней мере половина азота в организме человека сегодня поступает из завода по производству синтетического аммиака.
Haber-Bosch привел к Зеленой революции, но этот процесс совсем не зеленый.Для этого требуется источник газообразного водорода (H 2 ), который отделяется от природного газа или угля в реакции с использованием сжатого перегретого пара. Остается двуокись углерода (CO 2 ), на которую приходится около половины выбросов от всего процесса. Второе сырье, N 2 , легко отделяется от воздуха, который на 78% состоит из азота. Но создание давления, необходимого для смешивания водорода и азота в реакторах, потребляет больше ископаемого топлива, что означает больше CO 2 .Сумма выбросов складывается: производство аммиака потребляет около 2% мировой энергии и генерирует 1% его CO 2 .
Зеленый способ производства аммиака
Обратные топливные элементы могут использовать возобновляемую энергию для производства аммиака из воздуха и воды, что является гораздо более экологически безопасным методом, чем промышленный процесс Хабера-Боша. Возобновляемый аммиак может служить удобрением — традиционная роль аммиака — или энергоемким топливом.
Промышленный аммиак Большая часть аммиака в мире синтезируется с использованием технологии Габера – Боша, вековой давности, которая является быстрой и достаточно эффективной.Но фабрики выбрасывают огромное количество углекислого газа (CO2). Мягкие реакции В обратном топливном элементе используется возобновляемая электроэнергия для запуска химической реакции, в результате которой образуется аммиак. Вода реагирует на аноде, образуя ионы водорода (H +), которые мигрируют к катоду, где они реагируют с азотом (N2) с образованием аммиака. Реакция эффективная, но медленная. Аммиак — это больше, чем удобрение. Газ легко сжижается при небольшом давлении и охлаждении и может транспортироваться на электростанции для выработки безуглеродной электроэнергии.Его также можно «расколоть» в h3, ценный источник энергии для транспортных средств на топливных элементах. Воздух Высокая температура и давление Низкие температура и давлениеN2h3h3CO2 Природный газNh4CO2Удобрения Аммиачная электростанция Транспортные средства на топливных элементахАммонийная остановка рядом с фермами ТранспортКрекингN2ВыходностьЭффективностьCO2ВыходностьЭффективностьCO2NhV. ALTOUNIAN / НАУКА
Yara делает первый шаг к озеленению этого процесса с помощью пилотного завода, который должен открыться в 2019 году, который будет располагаться рядом с существующим заводом Pilbara.Вместо того, чтобы полагаться на природный газ для производства H 2 , новая надстройка будет подавать энергию от солнечной батареи 2,5 мегаватт на блок электролизеров, которые разделяют воду на H 2 и O 2 . Завод по-прежнему будет полагаться на реакцию Габера-Боша, чтобы объединить водород с азотом для получения аммиака. Но источник водорода на солнечной энергии сокращает общие выбросы CO 2 в результате процесса примерно вдвое.
Другие проекты следуют этому примеру. В феврале штат Южная Австралия объявил о планах строительства завода по производству аммиака стоимостью 180 млн австралийских долларов, снова полагаясь на электролизеры, работающие на возобновляемых источниках энергии.Завод, открытие которого запланировано на 2020 год, станет региональным источником удобрений и жидкого аммиака, которые можно сжигать в турбине или пропускать через топливный элемент для производства электроэнергии. Поставка жидкой энергии поможет стабилизировать энергосистему в Южной Австралии, которая в 2016 году пострадала от изнурительного отключения электроэнергии.
Полученный таким образом аммиак должен привлечь покупателей в таких странах, как Европейский Союз и Калифорния, которые создали стимулы для покупки более экологичного топлива. По словам Харриса, по мере роста рынка будут увеличиваться и маршруты распределения для импорта аммиака и технологии его использования.К тому времени топливные элементы, подобные топливным элементам MacFarlane, могут быть готовы заменить саму Haber-Bosch — и полузеленый подход к производству аммиака может стать полностью экологичным.
Вместо того, чтобы применять устрашающую температуру и давление, обратные топливные элементы производят аммиак, ловко перебирая ионы и электроны. Как и в заряжаемой батарее, заряженные ионы проходят между двумя электродами, на которые подается электричество. Анод, покрытый катализатором, расщепляет молекулы воды на O 2 , ионы водорода и электроны.Протоны проходят через электролит и проницаемую для протонов мембрану к катоду, в то время как электроны проходят через провод. На катоде катализаторы расщепляют молекулы N 2 и побуждают ионы и электроны водорода реагировать с азотом и производить аммиак.
В настоящее время урожайность невысока. При комнатной температуре и давлении реакции топливных элементов обычно имеют эффективность от 1% до 15%, а производительность незначительна. Но Макфарлейн нашел способ повысить эффективность за счет замены электролита.В электролите на водной основе, который используют многие группы, молекулы воды иногда реагируют с электронами на катоде, похищая электроны, которые в противном случае пошли бы на образование аммиака. «Мы постоянно боремся с переходом электронов в водород», — говорит Макфарлейн.
Компонент обратного топливного элемента использует возобновляемую энергию для соединения воды и азота для производства аммиака.
СТИВЕН МОРТОН / СОТРУДНИК КОРОЛЕВСКОГО ФОТОГРАФИЧЕСКОГО ОБЩЕСТВАЧтобы минимизировать эту конкуренцию, он выбрал так называемый ионный жидкий электролит.Такой подход позволяет большему количеству N 2 и меньшему количеству воды находиться рядом с катализаторами на катоде, увеличивая производство аммиака. В результате эффективность топливных элементов резко возросла с 15% до 60%, сообщил он и его коллеги в прошлом году в Energy & Environmental Science . С тех пор результат улучшился до 70%, говорит Макфарлейн, но с компромиссом. Ионная жидкость в его топливном элементе вязкая, в 10 раз более вязкая, чем вода. Протоны должны продвигаться к катоду, замедляя темпы производства аммиака.«Это причиняет нам боль», — говорит Макфарлейн.
Чтобы ускорить процесс, Макфарлейн и его коллеги играют со своими ионными жидкостями. В исследовании, опубликованном в апреле в ACS Energy Letters , они сообщают о разработке одного, богатого фтором, который помогает протонам легче проходить и ускоряет производство аммиака в 10 раз. его клетки могут соответствовать целям, установленным для данной области Министерством энергетики США (DOE), которые бросят вызов Хаберу-Бошу.
Рядом с университетом Монаша Сарб Гидди и его коллеги из офиса CSIRO Energy в Клейтоне производят аммиак с помощью своего «мембранного реактора». Он основан на высоких температурах и умеренном давлении — намного меньшем, чем в реакторе Габера-Боша, — что, по сравнению с ячейкой Макфарлейна, увеличивает пропускную способность, жертвуя при этом эффективностью. Конструкция реактора предусматривает использование пары концентрических длинных металлических трубок, нагретых до 450 ° C. В узкий зазор между трубками течет H 2 , который может быть изготовлен с помощью электролизера на солнечной или ветровой энергии.Катализаторы, выстилающие зазор, расщепляют молекулы H 2 на отдельные атомы водорода, которые затем под небольшим давлением проталкиваются через атомную решетку внутренней стенки трубки к ее полой сердцевине, где находятся закачанные по трубопроводу молекулы N 2 . Каталитически активный металл, такой как палладий, выстилает внутреннюю поверхность, расщепляя N 2 и уговаривая водород и азот объединиться в аммиак — намного быстрее, чем в ячейке Макфарлейна. Пока только небольшая часть входящего H 2 вступает в реакцию за любой проход — это еще один удар по эффективности реактора.
В разработке находятся другие подходы. В Колорадской горной школе в Голдене исследователи под руководством Райана О’Хейра разрабатывают обратные топливные элементы размером с кнопку. Изготовленный из керамики, чтобы выдерживать высокие рабочие температуры, элемент может синтезировать аммиак с рекордной скоростью — примерно в 500 раз быстрее, чем топливный элемент MacFarlane. Подобно мембранным реакторам Гидди, керамические топливные элементы приносят в жертву некоторую эффективность ради производительности. Даже в этом случае, говорит О’Хейр, им все равно необходимо повысить производительность еще в 70 раз, чтобы достичь целей Министерства энергетики.«У нас много идей, — говорит О’Хейр.
Пока неизвестно, окажется ли какой-либо из этих подходов одновременно эффективным и быстрым. «Сообщество все еще пытается выяснить, в каком направлении двигаться», — говорит Лорен Гринли, инженер-химик из Университета Арканзаса в Фейетвилле. С этим согласен Григорий Соловейчик, менеджер в Вашингтоне, округ Колумбия, программы Министерства энергетики по перспективным исследовательским проектам Министерства энергетики по производству возобновляемых видов топлива. «Сделать [зеленый] аммиак несложно», — говорит он.«Сделать это экономично в больших масштабах сложно».
Похоже, интереса достаточно, чтобы начать эту отрасль.
Дэвид Харрис, CSIRO Energy
Какой бы отдаленной ни была перспектива следующих в Азию танкеров с зеленым австралийским аммиаком, возникает следующий вопрос. «Как только вы доставите аммиак на рынок, как вы получите из него энергию?» — спрашивает Майкл Долан, химик из CSIRO Energy в Брисбене.
По словам Долана, самый простой вариант — использовать зеленый аммиак в качестве удобрения, как современный аммиак, но без штрафа за углерод.Кроме того, аммиак можно преобразовать в электричество на электростанции, приспособленной для сжигания аммиака, или в традиционном топливном элементе, как планирует это сделать завод в Южной Австралии. Но в настоящее время самая высокая ценность аммиака — это богатый источник водорода, используемый в транспортных средствах на топливных элементах. В то время как аммиачные удобрения продаются по цене около 750 долларов за тонну, водород для автомобилей на топливных элементах может быть более чем в 10 раз дороже.
В Соединенных Штатах автомобили на топливных элементах кажутся почти мертвыми, побежденными автомобилями с батарейным питанием.Но Япония по-прежнему активно поддерживает топливные элементы. Страна потратила более 12 миллиардов долларов на водородные технологии в рамках своей стратегии по сокращению импорта ископаемого топлива и выполнения своего обязательства по сокращению выбросов CO 2 в соответствии с Парижским соглашением по климату. Сегодня в стране всего около 2500 автомобилей на топливных элементах. Но к 2030 году японские официальные лица ожидают 800 000 человек. И страна рассматривает аммиак как способ заправить их.
Преобразование водорода в аммиак только для его обратного преобразования может показаться странным.Но водород трудно транспортировать: его нужно сжижать, охлаждая до температуры ниже -253 ° C, используя треть его энергетической ценности. Аммиак, напротив, разжижается при -10 ° C под небольшим давлением. По словам Долана, затраты энергии на преобразование водорода в аммиак и обратно примерно такие же, как и при охлаждении водорода, а поскольку для обработки и транспортировки аммиака уже существует гораздо большая инфраструктура, аммиак — более безопасный вариант.
Последний шаг — удаление водорода из молекул аммиака — это то, над чем работают Долан и его коллеги.На огромном металлическом складе в кампусе CSIRO, который долгое время использовался для изучения горения угля, двое коллег Долана собирают реактор высотой 2 метра, который затмевает находящийся поблизости угольный реактор. При включении реактор «расщепляет» аммиак на две составляющие: H 2 для продажи и N 2 для возврата в воздух.
Обзор исследований по теме
Этот реактор по сути является увеличенной версией мембранного реактора Гидди, работающего в обратном направлении.Только здесь газообразный аммиак подается в пространство между двумя концентрическими металлическими трубками. Тепло, давление и металлические катализаторы расщепляют молекулы аммиака и толкают атомы водорода к полой сердцевине трубки, где они объединяются, образуя H 2 , который отсасывается и хранится.
В конечном итоге, говорит Долан, реактор будет производить 15 килограммов в день водорода с чистотой 99,9999%, чего достаточно для питания нескольких автомобилей на топливных элементах. В следующем месяце он планирует продемонстрировать реактор автопроизводителям, используя его для заправки баков Toyota Mirai и Hyundai Nexo, двух автомобилей на топливных элементах.Он говорит, что его команда на поздней стадии обсуждает с компанией возможность построить коммерческую пилотную установку на основе этой технологии. «Это очень важная часть головоломки, — говорит Купер.
Согласно плану развития возобновляемых источников энергии, недавно опубликованному Министерством экономики, торговли и промышленности Японии, после 2030 года Япония, вероятно, будет импортировать водород на сумму от 10 до 20 миллиардов долларов в год. Япония, Сингапур и Южная Корея начали переговоры с австралийскими официальными лицами о создании портов для импорта водорода или аммиака, произведенного из возобновляемых источников.«Я не знаю, как все это сочетается с экономической точки зрения», — говорит Харрис. «Но похоже, что есть достаточно интереса, чтобы начать эту отрасль».
Купер знает, чем он хочет, чтобы это закончилось. За кофе дождливым утром в Сиднее он описывает свое футуристическое видение возобновляемого аммиака. Когда он прищуривается, то видит, что лет через 30, побережье Австралии усеяно супертанкерами, пришвартованными к морским буровым установкам. Но они не стали бы заправляться маслом. Линии электропередач на морском дне будут передавать возобновляемую электроэнергию на буровые установки от ветряных и солнечных ферм на берегу.На борту одно устройство будет использовать электричество для опреснения морской воды и подачи пресной воды в электролизеры для производства водорода. Другое устройство будет фильтровать азот с неба. Обратные топливные элементы соединят их вместе в аммиак для загрузки на танкеры — изобилие энергии солнца, воздуха и моря.
Это мечта, которой ядерный синтез так и не осуществился, говорит он: неиссякаемая безуглеродная энергия, только на этот раз за счет аммиака. «Он никогда не закончится, и в системе нет углерода.«
Производство аммиака | Энциклопедия
Определение
Аммиак — второй по величине химический продукт в мире, используемый в качестве сельскохозяйственных удобрений, продуктов питания, промышленных материалов, хладагентов и добавок.В последнее время использование аммиака в качестве энергоносителя (вторичного источника энергии) привлекло много внимания из-за его высокой объемной плотности водорода, низкого давления хранения, высокой стабильности при длительном хранении, высокой температуры самовоспламенения, низкого давления конденсации, и более низкая плотность газа, чем у воздуха. в целом производство аммиака включает в себя принятые в настоящее время термохимические (Габера – Боша), электрохимические и фотохимические циклические процессы.
1.Введение
В настоящее время во всем мире производится около 200 млн т аммиака в год. [1] , что делает его вторым по величине производимым химическим веществом в мире после серной кислоты (H 2 SO 4 ). Подобно водороду, аммиак можно производить из различных источников первичной энергии, включая биомассу, уголь, природный газ, солнечные, ветровые, геотермальные, гидро- и ядерные источники. Аммиак можно производить с помощью различных технологий преобразования: термохимических, электрохимических, фотохимических и плазменных [2] .Однако, с учетом технологической осуществимости и общей энергоэффективности [3] [4] , в этой работе описаны три основные технологии преобразования (Габера – Боша, процессы электрохимического и термохимического цикла). Кроме того, описаны последние тенденции в разработке усовершенствованных систем для повышения общей энергоэффективности при производстве аммиака.
2. Производство обычного аммиака
В применяемом в настоящее время процессе производства аммиака в основном используется система, изобретенная Фрицем Хабером и Карлом Бошем около 100 лет назад. [1] .Поэтому эта система хорошо известна как процесс Габера – Боша. Около 85% от общего объема производства аммиака во всем мире производится этим способом [5] . Синтез аммиака происходит по реакции (1).
3 H 2 + N 2 ⇋ 2 NH 3 ΔH ° 27 ° C = −46,35 кДж / моль (1)
Синтез аммиака — это экзотермическая реакция (отрицательное изменение энтальпии), происходящее самопроизвольно при низких температурах (отрицательное изменение энтропии).Хотя это предпочтительно при комнатной температуре, скорость реакции, при которой реакция происходит при комнатной температуре, слишком мала, чтобы ее можно было применять в промышленном масштабе. Для увеличения кинетики реакции для достижения заданной скорости превращения требуются высокое давление и температура. Для эффективного синтеза аммиака из его основных компонентов (водорода и азота) реакцию необходимо проводить при относительно высокой температуре и давлении 400–500 ° C и 10–30 МПа соответственно с помощью катализатора на основе железа.Это условие требуется из-за высокой энергии диссоциации (941 кДж / моль) азота с тройной связью. Однако, чтобы провести реакцию при такой высокой температуре и давлении, требуется около 30 МДж / кг-NH 3 энергии [6] .
Производство аммиака из природного газа осуществляется путем реакции метана (природного газа) с водяным паром и воздухом с последующим удалением воды и CO 2 . Продуктами этого процесса являются водород и азот, которые являются сырьем для основного синтеза аммиака.Во время процесса важно удаление серы и других примесей, поскольку они могут снизить и повредить характеристики катализатора во время синтеза. В процессе синтеза аммиака и азот, и водород сжимаются до относительно высокого давления для подачи в реактор синтеза, где катализатор погружается внутрь. Полученный аммиак вместе с непрореагировавшим водородом, аргоном и другими примесями затем охлаждается для конденсации аммиака, чтобы отделить аммиак от других газов.Непрореагировавшие водород и азот затем возвращаются обратно и смешиваются с новым сырьем. Чтобы избежать накопления примесей, таких как аргон, небольшая часть газов удаляется из процесса. При синтезе аммиака выделяется небольшое количество тепла, которое выделяется из реактора; поэтому его можно регенерировать и использовать для других процессов, таких как производство пара и электроэнергии. В целом можно сохранить около 88% теплотворной способности водорода [7] .
Еще одна проблема процесса Хабера – Боша — низкий коэффициент конверсии; следовательно, процесс должен быть переработан для достижения ожидаемой производительности.Однако при давлении 30 МПа степень конверсии реакции все еще низкая, не более 25% [8] . Эта рециркуляция потока вызывает некоторые проблемы, в том числе необходимость в дополнительной системе рециркуляции и реакторе большего размера, что приводит к высоким инвестиционным и эксплуатационным затратам.
Когда водород получают электролизом воды, азот можно подавать путем разделения воздуха. Разделение воздуха для производства азота может осуществляться с помощью мембранных, криогенных, абсорбционных и адсорбционных технологий [9] .Для больших масштабов криогенное разделение считается более экономичным, чем другие методы. Кроме того, с помощью криогенной сепарации воздуха можно получить продукты высокой чистоты [10] .
Энергия, потребляемая при производстве аммиака, включая конверсию из первичных источников, обычно составляет примерно от 28 до 37 ГДж / т [5] . Система производства аммиака из любого первичного источника, такого как природный газ, считается сложной, поскольку включает в себя множество комбинированных процессов. На рис. 1 показана принципиальная схема производства обычного аммиака из природного газа.Система состоит из различных процессов: паровой конверсии, реакции конверсии воды в газ, удаления CO 2 , очистки синтез-газа, а также синтеза и разделения аммиака. Следовательно, усилия по снижению общего энергопотребления требуют улучшения всего процесса. Из-за высокой энергоемкости производства аммиака при синтезе аммиака ежегодно выделяется 289,8 Мт-CO 2 [11] , что составляет почти 0,93% от мировых выбросов CO 2 [12] .
Рис. 2. Принципиальная схема производства аммиака из природного газа с использованием процесса Габера – Боша.
Ориентируясь на процесс Haber – Bosch, были предприняты многие усилия по уменьшению его экстремальных условий. Они включают введение дополнительного компонента для подавления катализа и изменение геометрии и электронной природы реагирующих компонентов для оптимизации энергетики катализа [13] .Катализаторы на основе Ru могут в основном способствовать синтезу аммиака в мягких условиях (при температуре 300–450 ° C и давлении 4–15 МПа), что значительно ниже, чем условия, необходимые для катализаторов на основе железа. Однако катализаторы на основе Ru дороги и страдают от отравления водородом [14] [15] . Оксиды и гидроксиды щелочноземельных металлов были определены как промоторы для улучшения каталитических характеристик катализаторов на основе Ru [16] . Некоторые электриды (кристаллы, в которых электроны служат анионами), такие как Ca 2 N: e —, которые могут быть осаждены в наночастицах Ru, обладают потенциалом для облегчения синтеза аммиака при 200 ° C [17] .Переходные металлы (TM) также могут улучшить характеристики синтеза, включая снижение давления и температуры. Это связано с существованием масштабных соотношений между энергией переходного состояния, необходимой для диссоциации азота, и энергией адсорбции всех промежуточных соединений [18] [19] . Кроме того, Кавамура и Танигучи [20] испытали расплав натрия в качестве катализатора синтеза аммиака. Используя этот тип катализатора, синтез можно проводить при температурах реакции 500–590 ° C и атмосферном давлении.Однако требуются дальнейший анализ и эксперименты, чтобы довести этот метод до уровня применимости.
3. Электрохимическая обработка
Хотя электрохимическая обработка значительно недостаточно развита по сравнению с процессом Габера – Боша, ожидается, что она обеспечит более высокие энергетические характеристики. Энергия, потребляемая этим процессом, примерно на 20% ниже, чем в процессе Габера – Боша [21] . На рис. 2 представлена принципиальная схема электрохимического синтеза аммиака.Процесс считается простым; поэтому считается, что его применение потенциально снижает конфигурацию системы и сложность управления. Кроме того, инвестиционные затраты могут быть ниже по сравнению с применяемыми в настоящее время системами синтеза аммиака.
Рисунок 3. Принципиальная схема электрохимического синтеза аммиака.
Реакции как на катоде, так и на аноде в протонпроводящих ячейках показаны в реакциях (2) и (3) соответственно. Реакции на каждом катоде и аноде в основном обратимы.
N 2 + 6 H + + 6 e — ⇌ 2 NH 3 (2)
3 H 2 6 H + + 6 e — (3)
В настоящее время доступны четыре различных типа электролитов: (а) жидкие электролиты, (б) расплавленные соли, (в) композитные мембраны и (г) твердотельные электролиты. Жидкие электролиты могут работать при атмосферной температуре и давлении [22] . Есть несколько потенциальных жидких электролитов, в том числе LiClO 4 (0.2 M) в тетрагидрофуране [22] , LiClO 4 в ионной жидкости, LiClO 4 в H 2 SO 4 и Li 2 SO 4 в H 2 SO 4 [23] . Производство аммиака составляет 3,68 × 10 -10 моль / см 2 · с, тогда как эффективность системы может достигать около 58%, что указывает на то, что около 58% тока, подаваемого в систему, преобразуется в аммиак. Однако исследования, связанные с этим вопросом, по-прежнему ограничиваются лабораторными экспериментами с небольшими размерами ячеек и ограниченным временем работы [2] .
Электролит с расплавом солей обычно работает в диапазоне температур 300–500 ° C [24] . Есть некоторые потенциальные химические вещества для использования в качестве электролитов, такие как LiCl, KCl и CsCl, с растворенным Li 3 N [25] . Сообщенная скорость производства аммиака составляет 3,3 × 10 -9 моль / см 2 · с, а эффективность составляет около 72%. Кроме того, система с композитными электролитами также включает твердые электролиты, которые сочетаются с легкоплавкой солью и имеют рабочую температуру 300–700 ° C.Электролиты включают основную ионопроводящую фазу и дополнительную фазу, которая присоединена к основной фазе для улучшения электрических, механических и термических свойств [26] . Карбонат щелочного металла (например, LiCO 3 ) и оксид (например, LiAlO 2 ) и CeO 2 , легированный Sm 2 O 3 , как представитель композитных электролитов, показали ожидаемые свойства, в том числе ионная кислородная, карбонатная и протонная проводимость [27] .Кроме того, Amar et al. [27] протестировали смешанные карбонаты Na, K и Li в дополнение к LiAlO 2 в качестве электролита. Они получили скорость производства аммиака 2,32 × 10 -10 моль / см 2 · с при температуре около 400 ° C. Система с твердыми электролитами обычно работает в очень широком диапазоне рабочих температур, от комнатной до примерно 800 ° C. В этот тип электролита могут входить различные материалы. К ним относятся перовскиты (такие как церат и цирконат) [28] , флюориты (такие как легированный диоксид циркония, церий и торий), пирохлоры (такие как цирконат лантана, легированный кальцием) и другие материалы (включая браунмиллерит, эулитит и монацит) [ 26] .К недостаткам этого типа электролитов относятся их структурная стабильность и высокая температура спекания (до 1700 ° C), необходимая для достижения высокой плотности. При использовании такого твердотельного электролита скорость производства аммиака 3,1 × 10 -9 моль / см 2 · с может быть достигнута при температуре 570 ° C с эффективностью около 75% [27 ] [29] .
4. Термохимический цикл производства аммиака
В качестве альтернативного процесса производства аммиака был разработан процесс, использующий термохимический цикл. [30] .Система состоит из двух циркулирующих процессов: восстановления (активация азота) и парогидролиза (образование аммиака). Обе реакции резюмируются следующим образом:
Al 2 O 3 + 3C + N 2 → 2 AlN + 3 CO ΔH ° 25 ° C = 708,1 кДж / моль (4)
2AlN + 3 H 2 O → Al 2 O 3 + 2 NH 3 ΔH ° 25 ° C = −274,1 кДж / моль (5)
На рисунке 3 представлена принципиальная схема термохимического цикла производства аммиака.Первичные источники энергии предварительно обрабатываются и превращаются в углерод перед подачей в процесс термохимического цикла. В первом процессе восстановления (реакция (4)) AlN получают карботермическим восстановлением Al 2 O 3 и азота. Эта реакция эндотермическая и протекает при температуре около 1500 ° C. Кроме того, во второй реакции, которая представляет собой гидролиз водяным паром (реакция (5)), AlN, полученный в первом процессе восстановления, реагирует с паром (H 2 O) с образованием Al 2 O 3 .Полученный в этой второй реакции Al 2 O 3 затем направляют в первый процесс восстановления. Детальная кинетика реакции была подробно проанализирована в [31] .
Рисунок 4. Принципиальная схема термохимического цикла производства аммиака.
В отличие от процесса Габера – Боша, этот термохимический цикл можно проводить при атмосферном давлении и без катализатора. Процесс позволяет независимо контролировать реакцию активации азота (реакция (4)) и образования аммиака (реакция (5)).Кроме того, как можно было наблюдать из реакции (4), система может производить аммиак непосредственно из карбонизированного материала вместо чистого водорода. Следовательно, ожидается, что эта система сможет снизить потребление энергии при производстве аммиака. Однако самая большая проблема этой системы связана с ее очень высокой рабочей температурой, что приводит к ограниченным источникам тепла и материалам. Были предложены различные идеи для теплоснабжения, включая использование концентрированного солнечного тепла.
Хуангса и Азиз [32] разработали интегрированную систему, состоящую из производства азота, производства аммиака с использованием термохимического цикла и выработки электроэнергии. В их системе тепло, необходимое для восстановления, в основном покрывается теплом, выделяемым при сгорании топливных газов, образующихся при производстве аммиака. Система может достичь высокого общего теоретического КПД энергии около 69%. Кроме того, они также заявили, что температура окисления играет важную роль в работе системы.
1,4. Современные системы производства аммиака
В связи с растущим беспокойством, связанным с экономическим и экологическим воздействием, усилия по предложению и развитию усовершенствованной системы производства аммиака были предприняты интенсивно. К ним относятся как термохимические, так и электрохимические процессы.
Cinti et al. [33] предложили комбинированную систему, которая состоит из твердооксидного электролизера, производства азота с адсорбцией при переменном давлении и процесса Габера-Боша.Более того, та же группа [11] также разработала интегрированную систему, охватывающую паровой риформинг метана и процесс Габера – Боша. В основном они сосредоточились на системной интеграции и рекуперации тепла для повышения общей энергоэффективности. Кроме того, Азиз и др. [34] предложили интегрированную систему преобразования водорода в аммиак с относительно высокой общей энергоэффективностью. Их система включает криогенное разделение азота с одним реактором дистилляции, процесс Габера – Боша и производство электроэнергии.Вырабатываемое при синтезе аммиака тепло, а также продуванный газ (содержащий небольшое количество водорода и аммиака) рекуперируются и используются для выработки электроэнергии. Кроме того, они использовали как регенерацию эксергии, так и интеграцию процессов для достижения высокой энергоэффективности [35] .
Разработаны другие интегрированные системы для производства аммиака из различных видов первичных источников энергии. Нурдиавати и др. [36] предложили производство аммиака на основе водорослей путем интеграции сушки водорослей, газификации, химического цикла, синтеза аммиака (процесс Габера – Боша) и выработки электроэнергии.В их системе процесс отделения азота не используется из-за использования богатого азотом дымового газа из химического контура. Их система способна эффективно преобразовывать водоросли в аммиак с общей энергоэффективностью около 64%, включая эффективность производства аммиака 63%. Другая система была также разработана той же группой [37] , с основным отличием в гидротермальной газификации и производстве азота. Другая комбинированная система для преобразования сельскохозяйственных отходов от завода по производству пальмового масла также была предложена и оценена Ajiwibowo et al. [38] . В их системе сверхкритическая водная газификация смешанных пустых плодовых гроздей и сточных вод завода по производству пальмового масла сочетается с химическим циклом синтез-газа и синтезом аммиака на основе Габера – Боша.
Запись из 10.3390 / en13123062
Аммиак
Производство аммиака имеет решающее значение для мировой сельскохозяйственной промышленности, поскольку из него производятся все удобрения, содержащие азот.
Использование аммиака
Производство удобрений, безусловно, является наиболее важным видом использования аммиака. К ним относятся мочевина, соли аммония (фосфаты аммония, нитрат аммония, нитрат аммония кальция) и растворы аммиака.
Рис. 1 Использование аммиака.
Увеличивающееся количество аммиака, хотя и небольшое по сравнению с другими видами применения, используется в качестве концентрированного раствора для борьбы с выбросами оксидов азота из электростанций.
Годовое производство аммиака
Аммиак занимает второе место после серной кислоты как химическое вещество с наибольшим тоннажем. Его все чаще производят в странах, которые имеют недорогие источники природного газа и угля (на Китай и Россию приходится или 40%). Крупнейшие заводы производят около 3000 тонн в день, и есть планы построить заводы, производящие 4000-5000 тонн в день, что означает, что всем мировым производством можно будет управлять с помощью 100 таких единиц. Текущее производство:
| Весь мир | 146 млн тонн |
| Китай | 48 млн тонн |
| Россия | 12 млн тонн |
| Индия | 11 млн тонн |
| U.С. | 9 миллионов тонн |
| Индонезия | 5 млн тонн |
| Тринидад и Тобаго | 5 миллионов тонн |
| Украина | 4 миллиона тонн |
Данные из:
Геологическая служба США, Сводные данные по минеральным товарам, 2016 г.
Увеличение тоннажа производимого аммиака идет в ногу с увеличением загрязнения мира и повышением уровня жизни в нем.Ожидается, что к 2018 году спрос на аммиак увеличится почти до 200 млн тонн. 1 .
1. Международная ассоциация удобрений, 2014 г.
Производство аммиака
Производство аммиака из азота и водорода осуществляется в два основных этапа:
а) производство водорода
б) синтез аммиака (процесс Габера)
Производство водорода включает несколько различных процессов. На рисунке 2 показана их последовательность и расположение на заводе по производству аммиака (шаги 1–5).Также показан конвертер, используемый для производства аммиака из водорода (этап 6). Что происходит на каждом из этих шагов, описано ниже.
Рисунок 2 Завод по производству аммиака в Западной Австралии: 1 Установки десульфуризации |
(а) Производство водорода
Водород производится из разнообразного сырья, в основном из природного газа, угля или нафты. Способы получения водорода из этого сырья рассматриваются отдельно.
Водород из природного газа (метан)
Это включает в себя два этапа:
i) производство синтез-газа (смесь окиси углерода и водорода (паровой риформинг))
ii) удаление окиси углерода и получение смеси водорода и азота (реакция сдвига)
(i) Производство синтез-газа
Каким бы способом ни был получен метан, он будет содержать некоторые органические соединения серы и сероводород, оба из которых необходимо удалить.В противном случае они отравят катализатор, необходимый для производства синтез-газа. В установке обессеривания органические соединения серы часто сначала превращаются в сероводород до реакции с оксидом цинка. Сырье смешивают с водородом и пропускают через катализатор из смешанных оксидов кобальта и молибдена на инертном носителе (специально обработанный оксид алюминия) при температуре – 700 K.
Затем газы пропускают через оксид цинка при температуре примерно 700 K и удаляют сероводород:
Первичный риформинг с водяным паром превращает метан и водяной пар в синтез-газ, смесь окиси углерода и водорода:
Высокие температуры и низкие давления способствуют образованию продуктов (принцип Ле Шателье).На практике реагенты пропускаются через катализатор из никеля, тонко разделенный на поверхности подложки из оксида кальция / оксида алюминия, содержащейся в вертикальных трубках из никелевого сплава. Трубки, до 350 параллельно включенных, нагреваются в печи выше 1000 К и под давлением ~ 30 атм. Это пример трубчатого реактора.
Вторичный риформинг с водяным паром реагирует на кислород из воздуха с некоторым количеством присутствующего водорода, и полученная смесь пропускается через никелевый катализатор.Пар и тепло, образующиеся при сгорании, преобразовывают большую часть остаточного метана. Среди ключевых реакций:
Выходящий газ из этой чистой экзотермической стадии имеет температуру – 1200 К и охлаждается в теплообменниках. Пар, образующийся из воды, используемой для охлаждения газов, используется для работы турбин и, следовательно, компрессоров, а также для предварительного нагрева реагентов.
В некоторых последних разработках отходящее тепло установки вторичного риформинга используется непосредственно для обеспечения теплом установки первичного риформинга.
На этой стадии газ содержит водород, азот, окись углерода и двуокись углерода и около 0,25% метана. Поскольку воздух содержит 1% аргона, он также накапливается в синтез-газе.
(ii) Реакция сдвига
В этом процессе окись углерода преобразуется в двуокись углерода, при этом образуется больше водорода.
Проходит в два этапа. В первой реакции высокотемпературного сдвига газ смешивается с паром и пропускается над катализатором на основе оксида железа / хрома (III) при температуре – 700 К в реакторе с неподвижным слоем.Это снижает концентрацию окиси углерода с 11%:
На второй стадии, реакция низкотемпературного сдвига , смесь газов проходит над медно-цинковым катализатором при примерно 500 К. Концентрация монооксида углерода дополнительно снижается до 0,2%.
Реакция проводится в два этапа по нескольким причинам. Реакция экзотермическая. Однако при высокой температуре выходная концентрация окиси углерода все еще довольно высока из-за контроля равновесия.Медный катализатор, используемый на низкотемпературной стадии, очень чувствителен к высоким температурам и не может эффективно работать на высокотемпературной стадии. Таким образом, основная часть реакции проводится при высокой температуре для рекуперации большей части тепла. Затем газ удаляют при низкой температуре, где равновесие гораздо более благоприятно, на очень активном, но нестабильном медном катализаторе.
Теперь газовая смесь содержит около 18% диоксида углерода, который удаляют путем промывки газа раствором основания с использованием одного из нескольких доступных методов.Предпочтение отдается органическому основанию (в поглотителе углекислого газа ), раствору этаноламина, часто 2,2 ‘- (метилимино) бис-этанола (N-метилдиэтаноламин).
Диоксид углерода выделяется при нагревании раствора в стриппере диоксида углерода (). Большая часть его сжижается и продается, например, для газированных напитков, в качестве охлаждающей жидкости для атомных электростанций и для стимулирования роста растений в теплицах.
Последние следы оксидов углерода удаляются пропусканием газов над никелевым катализатором при 600 К:
Этот процесс известен как метанирование.Получается газ типичного состава: 74% водорода, 25% азота, 1% метана вместе с некоторым количеством аргона.
Водород из нафты
Если в качестве сырья используется нафта, необходима дополнительная стадия риформинга. Нафта нагревается с образованием пара, смешивается с паром и проходит по трубам, нагревается до 750 К и набивается катализатором, никелем, нанесенным на смесь оксидов алюминия и магния. Основным продуктом является метан вместе с оксидами углерода, который затем обрабатывается паровой конверсией, как если бы это был природный газ, с последующей реакцией сдвига.
Водород из угля
Если используется уголь, его сначала тонко измельчают и нагревают в атмосфере кислорода и пара. Часть угля очень быстро сгорает в кислороде (менее 0,1 с), вызывая повышение температуры в печи, а остальная часть угля вступает в реакцию с паром:
Выбрасываемый газ содержит около 55% окиси углерода, 30% водорода, 10% двуокиси углерода и небольшие количества метана и других углеводородов. Эту смесь обрабатывают реакцией сдвига.
Основные проблемы использования угля включают большие количества диоксида и триоксида серы, образующиеся при сжигании угля, а также значительное количество других примесей, таких как мышьяк и бром, которые очень вредны для атмосферы и все они являются сильными ядами для катализаторы в процессе. Также существует серьезная проблема с удалением золы.
Водород из биомассы
Синтез-газ можно производить из биомассы. Процесс изложен в разделе «Биоперерабатывающие заводы».
(б) Производство аммиака (процесс Габера)
В основе процесса лежит реакция между водородом и азотом в реакторе с неподвижным слоем. Газы в стехиометрических пропорциях нагреваются и пропускаются под давлением над катализатором (рис. 3).
Рис. 3 Схема, иллюстрирующая обычный реактор синтеза (конвертер).
Доля аммиака в равновесной смеси увеличивается с увеличением давления и падением температуры (принцип Ле Шателье).Количественные данные приведены в таблице 1. Для получения приемлемого выхода и благоприятной скорости используются высокие давления, умеренные температуры и катализатор.
| Давление / атм | Процент аммиака, находящегося в равновесии в диапазоне температур | |||||
|---|---|---|---|---|---|---|
| 373 K | 473 K | 573 K | 97126 77126 77126 773 К||||
| 10 | – | 50.7 | 14,7 | 3,9 | 1,2 | 0,2 |
| 25 | 91,7 | 63,6 | 27,4 | 8,7 | 2,9 | – |
| 50 | 94,5 | 74,0 | 39,5 | 15,3 | 5,6 | 1,1 |
| 100 | 96.7 | 81,7 | 52,5 | 25,2 | 10,6 | 2,2 |
| 200 | 98,4 | 89,0 | 66,7 | 38,8 | 18,3 | – |
| 400 | 99,4 | 94,6 | 79,7 | 55,4 | 31,9 | – |
| 1000 | – | 98.3 | 92,6 | 79,8 | 57,5 | 12,9 |
Таблица 1 Объемное процентное содержание аммиака в равновесной смеси для реакции
между азотом и водородом при различных температурах и давлениях.
В зависимости от конструкции реактора используется широкий диапазон условий. Используемые температуры варьируются от 600 до 700 К, а давление от 100 до 200 атмосфер.Большая работа проводится для повышения эффективности катализатора, чтобы можно было использовать давление до 50 атмосфер.
Поскольку реакция является экзотермической, добавляются холодные реагенты (азот и водород) для снижения температуры реакторов (рис. 3).
Аммиак обычно хранится на месте (шаг 7) и перекачивается в другую часть завода, где он превращается в удобрение (мочевину или соль аммония). Однако иногда его транспортируют морем (рис. 4) или автомобильным транспортом для использования на другом заводе.
| Рис. 4 На заводе в Западной Австралии аммиак перекачивается по трубопроводу в близлежащую гавань (рис. 2, этап 8) и транспортируется морским транспортом. На нем около 40 000 тонн сжиженного аммиака. С любезного разрешения Yara International ASA. |
Исходным катализатором, который использовал Хабер, был Fe 3 O 4 , который был восстановлен реагентом, водородом, до железа.Была проделана большая работа по улучшению катализатора, и было обнаружено, что небольшое количество гидроксида калия эффективно в качестве промотора.
Недавние исследования были сосредоточены на поиске еще более эффективных катализаторов, которые позволили бы процессу протекать при более низких давлениях и температурах. Рутений на поверхности графита перспективен.
| Рисунок 5 Производство аммиака. |
Постскриптум
Процесс Габера настолько важен для нашей жизни, что за почти 90 лет он был удостоен трех Нобелевских премий по химии, присуждаемых немецким ученым, что является выдающимся рекордом.
Первый был дан в 1918 году Фрицу Габеру, химику, который разработал этот процесс в лаборатории. Второй — Карлу Бошу, блестящие инженерные навыки которого сделали этот процесс жизнеспособным в массовом масштабе, но который ждал своей награды до 1931 года.
В 2007 году Герхард Эртль был удостоен Премии за работу по катализу газовых реакций на твердых телах. Среди широкого круга изученных им реакций он получил доказательства адсорбции молекул азота и молекул водорода на поверхности железа и того, что эти адсорбированные молекулы диссоциируют на атомы.Затем эти атомы поэтапно соединяются, образуя молекулу аммиака. Следует помнить, что условия, использованные в этих исследованиях (менее 10 -10 атм), сильно отличаются от условий, используемых в промышленности, ок. 150 атм.
Сводка
Весь процесс производства аммиака из метана кратко представлен на Рисунке 5. Если уголь или нафта являются сырьем, необходимы дополнительные процессы. Нафта превращается в метан и оксиды углерода перед поступлением в установку первичного риформинга, а затем в реакцию конверсии.Уголь также превращается в водород и оксиды углерода, и эта смесь затем подвергается реакции сдвига.
Дата последнего изменения: 18 октября 2016 г.
Синтез аммиака стал электрическим | Feature
Картиш Мантирам мечтает о наэлектризованном будущем. Инженер-химик Массачусетского технологического института входит в растущую группу исследователей, изучающих способы, с помощью которых электрохимия на основе возобновляемых источников энергии может заменить ископаемое топливо в качестве основы химической промышленности.
«Общее видение состоит в том, чтобы думать о будущем, в котором химическое производство начинается только с двуокиси углерода, воды и азота», — говорит Мантирам. «Если мы начнем с этих трех видов сырья и у нас будет возобновляемая электроэнергия, то мы сможем представить себе использование углекислого газа в качестве источника атомов углерода, использование воды для кислорода и водорода и диазота в качестве источника азота, и начнем соединять вместе относительно сложные органические молекулы », — говорит он.
В том будущем мире, о котором мы мечтаем, мы могли бы производить аммиак только из воздуха, воды и возобновляемой электроэнергии
Первое место в списке молекул, которые исследователи электрохимии хотят получить таким образом, занимает аммиак.Ежегодно производится около 175 миллионов тонн аммиака, ключевого ингредиента синтетических удобрений. Но огромные количества, в которых он производится, и энергоемкий характер его производства означают, что аммиачные заводы потребляют примерно 2% мирового производства энергии и производят аналогичную долю глобальных выбросов углекислого газа.
В условиях быстро растущей доступности возобновляемой электроэнергии исследователи могут увидеть альтернативный путь к аммиаку. «В том будущем мире, о котором мы мечтаем, мы могли бы производить аммиак только из воздуха, воды и возобновляемой электроэнергии», — говорит Мантирам.В этом году лаборатория Мантирама присоединилась к немногим во всем мире, чтобы окончательно продемонстрировать, что аммиак может быть получен с помощью литиевого электрокатализатора.
В молодой области исследований, в которой ранние заявления об электрохимическом производстве аммиака часто не выдерживали критики, несколько надежных результатов, связанных с производством лития-опосредованного аммиака, могут сформировать прочный фундамент, на котором начинает строиться будущее чистого аммиака.
Разделяющая головная боль
Большая проблема синтеза аммиака, электрохимического или другого, заключается в том, чтобы взять диазот из воздуха и разбить его на две части.Тройная связь, удерживающая два атома азота вместе, является одной из самых прочных из известных.
За прошедшее столетие аммиачные заводы преодолели нежелание диазота реагировать посредством двухэтапного процесса. На первом этапе реакции парового риформинга метана вода и метан нагреваются над катализатором, который способствует обмену атомными партнерами, образуя поток диоксида углерода и водорода. Затем водород реагирует с азотом над железным катализатором в процессе Габера-Боша, названном в честь немецких химиков Фрица Габера, изобретшего реакцию, и Карла Боша, который усовершенствовал ее для промышленности.
Большая часть нашего неравенства в доступе к продовольствию в мире восходит к тому факту, что производство аммиака централизовано
Хабер обнаружил способ обойти проблему, заключающуюся в том, что при высоких температурах, необходимых для расщепления диазота, равновесие образования аммиака находится далеко слева, — говорит Иб Чоркендорф, исследователь катализа из Технического университета Дании и директор компании Villum. Центр науки об устойчивом топливе и химикатах.«Большое изобретение Габера заключалось в том, чтобы понять, что вы не получите никакого аммиака, если не закроете его под давлением», — говорит Чоркендорф. «Если вы возьмете четыре моля газа и превратите их в два, давление очень поможет». Сегодня заводы Haber Bosch обычно работают при давлении, превышающем 200 атмосфер.
Стехиометрический диоксид углерода, производимый реакцией, а также выбросы углерода, участвующие в создании требуемых высоких температур и давлений, являются одной из веских причин искать альтернативный подход.«Но даже если бы углекислый газ не был газом, улавливающим инфракрасное излучение и приводящим к глобальному потеплению, у нас все равно были бы проблемы с этим процессом», — говорит Мантирам. «Действительно высокие температуры и давления означают, что эту реакцию просто невозможно проводить распределенным образом».
Стоимость строительства реакторов высокого давления сильно нарушает экономическое равновесие в сторону строительства очень больших централизованных аммиачных заводов. «Большая часть нашего неравенства в доступе к продовольствию в мире восходит к тому факту, что производство аммиака централизовано», — говорит Мантирам.«В странах Африки к югу от Сахары инфраструктура распределения настолько бедна, что удобрения в конечном итоге стоят в два-три раза дороже, чем в среднем по миру. Это ограничивает его использование, что приводит к низкой урожайности, голоду, снижению производительности труда, снижению заработка, что еще больше ограничивает возможность позволить себе удобрения. Это огромная проблема, которую необходимо решить ».
Аммиак, производимый из воздуха, воды и возобновляемой электроэнергии при температуре и давлении окружающей среды, может производиться везде, где это необходимо.
Ощущение притяжения возобновляемых источников энергии
Исследователи десятилетиями пытались найти более экологичные альтернативы реакции Габера – Боша.На этот раз разница заключается в быстро меняющемся энергетическом рынке, — говорит Дуг Макфарлейн, химик из Университета Монаша, возглавляющий Центр передового опыта в области электроматериалов при Австралийском исследовательском совете. «За последние 10 лет или около того стало доступно все больше и больше недорогих возобновляемых источников энергии», — говорит Макфарлейн. С 2010 года цена на солнечную энергию упала на 80%, а на энергию ветра — на 50% с перспективой дальнейшего падения. «Это позволило сфокусироваться на электрохимических технологиях в очень широком смысле с использованием электронов в качестве конечного восстановителя», — говорит он.
Лаборатория Макфарлейна, как и многие лаборатории электрохимического синтеза, изначально была сосредоточена на химии расщепления воды на основе возобновляемых источников энергии, чтобы произвести поток чистого водорода, который можно было бы использовать в качестве сырья или топлива. По его словам, вторая волна исследований была сосредоточена на сокращении выбросов углекислого газа, чтобы превратить выбросы углерода в полезные продукты. «Исходя из этого, около шести лет назад мы начали понимать, что у наших исследований есть третья перспектива, а именно сокращение содержания азота», — говорит Макфарлейн.«Это те же идеи, тот же лабораторный набор, но другой субстрат и целевой продукт». Вместо водорода клетка будет производить поток аммиака.
Производство аммиака может выйти далеко за рамки использования удобрений. Падение цен на электроэнергию из-за возобновляемых источников энергии уже побудило переосмыслить традиционную реакцию парового риформинга (см. Вставку «Реформирование электроэнергии» ниже). Такие страны, как Австралия, которые имеют солнечные и ветровые ресурсы, намного превосходящие их собственные потребности, рассматривают электрохимически синтезированный аммиак не только для производства более чистых удобрений, но и в качестве зеленого топлива, которое могло бы обеспечить экспорт возобновляемой энергии.
В мае 2020 года Макфарлейн и его коллеги опубликовали дорожную карту, излагающую потенциальный путь к зеленой аммиачной экономике. Концепция первого поколения, идея сочетания обычного производства аммиака с улавливанием углерода, уже заменяется подходом второго поколения, в котором водород для Хабера-Боша поступает из электрохимического расщепления воды на возобновляемых источниках энергии, а не из метана. приводной паровой риформинг.
После десятилетий исследований электрохимическое расщепление воды достигло той точки, когда становятся доступными водоразделители промышленного масштаба от таких компаний, как ITM-Power в Великобритании и Siemens в Германии.Компания Siemens уже протестировала концепцию сочетания разделения воды и Габера-Боша на демонстрационной установке зеленого аммиака Siemens в Оксфордшире. В регионе Пилбара в Западной Австралии, который получает одни из самых высоких годовых объемов солнечной энергии в мире, Yara Fertilizers также готовится к пилотному переходу. В настоящее время этот завод производит 5% мирового аммиака.
Основным препятствием для широкого внедрения производства аммиака второго поколения больше не является стоимость возобновляемой электроэнергии, говорит Макфарлейн.«Барьер — это капитальные затраты на электролизеры», — говорит он. В наиболее эффективных электродах для разделения воды используются драгоценные металлы.
Электрическое преобразование
Первым шагом в обычном синтезе аммиака является получение водорода, который будет объединен с диазотом для получения аммиака. Сегодня этот водород поступает из метана в результате реакции парового риформинга, приводимой в действие множеством газовых горелок, окружающих покрытые катализатором трубы, в которых происходит реакция.
Количество катализатора можно уменьшить на порядок
Паровой риформинг настолько эндотермичен, что создает значительный температурный градиент внутри трубы, что может привести к накоплению углерода на поверхности катализатора и закупорке или даже разрыву трубы.
В 2019 году Чоркендорф показал, что реакция может быть более эффективной за счет омического нагрева. При пропускании электрического тока через стальную трубу установки парового риформинга на месте выделяется тепло из-за удельного электрического сопротивления.«Мы получаем очень тесный контакт между источником нагрева и катализатором, что устраняет все проблемы с переносом тепла, и у нас вообще отсутствует температурный градиент», — говорит Чоркендорф.
Помимо предотвращения отложения углерода, омический нагрев дает много преимуществ, добавляет Чоркендорф. На запуск установки парового риформинга обычно уходит около недели, а для системы с омическим нагревом — около двух минут. «Количество катализатора можно уменьшить на порядок, а размер завода — на два порядка», — говорит он.Раньше из-за стоимости электричества омическое отопление было непомерно дорогим, но с возобновляемыми источниками это уже не так, говорит Чоркендорф. По его словам, компания, с которой Chorkendorff сотрудничал для проведения исследований, уже работает над пилотной установкой и имеет планы по омическому нагреву далеко за пределами парового риформинга.
Стоимость резки
Поиск более дешевых альтернатив платиновым и иридиевым электродам был давней целью лаборатории Черкендорфа. В 2005 году команда показала, что сульфид молибдена является сильным электрокатализатором реакции выделения водорода.Каталитически активная часть MoS 2 оказалась вдоль краев катализатора, а не на его плоской поверхности, что побудило множество исследований по разработке наноструктурированных или слоистых материалов MoS 2 , которые максимально увеличивают долю краев.
Мы знаем, что катализатор OER должен быть оксидом, и он должен быть стабильным до экстремальных значений pH
«Мы много изучали выделение водорода, но считаем, что это решено — есть несколько очень хороших катализаторов», — говорит Чоркендорф.«Настоящая проблема заключается в потерях энергии из-за выделения кислорода», — утверждает он. Водоразделительные элементы производят водород на катоде и кислород на аноде (см. Вставку «Тем временем на аноде» ниже). Низкая эффективность реакции выделения кислорода (OER) водоразделителя делает весь процесс более энергоемким и дорогостоящим в эксплуатации. «Сегодня они работают с максимальной эффективностью 70%, но обычно не такой высокой».
Несмотря на годы работы, прорыв в разработке катализаторов OER еще не наступил.«Ничто не говорит о том, что мы не можем найти материал, но мы знаем, что он становится плотным — мы знаем, что это должен быть оксид, он должен быть стабильным либо в сильной кислоте, либо в сильном щелочном растворе», — говорит Чоркендорф. Электролизеры работают при той или иной крайности шкалы pH, чтобы максимизировать эффективность, но наиболее активные катализаторы OER недостаточно стабильны в этих условиях для длительного практического использования.
Одна концепция, представленная Дэниелом Ночера, работавшим тогда в Массачусетском технологическом институте в США, — это самовосстанавливающиеся катализаторы ООР, которые образуются на месте и непрерывно регенерируются из ионов металлов в электролите.Электрокатализаторы Nocera работали в нейтральных условиях. В 2019 году Макфарлейн и его коллеги продемонстрировали самовосстанавливающийся катализатор OER на основе смешанных оксидов металлов, созданный на месте, для сильнокислых условий.
Между тем на аноде
Для большинства электрохимических процессов — производства водорода или аммиака или восстановления углекислого газа — все внимание обращено на катод. Сопутствующая реакция, происходящая на аноде, представляет собой окислительный процесс, который обычно генерирует кислород, безвредный побочный продукт основного события.
«Многие люди считают кислород просто ненужным продуктом», — говорит Чоркендорф. Но у газа есть потенциально ценные применения. Поток чистого кислорода является ключом к концепции кислородно-топливных электростанций, которые позволяют обойти проблемы улавливания углерода за счет сжигания топлива в кислороде, а не в воздухе. «Если вы сжигаете биомассу в силовой установке с этим кислородом, вы получаете гораздо более высокое содержание углекислого газа», — говорит Чоркендорф.
Мантирам также видит ценность в анодной реакции. «Мы работали над методами, с помощью которых можно было бы использовать этот кислород для химического синтеза, вместо того, чтобы пытаться объединить два атома кислорода для получения дикислорода, что кинетически сложно сделать.«Из предыдущей работы команда знала, что оксид марганца является катализатором, который окисляет воду, образуя оксо-частицы марганца в процессе. «Что, если бы мы могли перехватить это, используя олефин, чтобы сделать эпоксид?» — спрашивает Мантирам. «Это было чисто предположение, но каким-то образом оно сработало». Помимо производства эпоксидов, команда показала, что он может вставлять кислород в углерод-углеродную связь для образования лактонов. «Это могло бы сделать водный электролизер более экономически целесообразным», — говорит Мантирам. «Невозможно сделать весь водород в мире таким способом — у нас слишком большая потребность в водороде — но мы могли бы сделать немного водорода, который действительно дешев, при совместном создании лактонов, которые идут в биоразлагаемые пластмассы в больших объемах, или в высокоэффективный водород. объемные эпоксиды для получения этиленгликоля.’
Ненадежные источники
С учетом того, что разделение воды еще предстоит усовершенствовать, и с учетом продолжающейся зависимости от реакции Габера-Боша, есть надежда, что производство зеленого аммиака второго поколения станет ступенькой к конечной цели производства аммиака непосредственно с помощью электрохимических средств. Вместо того, чтобы производить газообразный дигидроген, атомы водорода и азота можно было бы объединить на месте на катоде для получения аммиака.
Основная задача — найти способы сделать производство аммиака более предпочтительным, чем образование дигидрогена, — объясняет Мантирам.«Резервуар электронов на катоде может реагировать с двумя протонами в растворе с образованием водорода; или вместо этого реагировать с азотом, чтобы разорвать тройную связь, а также привлечь шесть протонов, чтобы образовать две молекулы аммиака », — говорит Мантирам. «Практически любой катализатор будет производить больше водорода, чем аммиак».
За последние пять лет или около того, появился поток статей, в которых, казалось, были показаны катализаторы, способные производить некоторое количество аммиака в потоке преимущественно газообразного водорода, производимого на катоде.Тем временем лаборатория Макфарлейна проверяла идею о том, что хорошим способом подавления производства водорода было бы устранение одного из основных источников протонов — электролита. Переключившись на апротонный ионный жидкий электролит, а затем просто добавив контролируемое количество воды, кислоты или основания, команда показала, что они могут способствовать производству аммиака.
Практически любой катализатор будет производить больше водорода, чем аммиак
«Апротическая работа совершенно не зависит от катализатора, поэтому наш подход всегда заключался в применении ее к лучшему катализатору, который мы могли найти», — говорит Макфарлейн.«Всякий раз, когда публиковалась статья о новом катализаторе, мы быстро пытались повторить литературную работу, а затем применять ее в своей апротической работе. В некоторой степени разочарование, в некоторых случаях после разговора с вовлеченными авторами, нам так и не удалось найти в литературе катализатор для хорошей работы. В итоге мы стали экспертами в том, что не работает ».
Хотя преобразовать азот в аммиак очень сложно, слишком легко получить следы аммиака из других источников азота. Длинный список возможных источников случайного азота включает электрод или следы NO или NO 2 в газообразном азоте.Исключите или учитывайте эти источники, и количество азота, превращаемого в аммиак большинством каталитических систем, настолько мало, что не представляет практического интереса, говорит Макфарлейн.
«[Макфарлейн] был большим сторонником выяснения того, откуда на самом деле поступает аммиак и действительно ли катализатор выполняет свою работу», — говорит Лорен Гринли из Университета Арканзаса в США, которая была одной из первых, кто работы по электрокаталитическому производству аммиака и одними из первых, кто подчеркнул, что случайный аммиак является серьезной проблемой.«Непосредственное преобразование диазота в две молекулы аммиака на поверхности катализатора — очень сложная проблема, и я не знаю, насколько мы близки к ее решению».
На данный момент Гринли отказался от экспериментов по производству аммиака, чтобы провести более фундаментальные исследования проблемы. «Мы заинтересовались химией электролита и работали, чтобы понять химию поверхности катализатора и то, как он изменяется с этими электролитами», — говорит Гринли. «Я не обещаю ничего по поводу производства аммиака, но, надеюсь, мы узнаем много нового о катализаторе и внесем свой вклад в эту область.’
Ищем литий
Так же, как Гринли и Макфарлейн, Чоркендорф провел строгие контрольные эксперименты, в том числе с использованием радиоактивно меченного диазота, необходимые для того, чтобы показать, что производимый аммиак действительно происходит из диазота, а не из альтернативного источника азота. «Мы опубликовали метод, потому что мне надоело смотреть на все эти бумаги, в которых утверждается, что они производят аммиак, потому что они не производят его», — говорит Чоркендорф. «Я знаю только одну систему, которая производит аммиак точно, и это литий-опосредованный путь.’
Литий — единственный металл, который может спонтанно реагировать с диазотом с образованием нитрида металла, разрывая при этом тройную связь диазота. Способность лития генерировать аммиак была продемонстрирована японскими исследователями в середине 1990-х годов — единственный протокол, который Чоркендорф смог воспроизвести.
Литий-опосредованный подход к аммиаку в настоящее время является единственным, который без тени сомнения работает, соглашается Макфарлейн. Обратной стороной лития является то, что он приводит к значительному снижению энергоэффективности, требуя перенапряжения более 3 В.«Это много энергии, которая будет потрачена впустую, потеряна в виде тепла, поэтому раньше она не использовалась и не развивалась», — говорит Макфарлейн.
Но что у протокола есть, так это то, что он определенно работает — и предлагает множество направлений для будущих исследований. «На данный момент наш основной подход — это литиево-опосредованный подход», — говорит Макфарлейн. «Один из очевидных способов решения энергетической проблемы — это посмотреть на другие металлы и их нитриды металлов, которые могли бы выполнять этот процесс с меньшими затратами энергии, с меньшим отрицательным энергетическим потенциалом», — говорит он.
В лаборатории Чоркендорфа основное внимание уделяется пониманию того, что в первую очередь делает литий эффективным. «Мы прежде всего выясняем, что на самом деле находится на этой поверхности, чтобы осуществить этот процесс. Мы используем синхротрон в Стэнфорде, пытаясь построить модель этого процесса ».
Пару лет назад цены были настолько низкими, что мы даже не знали, производим ли мы аммиак.
Manthiram тем временем искал способы решить проблему эффективного взаимодействия газов в электрохимической ячейке на основе жидкости.«Мы продемонстрировали, как можно использовать газодиффузионный электрод в качестве средства для более эффективного ввода газообразного азота в реактор, преодоления транспортных ограничений и, таким образом, получения аммиака гораздо быстрее и с большей селективностью для получения аммиака по сравнению с водородом», — говорит он. Команда добилась рекордного выхода аммиака.
Пока что газодиффузионный реактор работает всего несколько минут и работает с очень высоким потенциалом. «Они вроде как заставляют это делать, но, несмотря на недостатки, мне очень нравится эта газета», — говорит Чоркендорф.«Он показывает путь вперед и необходимую науку».
У команды — и у поля — есть своя работа, чтобы превратить этот процесс в практическое решение для удобрения сельскохозяйственных культур или для хранения и транспортировки возобновляемой энергии, — говорит Мантирам. «Но когда мы вспоминаем, где мы были в этой области пару лет назад, показатели были настолько низкими, что мы даже не знали, производим ли мы аммиак. Мы, наконец, подошли к тому моменту, как я думаю, как показывает наша статья, что показатели настолько высоки, что на самом деле нет необходимости проводить контрольный эксперимент с меченым азотом, чтобы продемонстрировать, что аммиак существует.При таких концентрациях не может быть случайного образования аммиака ». Хотя он спешит добавить, что группа все еще проводит контрольные эксперименты.
На данный момент команда решает проблему перенапряжения, присущую литию. «Это плата, которую нужно заплатить, чтобы пойти по этому пути, и мы пришли к соглашению с этой ценой, потому что нет другой системы, которая могла бы работать даже рядом с теми темпами, которых мы достигли с литием», — Мантирам. говорит. «Я был бы удивлен, если бы в следующем десятилетии не появились другие методы, которые не принесли бы такого штрафа», — добавляет он.«Но это то место, где сейчас поле».
Джеймс Митчелл Кроу, научный писатель из Мельбурна, Австралия
Синтез аммиака — обзор
7.4.1 Железные катализаторы
Железные катализаторы состоят в невосстановленной форме из оксидов железа (в основном магнетита) и нескольких процентов Al, Ca и K; другие элементы, такие как Mg и Si, также могут присутствовать в небольших количествах. Активация обычно осуществляется in situ восстановлением синтез-газом.Предварительно восстановленные катализаторы также коммерчески доступны.
Эти катализаторы широко изучались в последние годы, что позволило выяснить механизм каталитической реакции азота и водорода с образованием аммиака (Ozaki and Kenichi, 1979). После 1980-х годов, с развитием большого разнообразия методов науки о поверхности, включая Оже-электронную спектроскопию, рентгеновскую фотоэлектронную спектроскопию, измерения работы выхода, адсорбцию и десорбцию с программированием температуры, сканирующую туннельную микроскопию и другие; можно было исследовать кинетику адсорбции и десорбции азота и водорода, а также идентифицировать адсорбированные промежуточные соединения.Результаты этих экспериментов позволяют четко идентифицировать механизм синтеза аммиака в диапазоне давлений, представляющем промышленный интерес (Somorjai, Li, 2010).
Синтез аммиака по процессу Габера-Боша, как и любая каталитическая газофазная реакция, можно разделить на следующие стадии:
- (1)
Транспорт реагентов путем диффузии и конвекции из основного газа поток через ламинарный пограничный слой к внешней поверхности частиц катализатора и далее через систему пор к внутренней поверхности (стенкам пор)
- (2)
Адсорбция реагентов (и каталитических ядов) на внутренняя поверхность
- (3)
Реакция адсорбированных частиц, если необходимо, с участием водорода из газовой фазы, с образованием активированных промежуточных соединений
- (4)
Десорбция аммиака, образовавшегося в газовая фаза
- (5)
Транспортировка аммиака через систему пор и ламинарный пограничный слой в основной поток газа
Ранее учебные материалы (Front Дело, 1959; Emmett and Brunauer, 1937) уже предположили, что на железных катализаторах адсорбция и диссоциация азота могут рассматриваться как этап, определяющий скорость внутренней реакции: это предположение является решающим при представлении кинетики реакции синтеза.Транспортные процессы, происходящие в порах катализатора в соответствии с классическими законами диффузии, имеют важное значение в промышленном синтезе.
Состав катализатора. Как было сказано ранее, основным компонентом катализаторов на основе железа является более или менее стехиометрический магнетит, Fe 3 O 4 , который после восстановления превращается в каталитически активную форму α-железа. Степень окисления промышленных катализаторов оказывает значительное влияние на их каталитические свойства, поэтому для получения оптимального состава катализатора необходим тщательный контроль производственного процесса, особенно условий плавления, которые определяют содержание кислорода.Митташ в 1909 году установил, что катализаторы, полученные путем восстановления фазы магнетита, превосходят катализаторы, полученные из других оксидов; кроме того, для промышленных катализаторов самые высокие выходы аммиака наблюдаются при соотношении Fe (II) –Fe (III) 0,5–0,6, что примерно соответствует степени окисления магнетита со стехиометрическим составом (Larson and Brooks, 1926).
Обычно катализаторы содержат различные количества оксидов алюминия, калия, кальция, магния и кремния в качестве промоторов.В патентах рекомендуется добавлять натрий (Gens, 1980), бериллий, ванадий, уран (Gourdier et al., 1972) или платину (Carter and Savini, 1969). Катализаторы, запатентованные Lummus (Sze, 1976) и Ammonia Casale, содержат церий в качестве дополнительного промотора. ICI и Grande Paroisse (Sze and Wang, 1976; Fuglerud and Skaugset, 1999) разработали кобальтсодержащий катализатор.
Размер и форма катализатора. Свеже восстановленные промышленные железные катализаторы, содержащие оксиды алюминия, калия и кальция в качестве основных промоторов, состоят из первичных кристаллитов размером приблизительно 30 нм.Помимо максимума с радиусом пор около 10 нм, который возникает при восстановлении фазы Fe 3 O 4 (магнетит) непористого оксидного катализатора, кривая распределения пор обычно показывает пик при 25-50 нм, который составляет образуются при восстановлении фазы вюстита (Nielsen, 1971). Объем пор составляет примерно 0,09–0,1 см 3 / г, с кажущейся плотностью 4,8–4,9 г / см 3 , и, соответственно, поры составляют 44–46% от объема гранулы катализатора. Поверхность стенок пор, так называемая внутренняя поверхность, составляет около 15 м 2 / г.Новый катализатор AmoMax, разработанный Süd-Chemie, основан на железе, но использует вюстит вместо магнетита и имеет улучшенную структуру пор и более высокую удельную поверхность. Оже-спектроскопические исследования восстановленных катализаторов BASF и Topsøe выявляют большие локальные различия в составе (Nielsen, 1981), показывая большие, очевидно гомогенные области, возникшие в результате восстановления кристаллитов Fe 3 O 4 , которые чередуются с образовавшимися неоднородными областями. восстановлением кристаллов FeO или состоят из аморфных фаз.
Обширные исследования, проведенные в последнее десятилетие, позволили получить более точную картину морфологии активного катализатора (восстановленное состояние) и его предшественника (оксидное состояние) (Jennings, 2013).
Влияние промоутеров. Промоторы можно разделить на разные группы в зависимости от конкретного действия оксидов металлов:
- —
Структурные стабилизаторы , такие как Al 2 O 3 , образуют высокую внутреннюю поверхность во время восстановления и стабилизируют он подвергается термическому напряжению, сдерживая рост кристаллитов железа.Способность различных оксидов металлов создавать высокую удельную поверхность уменьшается в следующем порядке (Dry et al., 1966): Al 2 O 3 > TiO 2 > Cr 2 O 3 > MgO> MnO = CaO> SiO 2 > BeO.
- —
Электронные промоторы , такие как оксиды щелочных металлов, увеличивают удельную активность (в расчете на единицу поверхности) железо-глиноземных катализаторов. Однако они уменьшают внутреннюю поверхность или понижают температурную стабильность и устойчивость к кислородсодержащим каталитическим ядам.В серии щелочных металлов промоторный эффект увеличивается с увеличением атомного радиуса, а деструктивный эффект — с уменьшением атомного радиуса. Стремясь улучшить активность или стабильность железных катализаторов, было исследовано множество структурных и электронных промоторов, в том числе оксиды редкоземельных элементов, такие как Sm 2 O 3 , Ho 2 O 3 , Dy 2 O 3 и Er 2 O 3 .
- —
Оксиды промотора , которые восстанавливаются до металла в процессе активации и образуют сплав с железом, представляют собой особую группу: среди тех, которые используются в промышленности, кобальт представляет особый интерес (Stoltze, 1995).
Эффект данного промотора зависит от концентрации, типа комбинации промоторов и рабочих условий, особенно от температуры реакции и чистоты синтез-газа.
При нормальных условиях эксплуатации (14–45 МПа, 380–550 C и 10 000–20 000 м 3 м — 3 ч — 1 (STP)) оптимальной активности соответствует состав 2,5% –3,5% CaO, 2,3% –5,0% Al 2 O 3 , 0,8% –1,2% K 2 O и 0–1.2% SiO 2 . Повышение или понижение концентрации конкретного оксида вызывает снижение активности; в частности, модификации концентраций оксида калия и алюминия имеют особенно сильное влияние, в то время как добавление оксида магния снижает эффективность катализатора. Менее активные, но более устойчивые к ядам и температуре катализаторы, содержащие до 3,6% оксида магния, были рекомендованы для более старых установок, например, для классических установок Казале, которые работали при давлении до 80 МПа (800 бар) и на которых достигалась конечная температура катализатора. 650 ° С.Промышленный катализатор для рабочих температур до 550 ° C устойчив к износу на 2–5% V 2 O 5 кроме 3,5% –4,0% Al 2 O 3 , 2,0–2,5% CaO , и 0,7% K 2 O. Для более высоких рабочих температур рекомендуется еще более высокое содержание V 2 O 5 . Добавки диоксида кремния смещают оптимальную концентрацию оксида калия в сторону более высоких значений.
Весь опубликованный опыт демонстрирует, что невозможно объединить в катализаторе высокую термическую стабильность с легкой восстанавливаемостью и высокой активностью при низких температурах.Следовательно, может быть выгодно использовать комбинацию активных и термостойких катализаторов в одном конвертере.
Размер и форма катализатора. Выбор размера и формы частиц промышленных аммиачных катализаторов в основном определяется двумя факторами:
- (1)
Характеристики катализатора
- (2)
Падение давления
Идеальный размер Размер частиц катализатора составляет около 1-2 мм, но такой малый размер частиц увеличивает падение давления и риск деструктивного псевдоожижения катализатора.Для процессов, работающих при давлениях 25–45 МПа (250–450 бар) и объемных скоростях 8000–20 000 м 3 м — 3 ч — 1 (STP), размер зерна 6–10 мм является предпочтительным. Более крупные гранулы, например, 8–15 мм или 14–20 мм, используются только на установках, где необходим минимально возможный перепад давления из-за очень высоких скоростей газа. В каталитических зонах, в которых скорость образования аммиака настолько высока, что превышаются допустимые пределы температуры, может быть выгодным использование крупных частиц для подавления реакции.Преобразователи с радиальным потоком и преобразователь Келлог с горизонтальным поперечным потоком, которые работают при сравнительно низких скоростях газа, позволяют использовать небольшие гранулы (1,5–3 или 2–4 мм) при оптимальном использовании объема преобразователя. Процессы с псевдоожиженным слоем, которые исследовались особенно в Советском Союзе, пока не увенчались успехом.
Два эффекта вызывают низкую производительность крупнозернистого катализатора:
- (1)
Крупный размер зерна замедляет перенос аммиака изнутри частицы в объемный поток газа, потому что это происходит только за счет медленной диффузии через система пор, что снижает скорость реакции.При высокой скорости реакции, характерной для входного слоя конвертера, в реакции участвует только поверхностный слой из зерен катализатора толщиной около 1-2 мм.
- (2)
В оксидном состоянии только одно зерно катализатора восстанавливается снаружи внутрь частицы: водяной пар, образующийся внутри зерна при восстановлении, встречает уже восстановленный катализатор на своем пути к внешняя поверхность частицы, вызывающая серьезную перекристаллизацию. Эффект очень значительный.Например, если размер частиц увеличивается примерно с 1 до 8 мм, внутренняя поверхность уменьшается с 11–16 до 3–8 мкм. 2 / г.
Восстановление катализатора. Для обеспечения максимальной эффективности катализатора необходимо соблюдать определенную процедуру восстановления. Прежде всего, парциальное давление образующегося водяного пара должно поддерживаться как можно более низким; кроме того, водяной пар не должен «касаться» областей, которые уже были восстановлены. Высокая температура и высокое парциальное давление водяного пара заметно ускоряют преждевременное старение катализатора из-за перекристаллизации.Следовательно, восстановление следует проводить при высоких скоростях газа (около 5000–15000 м 3 м — 3 ч — 1 (STP)), при самых низких температурах, достаточных для полного восстановления, и при не слишком высоких давлениях. (7–12 МПа в установках низкого давления и 25–30 МПа в установках высокого давления), что обеспечивает лучший контроль экзотермического образования аммиака во время восстановления. Когда восстановление оксидного катализатора осуществляется на производственных предприятиях, требуется длительное время восстановления при низких температурах и низких давлениях с вытекающими отсюда потерями производительности.
В атомном масштабе реакция контролируется двумя процессами:
- (1)
Металлическое железо образуется из вюстита в результате прямой химической реакции (7.10), контролируемой в начальной фазе скоростью реакции (энергия активации ок. 65 кДж / моль) и на заключительной стадии за счет процессов диффузии с участием водорода и воды на участке реакции:
(7,10) FeO + h3 → Fe + h3O
- 2.
В результате химической реакции образуется железо ( II) градиент концентрации ионов в твердом теле.Этот градиент приводит к быстрой диффузии ионов железа (II) из магнетита через вюстит к границе химической реакции, где они восстанавливаются и осаждаются в виде ядер железа. Это стало возможным из-за структурных дефектов вюстита. Осаждение дополнительных зародышей вюстита на границе реакции магнетит / вюстит, по-видимому, происходит за счет процессов диффузии ионов / электронов, а не за счет прямого контакта магнетита с водородом ((7.11) и (7.12)):
(7.11) O2− + h3 → h3O + 2e−
(7.12) Fe3O4 + Fe2 ++ 2e- → 4FeO
Катализаторные яды. Активность катализатора синтеза аммиака может быть снижена некоторыми веществами, так называемыми ядами. Эти вещества могут быть незначительными газообразными составляющими синтез-газа или твердыми веществами, вводимыми в катализаторы во время производственной процедуры, происходящими из примесей в природном магнетите, из которого изготовлен катализатор.
